Ogljik
 Grafit (levo) in diamant (desno), dva ogljikova alotropa | ||||||||||||||||||||||||||
| Ogljik | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [ɔɡˈljiːk] | |||||||||||||||||||||||||
| Alotropi | grafit, diamant in drugi | |||||||||||||||||||||||||
| Videz |
| |||||||||||||||||||||||||
| Standardna atomska teža Ar, std(C) | [12,0096; 12,0116] običajno: 12,011 | |||||||||||||||||||||||||
| Ogljik v periodnem sistemu | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Vrstno število (Z) | 6 | |||||||||||||||||||||||||
| Skupina | skupina 14 (ogljikova skupina) | |||||||||||||||||||||||||
| Perioda | perioda 2 | |||||||||||||||||||||||||
| Blok | blok p | |||||||||||||||||||||||||
| Razporeditev elektronov | [He] 2s2 2p2 | |||||||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 4 | |||||||||||||||||||||||||
| Fizikalne lastnosti | ||||||||||||||||||||||||||
| Faza snovi pri STP | trdnina | |||||||||||||||||||||||||
| Sublimišče | 3642 °C | |||||||||||||||||||||||||
| Gostota (blizu s.t.) | amorfen: 1,8–2,1 g/cm3[1] grafit: 2,267 g/cm3 diamant: 3,515 g/cm3 | |||||||||||||||||||||||||
| Trojna točka | 4.330 °C, 10.800 kPa[2][3] | |||||||||||||||||||||||||
| Talilna toplota | grafit: 117 kJ/mol | |||||||||||||||||||||||||
| Toplotna kapaciteta | grafit: 8,517 J/(mol·K) diamant: 6,155 J/(mol·K) | |||||||||||||||||||||||||
| Lastnosti atoma | ||||||||||||||||||||||||||
| Oksidacijska stanja | −4, −3, −2, −1, 0, +1,[4] +2, +3,[5] +4[6] (rahlo kisel oksid) | |||||||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 2,55 | |||||||||||||||||||||||||
| Ionizacijske energije |
| |||||||||||||||||||||||||
| Kovalentni polmer | sp3: 77 pm sp2: 73 pm sp: 69 pm | |||||||||||||||||||||||||
| Van der Waalsov polmer | 170 pm | |||||||||||||||||||||||||
| Druge lastnosti | ||||||||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | |||||||||||||||||||||||||
| Kristalna struktura | grafit: preprosta heksagonalna (črna) | |||||||||||||||||||||||||
| Kristalna struktura | diamant: diamantna kubična (brezbarvna) | |||||||||||||||||||||||||
| Hitrost zvoka tanka palica | diamant: 18,350 m/s (pri 20 °C) | |||||||||||||||||||||||||
| Temperaturni raztezek | diamant: 0,8 µm/(m⋅K) (pri 25 °C)[7] | |||||||||||||||||||||||||
| Toplotna prevodnost | grafit: 119–165 W/(m⋅K) diamant: 900–2300 W/(m⋅K) | |||||||||||||||||||||||||
| Električna upornost | grafit: 7,837 µΩ⋅m[8] | |||||||||||||||||||||||||
| Magnetna ureditev | diamagnetik[9] | |||||||||||||||||||||||||
| Magnetna susceptibilnost | −5,9·10−6 (graf.) cm3/mol[10] | |||||||||||||||||||||||||
| Youngov modul | diamant: 1050 GPa[7] | |||||||||||||||||||||||||
| Strižni modul | diamant: 478 GPa[7] | |||||||||||||||||||||||||
| Stisljivostni modul | diamant: 442 GPa[7] | |||||||||||||||||||||||||
| Poissonovo razmerje | diamant: 0,1[7] | |||||||||||||||||||||||||
| Mohsova trdota | grafit: 1–2 diamant: 10 | |||||||||||||||||||||||||
| Številka CAS |
| |||||||||||||||||||||||||
| Zgodovina | ||||||||||||||||||||||||||
| Odkritje | Egipčani in Sumerci[11] (3750 pr. n. št.) | |||||||||||||||||||||||||
| Kot element prepoznal | Antoine Lavoisier[12] (1789) | |||||||||||||||||||||||||
| Najpomembnejši izotopi ogljika | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Ogljík (izpeljano iz oglje) je kemični element s simbolom C in atomskim številom 6. Element je nekovina in tetravalenten – štirje prosti elektroni kovalentne kemične vezi. Spada v 14. skupino periodnega sistema.[13] Ogljik predstavlja le približno 0,025 odstotka zemeljske skorje.[14] Trije izotopi so prisotni v naravi, 12C in 13C sta stabilna, medtem ko je 14C radionuklid, ki razpada z razpolovno dobo približno 5.730 let.[15] Ogljik je eden redkih elementov, ki so jih poznali že v antiki.[16][17][18]
Ogljik je 15. najbolj razširjeni element v zemeljski skorji in četrti najbolj razširjeni element v vesolju po masi za vodikom, helijem in kisikom. Pogostnost ogljika, edinstvena raznolikost njegovih organskih spojin in nenavadna sposobnost tvoriti polimere pri temperaturah, ki jih pogosto najdemo na Zemlji, omogočajo temu elementu, da je osnova vsega znanega življenja. Po kisiku je drugi masni element v človeškem telesu (približno 18,5 %).[19]
Atomi ogljika se lahko med seboj vežejo na različne načine, kar ima za posledico različne alotrope ogljika. Najbolj znani alotropi so grafit, diamant, grafen in buckminsterfullereni.[20] Fizične lastnosti ogljika se zelo razlikujejo glede na alotropno obliko. Grafit je na primer neprozoren in črn, diamant pa bister in visoko prozoren. Grafit je po eni strani dovolj mehak, da na papirju zapusti sled (od tod tudi njegovo ime iz grškega glagola "γράφειν", kar pomeni »pisati«), diamant po drugi strani pa je najtrši naravni material, ki ga poznamo. Grafit je dober električni vodnik, medtem ko ima diamant nizko električno prevodnost. V normalnih pogojih imajo diamant, ogljikove nanocevke in grafen najvišjo toplotno prevodnost od vseh znanih materialov. Vsi ogljikovi alotropi so v normalnih pogojih trdne snovi, pri tem je grafit najbolj termodinamično stabilna oblika pri standardni temperaturi in tlaku. So kemično odporni in za reakcijo s kisikom zahtevajo visoko temperaturo.
Najpogostejše oksidacijsko stanje ogljika v anorganskih spojinah je +4, medtem ko +2 najdemo v ogljikovem monoksidu in karbonilnih kompleksih prehodnih kovin. Največji viri anorganskega ogljika so apnenci, dolomiti in ogljikov dioksid, vendar je velike količine najti v organskih nahajališčih premoga, šote, nafte in metanskih klatratov. Ogljik tvori veliko število spojin, več kot kateri koli drug element – opisanih je skoraj deset milijonov ogljikovih spojin,[21] kar pa je le majhen del teoretično možnih spojin v standardnih pogojih. Zaradi tega so ogljik pogosto imenovali »kralj elementov«.[22]
Značilnosti[uredi | uredi kodo]

Med alotrope ogljika spadata grafit, ena najmehkejših znanih snovi, in diamant, najtrša snov v naravi. Z lahkoto se veže z drugimi majhnimi atomi, vključno z drugimi atomi ogljika, in lahko tvori več stabilnih kovalentnih vezi z ustreznimi večvalentnimi atomi. Znano je, da ogljik tvori skoraj deset milijonov spojin, kar je velika večina vseh kemičnih spojin, kar jih poznamo.[21] Ogljik ima tudi najvišjo sublimacijsko točko med vsemi elementi. Pri atmosferskem tlaku nima tališča, saj je njegova trojna točka 108 ± 02 MPa (1.066 ± 20 atm; 15.660 ± 290 psi) in 4.600 ± 300 K (4.330 ± 300 °C; 7.820 ± 540 °F), tako da sublimira pri približno 3.900 K (3.630 °C; 6.560 °F).[23][24] Grafit je v običajnih pogojih veliko bolj reaktiven kot diamant, čeprav je bolj termodinamično stabilen, saj je njegov delokalizirani sistem pi veliko bolj občutljiv na napade. Grafit lahko na primer v vroči koncentrirani dušikovi kislini v standardnih pogojih oksidira v melitinsko kislino, C6(CO2H)6, ki ohranja šesterokotne enote grafita, hkrati pa razbije večjo strukturo.[25]
Ogljik sublimira v ogljikovem loku, ki ima temperaturo približno 5800 K (5.530 °C ali 9.980 °F). Tako ostaja ogljik ne glede na svojo alotropno obliko trden pri višjih temperaturah kot kovine z najvišjimi tališči, kot sta volfram ali renij. Čeprav je termodinamično nagnjen k oksidaciji, se ogljik učinkoviteje upira oksidaciji kot na primer železo in baker, ki sta pri sobni temperaturi šibka reducenta.
Ogljik je šesti element, v osnovnem stanju ima elektronsko konfiguracijo 1s22s22p2, štirje zunanji elektroni so pri tem valenčni elektroni. Prve štiri ionizacijske energije, 1086,5, 2352,6, 4620,5 in 6222,7 kJ / mol, so veliko višje kot pri težjih elementih skupine 14. Elektronegativnost ogljika je 2,5, bistveno višja od težjih elementov skupine 14 (1,8–1,9), vendar blizu večini bližnjih nekovin, pa tudi nekaterih prehodnih kovin druge in tretje vrste. Za kovalentne polmere ogljika se običajno navaja 77,2 pm (C-C), 66,7 pm (C = C) in 60,3 pm (C≡C), čeprav se lahko razlikujejo glede na koordinacijsko število in na kaj je ogljik vezan. Na splošno se kovalentni radij zmanjšuje z nižjim koordinacijskim številom in višjim redom vezi.[26]
Ogljikove spojine so osnova vsega znanega življenja na Zemlji in ogljikov in dušikov krogotok zagotavljata del energije, ki jo dajejo Sonce in druge zvezde. Čeprav tvori izjemno raznolikost spojin, je večina oblik ogljika v običajnih pogojih razmeroma nereaktivna. Pri standardni temperaturi in tlaku se upira vsem, razen najmočnejšim oksidantom. Ne reagira ne z žveplovo kislino, ne s klorovodikovo kislino, tudi ne s klorom in nobeno alkalijo. Pri povišanih temperaturah ogljik reagira s kisikom in tvori ogljikove okside, pri tem ropa kisik iz kovinskih oksidov, da pride do nastanka elementarne kovine. Ta eksotermna reakcija se uporablja v železarski in jeklarski industriji za taljenje železa in za nadzor vsebnosti ogljika v jeklu :
- Fe
3O
4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
Ogljikov monoksid se lahko reciklira in uporabi za dodatnop taljenje železa:
- Fe
3O
4 + 4 CO(g) → 3 Fe(s) + 4 CO
2(g)
z žveplom, da nastane ogljikov disulfid in pa s paro v reakciji premog-plin:
- C (s) + H2O(g) → CO (g) + H 2(g)
Ogljik se z nekaterimi kovinami pri visokih temperaturah tvori kovinske karbide, kot je železov karbid z imenom cementit v jeklu in volframov karbid, ki se pogosto uporablja kot abraziv in za izdelavo trdih konic za rezalno orodje.
Sistem ogljikovih alotropov ima skrajnostni razponi:
| Grafit je eden najmehkejših znanih materialov. | Sintetični nanokristalni diamant je najtrši material. [27] |
| Grafit je zelo dobro mazivo, ki kaže supermazljivost. [28] | Diamant je vrhunski abraziv. |
| Grafit je prevodnik električne energije. [29] | Diamant je odličen električni izolator [30] in ima med vsemi poznanimi materiali največje prebojno električno polje |
| Nekatere oblike grafita se uporabljajo za toplotno izolacijo (npr. za protipožarno zaščito in toplotne ščite), nekatere druge oblike pa so dobri toplotni vodniki. | Diamant je najbolj znan naravni prevodnik toplote |
| Grafit je neprozoren. | Diamant je visoko prozoren. |
| Grafit kristalizira v heksagonalnem sistemu. [31] | Diamant kristalizira v kubičnem sistemu. |
| Amorfni ogljik je popolnoma izotropen. | Ogljikove nanocevke so med najbolj anizotropnimi materiali, kar jih poznamo. |
Alotropi[uredi | uredi kodo]
Atomski ogljik je zelo kratkotrajna vrsta, tako da se ogljik stabilizira v različnih alotropih, to je večatomskih strukturah z različnimi molekularnimi konfiguracijami. Trije razmeroma dobro znani alotropi ogljika so amorfni ogljik, grafit in diamant. Nekoč veljajo za eksotične, fulereni se danes pogosto sintetizirajo in uporabljajo v raziskavah; vključujejo buckyballs, [32] [33] ogljikove nanocevke,[34] ogljikove nanobrstiče[35] in nanovlakna.[36][37] Odkritih je bilo tudi več drugih eksotičnih alotrop, kot so lonsdaleit,[38] stekleni ogljik,[39] ogljikova nano-pena[40] in linearni acetilenski ogljik (karbin).[41]
Grafen je dvodimenzionalna folija ogljika z atomi, razporejenimi v šesterokotno mrežo. Grafen zglčeda spada med najmočnejše med doslej preizkušenimi materiali.[42] To mu daje veliko uporabno vrednost v elektronski industriji, kot sestavni del elektronskih komponent, pri razvoju nosilnih elementov za organske prikazovalnike ter pri razvoju gibkih mobilnih telefonov, kakor tudi pri razvoju modernih letal. Lahko se uporablja tudi za varno shranjevanje vodika za uporabo v vodikovem motorju v avtomobilih.[43]

Amorfna oblika je nabor ogljikovih atomov v nekristaliziranem, nepravilnem, steklastem stanju, brez kristalne makrostrukture. Kot prah je glavna sestavina snovi, kot so oglje, svetilke in saje ter aktivno oglje. Pri normalnih tlakih ima ogljik obliko grafita, pri katerem je vsak atom trigonalno vezan na tri druge v ravnini, sestavljeni iz spojenih šesterokotnih obročev, podobno kot pri aromatskih ogljikovodikih. [44] Nastalo omrežje je dvodimenzionalno in nastali ravni listi so zloženi in ohlapno povezani s šibkimi van der Waalsovimi silami. To daje grafitu mehkobo in lastnosti cepljenja (listi enostavno zdrsnejo drug mimo drugega). Zaradi delokalizacije enega od zunanjih elektronov vsakega atoma, da tvori π-oblak, grafit prevaja elektriko, vendar le v ravnini vsake kovalentno vezane pločevine. Posledica tega je električna prevodnost pod večino kovin. Delokalizacija je tudi vzrok za energijsko stabilnost grafita v primerjavi z diamantom pri sobni temperaturi.

Pri zelo visokih tlakih ogljik tvori bolj kompakten alotrop, diamant, ki ima skoraj dvakrat večjo gostoto kot grafit. Tu je vsak atom tetraedrsko povezan s štirimi drugimi in tvori tridimenzionalno mrežo nagubanih šesterokotnih atomskih obročev. Diamant ima enako kubično strukturo kot silicij in germanij, zaradi trdnosti vezi ogljik-ogljik pa je najtrša snov v naravi, merjena z odpornostjo na praske. V nasprotju s splošnim prepričanjem, da so diamanti »večni«, so termodinamično nestabilni (Δ fG° (diamant, 298 K) = 2,9 kJ / mol[45] ) v normalnih pogojih (298 K, 10 5 Pa) in se pretvarjajo v grafit.[20] Zaradi visoke aktivacijske energijske pregrade je prehod v grafit pri običajni temperaturi tako počasen, da ga ni mogoče opaziti. Spodnji levi kot faznega diagrama za ogljik ni bil eksperimentalno pregledan. Čeprav je računska študija z uporabo metod teoretične funkcionalne gostote prišla do zaključka, da s T → 0 K in p → 0 Pa diamant postane stabilnejši od grafita za približno 1,1 kJ / mol,[46] novejše in dokončne eksperimentalne in računske študije kažejo, da je grafit stabilnejši od diamanta za T < 400 K, brez uporabljenega tlaka, za 2,7 kJ / mol pri T = 0 K in 3.2 kJ / mol pri T = 298.15 K.[47] V nekaterih pogojih ogljik kristalizira kot lonsdaleit, heksagonalna kristalna mreža z vsemi atomi vezanimi kovalentno in z lastnostmi, ki so podobne lastnostim diamanta.[38]
Fulereni so sintetična kristalna tvorba z grafitom podobno strukturo, toda namesto ploskih šesterokotnih celic so nekatere celice, iz katerih nastajajo fulereni, lahko peterokotniki, neravninski šesterokotniki ali celo sedmerokotniki ogljikovih atomov. Listi se tako zvijejo v krogle, elipse ali valje. Lastnosti fulerenov (razdeljene na skupine buckyballs, bucky cevke in nano brstiče) še niso v celoti analizirane in predstavljajo intenzivno področje raziskav nanomaterialov. Za imena kot sta fuleren in buckyball je bil boter Richard Buckminster Fuller, popularizator geodetskih kupol, ki spominjajo na strukturo fulerenov.

Ogljikova nano-pena, odkrita 1997, je feromagneten alotrop, odkrit leta 1997. Sestavljajo jo skupine ogljikovih atomov nizke gostote, povezane v ohlapno tridimenzionalno mrežo, v kateri so atomi trigonalno povezani v šest- in sedemčlenske obroče. Z gostoto približno 2 kg/m3 spada med najlažje trdnine.[48] Podobno vsebuje tudi steklen ogljik velik delež zaprte poroznosti [39] vendar v nasprotju z običajnim grafitom grafitne plasti niso zložene kot strani v knjigi, temveč imajo bolj naključno razporeditev. Linearni acetilenski ogljik [41] ima kemično strukturo −(C:::C)n-. Ogljik je pri tej modifikaciji linearen s sp orbitalno hibridizacijo, kot polimer z izmeničnimi enojnimi in trojnimi vezmi. Ta karbin je zelo zanimiv za nanotehnologijo, saj je njegov Youngov modul 40-krat večji od najtršega znanega materiala – diamanta. [49]
Leta 2015 je ekipa z državne univerze v Severni Karolini napovedala razvoj še enega alotropa, ki so ga poimenovali Q-ogljik, ustvarjen s kratkotrajnim laserskim impulzom visoke energije na amorfnem ogljikovem prahu. Poročajo, da Q-ogljik kaže feromagnetizem, fluorescenco in trdoto, ki je boljša od diamanta.[50]
V parni fazi je nekaj ogljika prisotno v obliki dikarbona (C
2). Ekscitiran plin zasveti zeleno.
Pogostnost[uredi | uredi kodo]


Ogljik je četrti najpogostejši kemični element v opazovanem vesolju po masi za vodikom, helijem in kisikom. Julija 2020 so astronomi poročali o dokazih, da je ogljik tvorjen predvsem v belih pritlikavih zvezdah, zlasti tistih, ki so večje od dveh sončnih mas. [51] [52] Ogljika je veliko v Soncu, zvezdah, kometih in v ozračju večine planetov.[53] Nekateri meteoriti vsebujejo mikroskopske diamante, ki so nastali, ko je bil sončni sistem še protoplanetarni disk. [54] Mikroskopski diamanti lahko nastanejo tudi zaradi močnega pritiska in visoke temperature na mestih udarcev meteorita.[55]
Ocenjeno je bilo, da trdna zemlja kot celota vsebuje 730 dnm ogljika, z 2000 dnm v jedru in 120 dnm v kombiniranem plašču in skorji. [56] Ker je masa zemlje 5972, bi to pomenilo 4360 milijonov gigaton ogljika. To je veliko več kot količina ogljika v oceanih ali ozračju (spodaj).
V kombinaciji s kisikom v ogljikovem dioksidu najdemo ogljik v zemeljski atmosferi (približno 900 g gigaton ogljika - vsak dnm ustreza 2,13 Gt) in raztopljen v vseh vodnih telesih (približno 36.000 gigaton ogljika). Ogljik v biosferi je ocenjen na 550 gigaton, vendar z veliko negotovostjo, večinoma zaradi velike negotovosti glede količine podzemnih bakterij.[57] Ogljikovodiki (kot so premog, zemeljsko olje in zemeljski plin ) vsebujejo tudi ogljik. "Rezerve" premoga (ne "viri") znašajo približno 900 gigaton z morda 18.000 Gt virov.[58] Zaloge nafte so okoli 150 gigaton. Dokazani viri zemeljskega plina so približno 175 x 1012 kubičnih metrov ( približno 105 gigaton ogljika), vendar študije ocenjujejo še 900 "nekonvencionalnih" nahajališč, kot je plin iz skrilavcev, ki predstavljajo približno 540 gigaton ogljika.[59]
Ogljik najdemo tudi v metan hidratih v polarnih regijah in pod morjem. Po različnih ocenah gre za količine ogljika med 500, 2500 Gt[60] ali 3000 Gt.
V preteklosti so bile količine ogljikovodikov večje. Po navedbah enega vira je bilo v obdobju od 1751 do 2008 približno 347 gigaton ogljika sproščeno kot ogljikov dioksid v ozračje zaradi izgorevanja fosilnih goriv. [61] Drugi vir dodaja, da je bila količina dodanega ozračja za obdobje od leta 1750 na 879 Gt, skupna količina v ozračje, morje in kopno (na primer nahajališča šote) pa skoraj 2000 Gt. [62]
Ogljik je sestavni del (približno 12 mas. %) zelo velikih mas karbonatnih kamnin (apnenec, dolomit, marmor itd.). Premog je zelo bogat z ogljikom (antracit ga vsebuje 92–98 %) [63] in je največji komercialni vir mineralnega ogljika, saj predstavlja 4.000 gigaton ali 80 % fosilnega goriva. [64]
Kar zadeva posamezne ogljikove alotrope, je grafit najti v velikih količinah v ZDA (večinoma v New Yorku in Teksasu, Rusiji, Mehiki, Grenlandiji in Indiji. Naravni diamanti se pojavljajo v kamnitih kimberlitih, ki jih najdemo v starih vulkanskih "vratovih" ali "ceveh". Največ nahajališč diamantov je v Afriki, predvsem v Južni Afriki, Namibiji, Bocvani, Republiki Kongo in Sierra Leone. Nahajališča diamantov so tudi v Arkansasu v Kanadi, ruski Arktiki, Braziliji ter severni in zahodni Avstraliji. Diamante najdemo naravno, vendar je zdaj izdelanih približno 30% vseh industrijskih diamantov, ki se uporabljajo v ZDA.
Ogljik-14 se tvori v zgornjih plasteh troposfere in stratosfere na nadmorski višini 9–15 km z reakcijo, ki jo pospešujejo kozmični žarki.[65] Proizvajajo se toplotni nevtroni, ki trčijo z jedri dušika-14 in pri tem tvorijo ogljik-14 in proton. Tako 1,5%×10−10 atmosferskega ogljikovega dioksida vsebuje ogljik-14.[66]znanimi kot heteroatomi. Pogostni heteroatomi v organskih spojinah, so kisik, dušik, žveplo, fosfor in neradioaktivni halogeni, pa tudi kovine, kot litij in magnezij. Organske spojine, ki vsebujejo vezi s kovino, so znane kot organometalne spojine. Nekatere skupine atomov, pogosto s heteroatomi, je najti v velikem številu organskih spojin. Te skupine atomov, znane kot funkcionalne skupine, dajejo spojini, v katero so vgrajene, tipične značilnosti glede reaktivnosti inh drugih lastnosti. Tako vplivajo na lastnosti organskih molekul, podobno kot dolžina verig.
V najbolj stabilnih spojinah ogljika (in skoraj vseh stabilnih organskih spojinah) ogljik spoštuje pravilo okteta in je štirivalenten, kar pomeni, da atom ogljika tvori skupaj štiri kovalentne vezi (ki lahko vključujejo dvojne in trojne vezi). Izjeme so maloštevilni stabiliziranih karbokationi (tri vezi, pozitiven naboj), radikali (tri vezi, nevtralni), karbanjoni (tri vezi, negativni naboj) in karbeni (dve vezi, nevtralni), čeprav je verjetno, da bo snov te vrste nestabilen, reaktiven intermediat.
Ogljik se pojavlja v vseh znanih organskih življenjih in je osnova organske kemije. Spojen z vodikom tvori različne ogljikovodike, ki so za industrijo pomembni kot hladilna sredstva, maziva, topila, kot kemična surovina za proizvodnjo plastike in petrokemikalij ter kot fosilna goriva.
V kombinaciji s kisikom in vodikom lahko ogljik tvori številne skupine pomembnih bioloških spojin, vključno s sladkorji, lignani, hitini, alkoholi, maščobami in aromatičnimi estri, karotenoidi in terpeni. Z dušikom tvori alkaloide, z dodatkom žvepla pa tudi antibiotike, aminokisline in gumene izdelke. Z dodatkom fosforja tem drugim elementom tvori DNA in RNA, nosilca kemijske kode življenja, in adenozin trifosfat (ATP), najpomembnejšo molekulo za prenos energije v vseh živih celicah.
Anorganske spojine[uredi | uredi kodo]
Običajno spojine, ki vsebujejo ogljik in so povezane z minerali ali ne vsebujejo vezi z drugimi atomi ogljika, halogeni ali vodikom, se obravnavajo ločeno od klasičnih organskih spojin ; opredelitev ni toga in klasifikacija nekaterih spojin se lahko razlikuje od avtorja do avtorja (glej referenčne članke zgoraj). Med temi so preprosti ogljikovi oksidi. Najbolj očiten oksid je ogljikov dioksid (CO2), nekoč glavna sestavina paleoatmosfere, danes pa manjši sestavni del Zemljine atmosfere.[67] Raztopljen v vodi, tvori ogljikovo kislino (H
2CO
3), vendar je kot večina spojin z več na ogljik enojno vezanimi kisiki nestabilna. [68] Skozi ta vmesni produkt pa nastajajo resonančno stabilizirani karbonatni ioni. Nekateri od pomembnih kamenin so karbonati, v prvci vrsti kalcit.Podobno velja za ogljikov disulfid (CS
2).[25] Kljub temu ogljikov disulfid zaradi fizikalnih lastnosti in povezanosti z organsko sintezo včasih uvrščajo med organska topila.
Drugi pogosti oksid je ogljikov monoksid (CO). Nastane z nepopolnim zgorevanjem in je brezbarven plin brez vonja. Vsaka molekula vsebuje trojno vez in je dokaj polarna, kar ima za posledico težnjo, da se trajno veže na molekule hemoglobina in izpodriva kisik, ki ima manjšo afiniteto do vezave. [69] [70] Cianid (CN−) ima podobno strukturo, vendar se obnaša podobno kot halogenidni ion ( psevdohalogen). Drugi redki oksidi so ogljikov suboksid (C
3O
2),[71] nestabilni diogljkov monoksid (C2O),[72][73] ogljikov trioksid (CO3)[74][75] ciklopentanpenton (C5O5),[76] cikloheksanhekson (C6O6 ) in melitni anhidrid (C12O9). Melitni anhidrid je trojni anhidrid acil melitinske kisline; poleg tega vsebuje benzenski obroč, tako da mnogi kemiki menijo, da gre za organsko snov.
Z reaktivnimi kovinami, kot je na primer volfram, ogljik tvori bodisi karbide (C 4−) bodisi acetilide (C2−
2 ), to je zlitine z visokimi tališči. Ti anioni so povezani tudi z metanom in acetilenom, ki sta oba zelo šibki kislini. Z elektronegativnostjo 2,5 [77] ogljik raje tvori kovalentne vezi. Nekaj karbidov imajo obliko kovalentnih mrež, tako karborund (SiC), kar spominja na diamant. Kljub temu tudi najbolj polarni in solem podobni karbidi niso popolnoma ionske spojine.[78]
Organokovinske spojine[uredi | uredi kodo]
Organokovinske spojine po definiciji vsebujejo vsaj eno kovalentno vez ogljik-kovina. Obstaja širok nabor takih spojin; glavni razredi vključujejo enostavne alkil-kovinske spojine (na primer tetraetil- svinec), η2 alkenske spojine (na primer Zeisejeva sol ) in η3 alilne spojine (na primer dimer alilpaladijev klorid ); metalocene, ki vsebujejo ciklopentadienil ligande (na primer ferocen ); in kompleksi karbenov iz prehodnih kovin. Obstaja veliko kovinskih karbonilov in kovinskih cianidov (na primer tetrakarbonilnikel in kalijev fericijanid).
Čeprav naj bi, ogljik močno dajal prednost tvorbi štirih kovalentnih vezi, so znane tudi druge eksotične sheme vezi. Karborani so zelo stabilni dodekaedrski derivati z enoto [B12 H12] 2-, pri čemer je ena BH nadomeščena s CH +. Tako je ogljik vezan na pet atomov bora in en atom vodika. Kation [(Ph3 PAu)6C] 2+ vsebuje oktaedrski ogljik, vezan na šest fragmentov fosfin-zlato.[79] V naravi ima železo-molibdenov kofaktor ( FeMoco ), odgovoren za fiksiranje dušika v mikrobih, tudi oktaedrično ogljikovo sredico (formalno karbid, C (-IV)), vezano na šest atomov železa. Leta 2016 je bilo potrjeno, da v skladu s prejšnjimi teoretičnimi napovedmi dikacija heksametilbenzena vsebuje atom ogljika s šestimi vezmi. Natančneje, dikacijo bi lahko strukturno opisali s formulacijo [MeC(η5-C5Me5)] 2+, tako da struktura postane "organski metalocen ", v katerem je fragment MeC 3+ vezan na η5-C5Me5- fragment s pomočjo vseh pet ogljikovih atomov v obroču.[80]
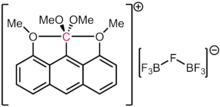
Pomembno je omeniti, da v zgornjih primerih vsaka vez na ogljik vsebuje manj kot dva formalna elektronska para. Tako formalno število elektronov teh vrst ne presega okteta. Zaradi tega so hiperkoordinatni, vendar ne hipervalentni. Tudi v primerih domnevnih vrst 10-C-5 (to je ogljik s petimi ligandi in formalnim številom elektronov deset), kot poročajo Akiba in sodelavci,[81] elektronski izračuni strukture ugotavljajo, da je populacija elektronov okoli ogljika je še vedno manj kot osem, kar velja za druge spojine s štirimi elektronskimi trosmernimi vezmi.
Zgodovina in etimologija[uredi | uredi kodo]

Ogljik je bil znan že v prazgodovini in je bil v obliki saj in oglja znan že v najzgodnejših človeških civilizacijah. Diamanti so bili znani verjetno že leta 2500 p.n.št. na Kitajskem, medtem ko je ogljik v obliki oglja okoli rimskih časov izdelovali po istem postopku kot danes, CS
2)s segrevanjem lesa v piramidi, prekriti z glino, da se izključi zrak.[82][83]

Leta 1722 je René Antoine Ferchault de Réaumur dokazal, da se železo pretvori v jeklo, če adsorbira neko snov, ki je zdaj znana kot ogljik.[84] Leta 1772 je Antoine Lavoisier pokazal, da so diamanti oblika ogljika; ko je zažgal vzorce oglja in diamantov in ugotovil, da noben od njiju ne proizvaja vode in da oba sproščata enako količino ogljikovega dioksida na gram. Leta 1779 je[85] Carl Wilhelm Scheele pokazal, da grafit ni neka oblika svinca, kot se je mislilo, temveč namesto tega identičen oglju, vendar z majhno primesjo železa, in da med oksidajo z dušikovo kislino oddaja »zračno kislino« (njegovo ime za ogljikov dioksid).[86] Leta 1786 so francoski znanstveniki Claude Louis Berthollet, Gaspard Monge in CA Vandermonde potrdili, da je grafit večinoma ogljik, tako da ga lahko oksidirajo v kisiku, podobno kot je to storil Lavoisier z diamantom.[87] Ponovno je ostalo nekaj železa, za kar so francoski znanstveniki menili, da je potrebno za grafitno strukturo. V objavi so predlagali ime Carbone (latinsko carbonum) za element v grafitu, ki je kot plin izhajal iz grafita med izgorevanjem. Antoine Lavoisier je nato v svojem učbeniku iz leta 1789 ogljik navedel kot element.[88]
Nov alotrop ogljika, fuleren, odkrit leta 1985,[89] vključuje nanostrukturirane oblike, kot so kroglice in nanocevke.[32] Njegovi odkritelji Robert Curl, Harold Kroto in Richard Smalley so leta 1996 prejeli Nobelovo nagrado za kemijo.[90] Ponovno zanimanje za nove oblike je pripeljalo do odkritja nadaljnjih eksotičnih alotropov, kot je stekleni ogljik, in spoznanja, da "amorfni ogljik" ni popolnoma amorfen.[39]
Proizvodnja[uredi | uredi kodo]
Grafit[uredi | uredi kodo]
Naravna nahajališča grafita, katerih izkoriščanje se splača, se pojavljajo v mnogih delih sveta, vendar so ekonomsko najpomembnejši viri na Kitajskem, v Indiji, Braziliji in Severni Koreji. Zaloge grafita so metamorfnega izvora, najdemo jih v povezavi s kremenom, sljudo in glinenci v škrilavcih, gnajsih in preobraženih peščenjakih in apnencih kot leče ali žile, včasih debeline enega metra ali več. Zaloge grafita v Borrowdaleu v Cumberlandu v Angliji so bile sprva dovolj velike in čiste, da so do 19. stoletja svinčnike izdelovali preprosto z žaganjem blokov naravnega grafita na trakove, ki so jih vdelali v les. Danes dobimo manjša nahajališča grafita z drobljenjem matične kamnine in flotacijo lažjega grafita na vodi.[91]
Obstajajo tri vrste naravnega grafita – amorfni, luskasti ter v žilah ali grudast. Amorfni grafit je najkakovostnejši in najbolj razširjen. V nasprotju z znanostjo se v industriji izraz »amorfen« nanaša na zelo majhno velikost kristalov in ne na popolno pomanjkanje kristalne strukture. Amorfni grafit se uporablja za grafitne izdelke nižje vrednosti in je najcenejši med grafiti. Velika nahajališča amorfnega grafita najdemo na Kitajskem, v Evropi, Mehiki in ZDA. luskasti grafit je manj pogost in kakovostnejši od amorfnega; pojavlja se v plasteh, ki so kristalizirale v metamorfni kamnini. Kosmičasti grafit je lahko štirikrat višji od cene amorfnega. Kakovostne kosmiče lahko predelamo v grafit, ki ga je mogoče razširiti za številne namene, kot so zaviralci gorenja. Najpomembnejše nahajališča najdemo v Avstriji, Braziliji, Kanadi, na Kitajskem, v Nemčiji in na Madagaskarju. Žilni ali grudasti grafit je najredkejša, najbolj dragocena in najkakovostnejša vrsta naravnega grafita. Pojavi se v žilah vzdolž intruzij v trdnih grudicah, komercialno se pridobiva edinole na Šrilanki.[91]
Po podatkih USGS je bila svetovna proizvodnja naravnega grafita 1,1 milijonov ton v letu 2010, od tega je Kitajska prispevala 800.000 t, Indija 130.000 t, Brazilija 76.000 t, Severna Koreja 30.000 t in Kanada 25.000 t. V ZDA niso poročali, da bi kopali naravni grafit, ampak 118.000 t sintetičnega grafita z ocenjeno vrednostjo 998 milijonov USD leta 2009.[91]
Diamant[uredi | uredi kodo]
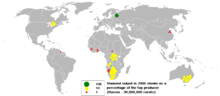
Diamantno dobavno verigo nadzoruje omejeno število močnih podjetij, poleg tega je močno koncentrirana na majhno število lokacij po vsem svetu (glej sliko).Le zelo majhen delež diamantne rude je sestavljen iz dejanskih diamantov. Ruda se zdrobi, pri čemer je treba paziti, da se v tem postopku ne uničijo večji diamanti, nato pa se delci razvrstijo po gostoti. Danes se diamanti v diamantno bogati frakciji iščejo s pomočjo rentgenske fluorescence, po kateri se končni koraki sortiranja opravijo ročno. Preden se je uporaba rentgenskih žarkov uveljavila, so diamante izločevali z namaščenimi trakovi, ker se diamanti se močneje primejo maščobe kot drugi minerali v rudi.[92]
V preteklosti se je vedelo, da je diamante najti le v naplavinah v južni Indiji.[93] Indija je vodila svet v proizvodnji diamantov od njihovega odkritja približno v 9. stoletju pred našim štetjem[94] do sredine 18. stoletja našega štetja, vendar je bil komercialni potencial teh virov konec 18. stoletja izčrpan. Indijo je tedaj zasenčila Brazilija, kjer so prve diamante izven Indije našli leta 1725. [95]
Diamantna proizvodnja primarnih nahajališč (kimberliti in lamproiti) se je začela šele po sedemdesetih letih 19. stoletja po odkritju diamantnih polj v Južni Afriki. Proizvodnja se je sčasoma povečala in odtlej so izkopali 4,5 milijarde karatov.[96] Približno 20 % te količine odpade na zadnjih 5 let in v zadnjih desetih letih so odprli 9 novih rudnikov, medtem ko še 4 čakajo na začetek proizvodnje. Večina teh rudnikov je v Kanadi, Zimbabveju, Angoli, eden pa je v Rusiji.
Danes je največ komercialno donosnih nahajališč diamantov v Rusiji, Bocvani, Avstraliji in Demokratični republiki Kongo.[97] Leta 2005 je Rusija proizvedla skoraj petino svetovne proizvodnje diamantov, poroča Britanski geološki zavod. Avstralija ima najbogatejšo cev, katere proizvodnja je v devetdesetih letih znašala 42 ton.[98] Komercialna nahajališča so tudi na severozahodnih ozemljih Kanade, Sibirije (večinoma na ozemlju Jakutije ; na primer Mir in Udačnaja), Brazilije ter severne in zahodne Avstralije.
Uporaba[uredi | uredi kodo]


Ogljik je bistvenega pomena za vse znane žive sisteme in brez njega življenje, kakršno poznamo, ne bi moglo obstajati (glej alternativno biokemijo). Največja gospodarska raba ogljika, razen hrane in lesa, je v obliki ogljikovodikov, predvsem plina metana iz fosilnih goriv in surove nafte (nafte). Surova nafta se v rafinerijah destilira za proizvodnjo bencina, kerozina in drugih izdelkov. Celuloza je naravni polimer na osnovi ogljika, ki ga rastline proizvajajo v obliki lesa, bombaža, lana in konoplje. Celuloza se uporablja predvsem za vzdrževanje strukture v rastlinah. Med komercialno dragocene ogljikove polimere živalskega izvora spadajo volna, kašmir in svila. Umetne mase so narejene iz sintetičnih ogljikovih polimerov, pogosto z atomi kisika in dušika, ki so redno vključeni v glavno polimerno verigo. Surovine za mnoge od teh sintetičnih snovi izvirajo iz surove nafte.
Uporaba ogljika in njegovih spojin je zelo raznolika. Z železom lahko tvori zlitine, med katerimi je najpogostejše ogljikovo jeklo. Grafit se kombinira z glinami se uporablja v svinčnikih za pisanje in risanje. Uporablja se tudi kot mazivo in pigment, kot oblikovalni material v proizvodnji stekla, v elektrodah za suhe baterije in v galvanizaciji in elektrooblikovanju, v ščetkah za elektromotorje in kot nevtronski moderator v jedrskih reaktorjih.
Oglje se uporablja kot risalni material pri umetniških delih, za taljenje železa in v mnogih drugih aplikacijah. Les, premog in olje se uporabljajo kot gorivo za proizvodnjo energije in ogrevanje. Kakovostni diamanti se uporablja v nakitu, industrijski diamanti pa pri vrtanju, rezanju in poliranju orodij za obdelavo kovin in kamna. Umetne mase so narejene iz fosilnih ogljikovodikov, ogljikova vlakna, izdelana s pirolizo sintetičnih poliestrskih vlaken, pa se uporabljajo za ojačenja plastike in tvorijo napredne, lahke kompozitne materiale.
Ogljikova vlakna nastanejo s pirolizo ekstrudiranih in raztegnjenih filamentov poliakrilonitrila (PAN) in drugih organskih snovi. Kristalografska struktura in mehanske lastnosti vlaken so odvisne od vrste vhodne snovi in nadaljnje obdelave. Ogljikova vlakna iz PAN imajo strukturo, ki spominja na ozke filamente grafita, vendar lahko termična obdelava strukturo preuredi v neprekinjeno valjan produkt. Rezultat so vlakna sspecifično natezno trdnostjo, boljšo od jekla. [99]
Saje se uporabljajo kot črni pigment v tiskarskem črnilu, umetnikovi oljni barvi in vodnih barvah, karbonskem papirju, avtomobilskih oblogah, indijskem črnilu in tonerju za laserski tiskalnik. Saje se uporabljajo tudi kot polnilo v gumijastih izdelkih, kot so pnevmatike in v plastičnih zmesi. Aktivno oglje se uporablja kot absorbent in adsorbent v filtrih v tako raznolikih aplikacijah, kot so plinske maske, prečiščevanje vode in kuhinjske nape, ter v medicini za absorpcijo toksinov, strupov ali plinov iz prebavil. Ogljik se uporablja za redukcijo pri visokih temperaturah. Koks se uporablja za zmanjšanje železove rude v železo (taljenje). Kaljenje jekla se doseže s segrevanjem končnih jeklenih komponent v ogljikovem prahu. Silicijevi karbidi, volfram, bor in titan spadajo med najtrše znane materiale in se uporabljajo kot abrazivna sredstva pri rezalnih in brusilnih orodjih. Ogljikove spojine tvorijo večino materialov, ki se uporabljajo v oblačilih, kot so naravni in sintetični tekstil in usnje, ter skoraj vse notranje površine v grajenem okolju, razen stekla, kamna in kovine.
Diamanti[uredi | uredi kodo]
Diamantna industrija pozna dve kategoriji: ena se ukvarja z diamanti za nakit, druga pa z diamanti potrebe industrije. Čeprav gre pri obeh vrstah za podobno velike posle, oba trga zelo različno delujeta.Za razliko od plemenitih kovin, kot sta zlato ali platina, diamanti za nakit ne trgujejo kot blago : prodaja diamantov pozna precejšen pribitek in kaj posebno aktivnega trga za nadaljnjo prodajo diamantov ni.
Industrijski diamanti so cenjeni predvsem zaradi trdote in toplotne prevodnosti, za dragocene kamne pomembne lastnosti, kot sta jasnost in barva, večinoma niso nepomembne. Približno 80 % pridobljenih diamantov (okoli 100 milijonov karatov oziroma 20 ton letno) ni primernih za uporabo kot nakit, temveč za industrijske namene.[100] Sintetični diamanti, izumljeni v petdesetih letih dvajsetega stoletja, so našli skoraj takoj pot v industrijo; letno se proizvede 3. milijarde karatov (600 ton ) sintetičnih diamantov[101]
Prevladujoča industrijska uporaba diamantov je za rezanje, vrtanje, brušenje in poliranje. Za večino teh aplikacij niso potrebni veliki diamanti; diamante, ki so premajhni za namene nakita, se brez problema lahko uporablja industrijsko. Vdelujejo se v konice svedrov ali žagine liste ali zmeljejo v prah za uporabo pri brušenju in poliranju.[102] Specializirane uporabe so med drugim kot nakovala v laboratorijih za eksperimente pod visokim pritiskom (glej diamantno nakovalno celico ), visoko zmogljivi ležaji in specialna okna.[103][104] Z nenehnim napredkom v proizvodnji sintetičnih diamantov se odpirajo možnosti za nove aplikacije. Veliko navdušenja prinaša možna uporaba diamanta kot polprevodnika v mikročipih, zaradi izjemne lastnosti prevodnosti pa tudi za hladilna telesa v elektroniki.[105]
Varnostni vidiki[uredi | uredi kodo]

Čisti ogljik ima izjemno nizko toksičnost za ljudi in z njim lahko varno ravnamo v obliki grafita ali oglja. Odporen je na raztapljanje ali kemični napad, tudi v kisli vsebini prebavnega trakta. Ko bo enkrat vstopil v telesna tkiva, bo verjetno ostal tam za nedoločen čas. Saje so bile verjetno eden prvih pigmentov, ki so ga uporabili za tetoviranje, in Ötzi je imel ogljikova tetoviranja, ki so preživela njegovo življenje in poleg tega še 5200 let po njegovi smrti. [106] Vdihavanje premogovega prahu ali saj (saj) v velikih količinah je lahko nevarno, draži pljučna tkiva in povzroča kongestivno pljučno bolezen, t.i. rudarsko pnevmokoniozo. Diamantni prah, ki se uporablja kot sredstvo za brušenje, je lahko škodljiv, če ga zaužijemo ali vdihnemo. Mikro delci ogljika nastajajo v izpušnih plinih dizelskega motorja in se lahko kopičijo v pljučih. [107] V teh primerih lso lahko da škodljive nečistoče (npr. organske kemikalije, težke kovine) in ne ogljik sam. Za rakotvornost saj pri ljudeh ni nedvoumnih dokazov. Snov (in njeni izvlečki) je dokazano rakotvorna za preizkusne živali.[108] IARC zato oglene saje (Carbon black) uvršča v skupino 2B - to je med za ljudi potencialno rakotvorne snovi.
Ogljik ima na splošno nizko strupenost za življenje na Zemlji; ogljikovi nanodelci pa so za Drozophilo smrtonosni.[109]
Ogljik lahko močno in močno gori v prisotnosti zraka pri visokih temperaturah. Velike akumulacije premoga, ki so stotine milijonov let ostale inertne v odsotnosti kisika, se lahko spontano vžgejo, če so izpostavljene zraku v koncih odpadkov iz premogovnikov, ladijskih tovornih skladiščih in bunkerjih za premog[110][111] in odlagališčih.
V jedrskih reaktorjih, kjer se grafit uporablja kot nevtronski moderator, lahko pride do kopičenja Wignerjeve energije, čemur sledi nenaden, spontani izpust. Žarjenje na najmanj 250 ° C lahko varno sprosti energijo, čeprav je v požaru Windscale postopek šel narobe, zaradi česar so zagoreli drugi reaktorski materiali.
Velika raznolikost ogljikovih spojin vključuje po eni strani smrtonosne strupe, kot so tetrodotoksin, lektin ricin iz semen rastline Ricinus communis, cianid (CN− ) in ogljikov monoksid; po drugi strani snovi, ki so bistvenega pomena za življenje, tako glukozo in beljakovine.
Sklici[uredi | uredi kodo]
- ↑ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Haaland, D (1976). »Graphite-liquid-vapor triple point pressure and the density of liquid carbon«. Carbon. 14 (6): 357–361. doi:10.1016/0008-6223(76)90010-5.
- ↑ Savvatimskiy, A (2005). »Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)«. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027.
- ↑ »Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical« (PDF). Pridobljeno 6. decembra 2007.
- ↑ »Fourier Transform Spectroscopy of the System of CP« (PDF). Pridobljeno 6. decembra 2007.
- ↑ »Carbon: Binary compounds«. Pridobljeno 6. decembra 2007.
- ↑ 7,0 7,1 7,2 7,3 7,4 Properties of diamond, Ioffe Institute Database
- ↑ »Material Properties- Misc Materials«. www.nde-ed.org. Pridobljeno 12. novembra 2016.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 978-0-8493-0464-4.
- ↑ »History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky«. Caer.uky.edu. Pridobljeno 12. septembra 2008.
- ↑ Senese, Fred (9. september 2000). »Who discovered carbon?«. Frostburg State University. Pridobljeno 24. novembra 2007.
- ↑ »carbon | Facts, Uses, & Properties«. Encyclopedia Britannica (v angleščini). Arhivirano iz prvotnega spletišča dne 24. oktobra 2017.
- ↑ »carbon«. Britannica encyclopedia.
- ↑ »Carbon – Naturally occurring isotopes«. WebElements Periodic Table. Arhivirano iz prvotnega spletišča dne 8. septembra 2008. Pridobljeno 9. oktobra 2008.
- ↑ »History of Carbon«. Arhivirano iz prvotnega spletišča dne 1. novembra 2012. Pridobljeno 10. januarja 2013.
- ↑ »Carbon – Naturally occurring isotopes«. WebElements Periodic Table. Arhivirano iz prvotnega spletišča dne 8. septembra 2008. Pridobljeno 9. oktobra 2008.
- ↑ »History of Carbon«. Arhivirano iz prvotnega spletišča dne 1. novembra 2012. Pridobljeno 10. januarja 2013.
- ↑ Reece, Jane B. (31. oktober 2013). Campbell Biology (10 izd.). Pearson. ISBN 9780321775658.
- ↑ 20,0 20,1 »World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)«. Arhivirano iz prvotnega spletišča dne 31. maja 2001. Pridobljeno 9. oktobra 2008.
- ↑ 21,0 21,1 Chemistry Operations (15. december 2003). »Carbon«. Los Alamos National Laboratory. Arhivirano iz prvotnega spletišča dne 13. septembra 2008. Pridobljeno 9. oktobra 2008.
- ↑ Deming, Anna (2010). »King of the elements?«. Nanotechnology. 21 (30): 300201. Bibcode:2010Nanot..21D0201D. doi:10.1088/0957-4484/21/30/300201. PMID 20664156.
- ↑ Greenville Whittaker, A. (1978). »The controversial carbon solid−liquid−vapour triple point«. Nature. 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ↑ Zazula, J. M. (1997). »On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam« (PDF). CERN. Arhivirano iz prvotnega spletišča (PDF) dne 25. marca 2009. Pridobljeno 6. junija 2009.
- ↑ 25,0 25,1 Greenwood and Earnshaw, pp. 289–292.
- ↑ Greenwood and Earnshaw, pp. 276–8.
- ↑ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). »Materials: Ultrahard polycrystalline diamond from graphite«. Nature. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ↑ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). »Superlubricity of Graphite« (PDF). Physical Review Letters. 92 (12): 126101. Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101. PMID 15089689. Arhivirano (PDF) iz spletišča dne 17. septembra 2011.
- ↑ Deprez, N.; McLachan, D. S. (1988). »The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction«. Journal of Physics D: Applied Physics. 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ↑ Collins, A. T. (1993). »The Optical and Electronic Properties of Semiconducting Diamond«. Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ↑ Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 978-90-5699-228-6.
- ↑ 32,0 32,1 Unwin, Peter. »Fullerenes(An Overview)«. Arhivirano iz prvotnega spletišča dne 1. decembra 2007. Pridobljeno 8. decembra 2007.
- ↑ Ebbesen, T. W., ur. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 978-0-8493-9602-1.
- ↑ Dresselhaus, M. S., ur. (2001). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics. Zv. 80. Berlin. ISBN 978-3-540-41086-7.
- ↑ Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; in sod. (2007). »A novel hybrid carbon material«. Nature Nanotechnology. 2 (3): 156–161. Bibcode:2007NatNa...2..156N. doi:10.1038/nnano.2007.37. PMID 18654245.
- ↑ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). »Investigations of NanoBud formation«. Chemical Physics Letters. 446 (1): 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ↑ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). »Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst«. Applied Catalysis A: General. 274 (1–2): 1–8. doi:10.1016/j.apcata.2004.04.008.
- ↑ 38,0 38,1 Clifford, Frondel; Marvin, Ursula B. (1967). »Lonsdaleite, a new hexagonal polymorph of diamond«. Nature. 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ↑ 39,0 39,1 39,2 Harris, PJF (2004). »Fullerene-related structure of commercial glassy carbons« (PDF). Philosophical Magazine. 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715. doi:10.1080/14786430410001720363. Arhivirano iz prvotnega spletišča (PDF) dne 19. marca 2012. Pridobljeno 6. julija 2011.
- ↑ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (1999). »Structural analysis of a carbon foam formed by high pulse-rate laser ablation«. Applied Physics A: Materials Science & Processing. 69 (7): S755–S758. Bibcode:1999ApPhA..69S.755R. doi:10.1007/s003390051522.
- ↑ 41,0 41,1 Heimann, Robert Bertram; Evsyukov, Sergey E.; Kavan, Ladislav (28. februar 1999). Carbyne and carbynoid structures. Springer. str. 1–. ISBN 978-0-7923-5323-2. Arhivirano iz prvotnega spletišča dne 23. novembra 2012. Pridobljeno 6. junija 2011.
- ↑ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). »Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene«. Science. 321 (5887): 385–8. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798. Laični povzetek.
{{navedi časopis}}: Sklic uporablja opuščeni parameter|lay-url=(pomoč) - ↑ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (22. februar 2011). »Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage«. Chemistry of Materials. 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ↑ Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor & Francis. str. 30. ISBN 978-0-423-87500-3. Arhivirano iz prvotnega spletišča dne 23. novembra 2012. Pridobljeno 1. maja 2011.
- ↑ Rossini, F. D.; Jessup, R. S. (1938). »Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond«. Journal of Research of the National Bureau of Standards. 21 (4): 491. doi:10.6028/jres.021.028.
- ↑ Grochala, Wojciech (1. april 2014). »Diamond: Electronic Ground State of Carbon at Temperatures Approaching 0 K«. Angewandte Chemie International Edition (v angleščini). 53 (14): 3680–3683. doi:10.1002/anie.201400131. ISSN 1521-3773. PMID 24615828.
- ↑ White, Mary Anne; Kahwaji, Samer; Freitas, Vera L. S.; Siewert, Riko; Weatherby, Joseph A.; Ribeiro da Silva, Maria D. M. C.; Verevkin, Sergey P.; Johnson, Erin R.; Zwanziger, Josef W. (2021). »The Relative Thermal Stability of Diamond and Graphite«. Angewandte Chemie International Edition (v angleščini). 60: 1546–1549. doi:10.1002/anie.202009897.
- ↑ Schewe, Phil; Stein, Ben (26. marec 2004). »Carbon Nanofoam is the World's First Pure Carbon Magnet«. Physics News Update. 678 (1). Arhivirano iz spletišča dne 7. marca 2012.
- ↑ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). »Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods«. Angew. Chem. Int. Ed. 44 (45): 7432–5. doi:10.1002/anie.200502448. PMID 16240306.
- ↑ »Researchers Find New Phase of Carbon, Make Diamond at Room Temperature«. news.ncsu.edu. 30. november 2015. Arhivirano iz prvotnega spletišča dne 6. aprila 2016. Pridobljeno 6. aprila 2016.
- ↑ Rabie, Passant (6. julij 2020). »Astronomers Have Found The Source Of Life In The Universe«. Inverse. Pridobljeno 7. julija 2020.
- ↑ Marigo, Paola; in sod. (6. julij 2020). »Carbon star formation as seen through the non-monotonic initial–final mass relation«. Nature Astronomy. 152. arXiv:2007.04163. doi:10.1038/s41550-020-1132-1. Pridobljeno 7. julija 2020.
- ↑ Hoover, Rachel (21. februar 2014). »Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That«. NASA. Arhivirano iz prvotnega spletišča dne 6. septembra 2015. Pridobljeno 22. februarja 2014.
- ↑ Lauretta, D.S.; McSween, H.Y. (2006). Meteorites and the Early Solar System II. Space science series. University of Arizona Press. str. 199. ISBN 978-0-8165-2562-1. Arhivirano iz prvotnega spletišča dne 22. novembra 2017. Pridobljeno 7. maja 2017.
- ↑ Mark, Kathleen (1987). Meteorite Craters. University of Arizona Press. ISBN 978-0-8165-0902-7.
- ↑ William F McDonough The composition of the Earth Arhivirano 2011-09-28 na Wayback Machine. in Majewski, Eugeniusz (2000). Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. ISBN 978-0126851854.
- ↑ Yinon Bar-On; in sod. (19. junij 2018). »The biomass distribution on Earth«. PNAS. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ↑ Fred Pearce (15. februar 2014). »Fire in the hole: After fracking comes coal«. New Scientist. 221 (2956): 36–41. Bibcode:2014NewSc.221...36P. doi:10.1016/S0262-4079(14)60331-6. Arhivirano iz spletišča dne 16. marca 2015.
- ↑ "Wonderfuel: Welcome to the age of unconventional gas" Arhivirano 2014-12-09 na Wayback Machine. by Helen Knight, New Scientist, 12 June 2010, pp. 44–7.
- ↑ Ocean methane stocks 'overstated' Arhivirano 2013-04-25 na Wayback Machine., BBC, 17 Feb. 2004.
- ↑ Calculated from file global.1751_2008.csv in »Index of /ftp/ndp030/CSV-FILES«. Arhivirano iz prvotnega spletišča dne 22. oktobra 2011. Pridobljeno 6. novembra 2011.
- ↑ Rachel Gross (21. september 2013). »Deep, and dank mysterious«. New Scientist: 40–43. Arhivirano iz spletišča dne 21. septembra 2013.
- ↑ Stefanenko, R. (1983). Coal Mining Technology: Theory and Practice. Society for Mining Metallurgy. ISBN 978-0-89520-404-2.
- ↑ Kasting, James (1998). »The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning«. Consequences: The Nature and Implication of Environmental Change. 4 (1). Arhivirano iz spletišča dne 24. oktobra 2008.
- ↑ »Carbon-14 formation«. Arhivirano iz prvotnega spletišča dne 1. avgusta 2015. Pridobljeno 13. oktobra 2014.
- ↑ Aitken, M.J. (1990). Science-based Dating in Archaeology. str. 56–58. ISBN 978-0-582-49309-4.
- ↑ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). »The prebiological paleoatmosphere: stability and composition«. Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894. PMID 7162799.
- ↑ Loerting, T.; in sod. (2001). »On the Surprising Kinetic Stability of Carbonic Acid«. Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- ↑ Haldane J. (1895). »The action of carbonic oxide on man«. Journal of Physiology. 18 (5–6): 430–462. doi:10.1113/jphysiol.1895.sp000578. PMC 1514663. PMID 16992272.
- ↑ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (2003). »The clinical toxicology of carbon monoxide«. Toxicology. 187 (1): 25–38. doi:10.1016/S0300-483X(03)00005-2. PMID 12679050.
- ↑ »Compounds of carbon: carbon suboxide«. Arhivirano iz prvotnega spletišča dne 7. decembra 2007. Pridobljeno 3. decembra 2007.
- ↑ Bayes, K. (1961). »Photolysis of Carbon Suboxide«. Journal of the American Chemical Society. 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ↑ Anderson D. J.; Rosenfeld, R. N. (1991). »Photodissociation of Carbon Suboxide«. Journal of Chemical Physics. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ↑ Sabin, J. R.; Kim, H. (1971). »A theoretical study of the structure and properties of carbon trioxide«. Chemical Physics Letters. 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ↑ Moll N. G.; Clutter D. R.; Thompson W. E. (1966). »Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2«. Journal of Chemical Physics. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ↑ Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. (1963). »Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)« (PDF). Journal of Research of the National Bureau of Standards Section A. 67A (2): 153–162. doi:10.6028/jres.067A.015. PMC 6640573. PMID 31580622. Arhivirano iz prvotnega spletišča (PDF) dne 25. marca 2009. Pridobljeno 21. marca 2009.
- ↑ Pauling, L. (1960). The Nature of the Chemical Bond (3. izd.). Ithaca, NY: Cornell University Press. str. 93. ISBN 978-0-8014-0333-0.
- ↑ Greenwood and Earnshaw, pp. 297–301
- ↑ Scherbaum, Franz; in sod. (1988). »"Aurophilicity" as a consequence of Relativistic Effects: The Hexakis(triphenylphosphaneaurio)methane Dication [(Ph3PAu)6C]2+«. Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi:10.1002/anie.198815441.
- ↑ Ritter, Stephen K. »Six bonds to carbon: Confirmed«. Chemical & Engineering News. Arhivirano iz prvotnega spletišča dne 9. januarja 2017.
- ↑ Yamashita, Makoto; Yamamoto, Yohsuke; Akiba, Kin-ya; Hashizume, Daisuke; Iwasaki, Fujiko; Takagi, Nozomi; Nagase, Shigeru (1. marec 2005). »Syntheses and Structures of Hypervalent Pentacoordinate Carbon and Boron Compounds Bearing an Anthracene Skeleton − Elucidation of Hypervalent Interaction Based on X-ray Analysis and DFT Calculation«. Journal of the American Chemical Society. 127 (12): 4354–4371. doi:10.1021/ja0438011. ISSN 0002-7863. PMID 15783218.
- ↑ »Chinese made first use of diamond«. BBC News. 17. maj 2005. Arhivirano iz prvotnega spletišča dne 20. marca 2007. Pridobljeno 21. marca 2007.
- ↑ van der Krogt, Peter. »Carbonium/Carbon at Elementymology & Elements Multidict«. Arhivirano iz prvotnega spletišča dne 23. januarja 2010. Pridobljeno 6. januarja 2010.
- ↑ Ferchault de Réaumur, R.-A. (1722). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago.
- ↑ »Carbon«. Canada Connects. Arhivirano iz prvotnega spletišča dne 27. oktobra 2010. Pridobljeno 7. decembra 2010.
- ↑ Senese, Fred. »Who discovered carbon?«. Frostburg State University. Arhivirano iz prvotnega spletišča dne 7. decembra 2007. Pridobljeno 24. novembra 2007.
- ↑ Giolitti, Federico (1914). The Cementation of Iron and Steel. McGraw-Hill Book Company, inc.
- ↑ Senese, Fred (9. september 2000). »Who discovered carbon«. Frostburg State University. Arhivirano iz prvotnega spletišča dne 7. decembra 2007. Pridobljeno 24. novembra 2007.
- ↑ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (1985). »C60: Buckminsterfullerene«. Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ↑ »The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"«. Arhivirano iz prvotnega spletišča dne 11. oktobra 2007. Pridobljeno 21. decembra 2007.
- ↑ 91,0 91,1 91,2 USGS Minerals Yearbook: Graphite, 2009 Arhivirano 2008-09-16 na Wayback Machine. and Graphite: Mineral Commodity Summaries 2011
- ↑ Harlow, G. E. (1998). The nature of diamonds. Cambridge University Press. str. 223. ISBN 978-0-521-62935-5.
- ↑ Catelle, W. R. (1911). The Diamond. John Lane Company. str. 159.
- ↑ Ball, V. (1881). Diamonds, Gold and Coal of India. London, Truebner & Co.
- ↑ Hershey, J. W. (1940). The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. str. 28. ISBN 978-1-4179-7715-4.
- ↑ Janse, A. J. A. (2007). »Global Rough Diamond Production Since 1870«. Gems and Gemology. XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98.
- ↑ Marshall, Stephen; Shore, Josh (22. oktober 2004). »The Diamond Life«. Guerrilla News Network. Arhivirano iz prvotnega spletišča dne 9. junija 2008. Pridobljeno 10. oktobra 2008.
- ↑ Lorenz, V. (2007). »Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future«. Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft. 56 (1/2): 35–40.
- ↑ Cantwell, W. J.; Morton, J. (1991). »The impact resistance of composite materials – a review«. Composites. 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V.
- ↑ Holtzapffel, Ch. (1856). Turning And Mechanical Manipulation. Charles Holtzapffel.
- ↑ »Industrial Diamonds Statistics and Information«. United States Geological Survey. Arhivirano iz prvotnega spletišča dne 6. maja 2009. Pridobljeno 5. maja 2009.
- ↑ Coelho, R. T.; Yamada, S.; Aspinwall, D. K.; Wise, M. L. H. (1995). »The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC«. International Journal of Machine Tools and Manufacture. 35 (5): 761–774. doi:10.1016/0890-6955(95)93044-7.
- ↑ Harris, D. C. (1999). Materials for infrared windows and domes: properties and performance. SPIE Press. str. 303–334. ISBN 978-0-8194-3482-1.
- ↑ Nusinovich, G. S. (2004). Introduction to the physics of gyrotrons. JHU Press. str. 229. ISBN 978-0-8018-7921-0.
- ↑ Sakamoto, M.; Endriz, J. G.; Scifres, D. R. (1992). »120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink«. Electronics Letters. 28 (2): 197–199. Bibcode:1992ElL....28..197S. doi:10.1049/el:19920123.
- ↑ Dorfer, Leopold; Moser, M.; Spindler, K.; Bahr, F.; Egarter-Vigl, E.; Dohr, G. (1998). »5200-year old acupuncture in Central Europe?«. Science. 282 (5387): 242–243. Bibcode:1998Sci...282..239D. doi:10.1126/science.282.5387.239f. PMID 9841386.
- ↑ Donaldson, K.; Stone, V.; Clouter, A.; Renwick, L.; MacNee, W. (2001). »Ultrafine particles«. Occupational and Environmental Medicine. 58 (3): 211–216. doi:10.1136/oem.58.3.211. PMC 1740105. PMID 11171936.
- ↑ »Summaries & Evaluations - CARBON BLACK (Group 2B)«. International Agency for Research on Cancer (IARC). IARC. Pridobljeno 10. marca 2021.
- ↑ Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young Arhivirano 2011-11-02 na Wayback Machine. ScienceDaily (Aug. 17, 2009)
- ↑ »Press Release – Titanic Disaster: New Theory Fingers Coal Fire«. www.geosociety.org. Arhivirano iz prvotnega spletišča dne 14. aprila 2016. Pridobljeno 6. aprila 2016.
- ↑ McSherry, Patrick. »Coal bunker Fire«. www.spanamwar.com. Arhivirano iz prvotnega spletišča dne 23. marca 2016. Pridobljeno 6. aprila 2016.
Zunanje povezave[uredi | uredi kodo]
Ogljik (video), Univerza v Nottinghamu



