Rutenij
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rutenij | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [ruténij] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Videz | srebrnkasto bel kovinski | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardna atomska teža Ar, std(Ru) | 101,07(2)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rutenij v periodnem sistemu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vrstno število (Z) | 44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina | skupina 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Perioda | perioda 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Razporeditev elektronov | [Kr] 4d7 5s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 18, 15, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne lastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Faza snovi pri STP | trdnina | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tališče | 2334 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vrelišče | 4150 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gostota (blizu s.t.) | 12,45 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| v tekočem stanju (pri TT) | 10,65 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Talilna toplota | 38,59 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izparilna toplota | 619 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna kapaciteta | 24,06 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Parni tlak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lastnosti atoma | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacijska stanja | −4, −2, 0, +1,[2] +2, +3, +4, +5, +6, +7, +8 (rahlo kisel oksid) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 2,2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizacijske energije |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski polmer | empirično: 134 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni polmer | 146±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druge lastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | heksagonalna gosto zložena (hgz) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hitrost zvoka tanka palica | 5970 m/s (pri 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperaturni raztezek | 6,4 µm/(m⋅K) (pri 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna prevodnost | 117 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Električna upornost | 71 nΩ⋅m (pri 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetna ureditev | paramagnetik[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Youngov modul | 447 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Strižni modul | 173 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stisljivostni modul | 220 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissonovo razmerje | 0,30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova trdota | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trdota po Brinellu | 2160 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Številka CAS | 7440-18-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zgodovina | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poimenovanje | po Ruthenia (lat.: srednjeveško ozemlje Kijevske Rusije) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Odkritje in prva izolacija | Karl Ernst Claus (1844) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Najpomembnejši izotopi rutenija | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ruténij je kemični element, ki ima v periodnem sistemu simbol Ru in atomsko število 44. To redko prehodno kovino iz skupine platine najdemo v rudah platine in jo uporabljamo kot katalizator v nekaterih zlitinah platine.
Pomembne lastnosti
[uredi | uredi kodo]Rutenij, polivalentna trdna bela kovina iz skupine platine, ima štiri kristalne oblike in na normalnih temperaturah ne potemni, vendar eksplozivno oksidira. Rutenij se raztaplja v zlitinah alkalij, kisline se ga ne lotevajo, vendar ga napadajo halogeni pri visokih temperaturah. Majhne količine rutenija lahko povečajo trdnost platine in paladija. Odpornost titana na korozijo lahko izrazito povečamo z malim dodatkom rutenija.
Kovino lahko galvaniziramo bodisi z elektro depozicijo ali s postopki toplotne dekompozicije. Za eno od zlitin rutenij-molibden je bilo ugotovljeno, da je superprevodna pri 10,6 K. Oksidacijska stanja rutenija so med +1 do +8, znano je tudi -2, čeprav so najpogostejša +2, +3 in +4.
Rutenijeve koordinacijske spojine in njihova uporaba
[uredi | uredi kodo]Kataliza
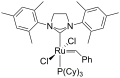
[uredi | uredi kodo]Rutenijeve koordinacijske spojine se široko uporabljajo kot katalizatorji v sintezni organski kemiji in sicer na področju asimetrične hidrogenacije (kompleksi s kiralnimi difosfini) in olefinske metateze (Grubbsovi katalizatorji; kompleksi s stabilnimi karbeni in sterično zahtevnimi fosfini). Leta 2005 so R. H. Grubbs, R. R. Schrock in Y. Chauvin za delo na področju olefinske metateze z uporabo rutenijevih katalizatorjev prejeli Nobelovo nagrado za kemijo.
-
Grubbsov katalizator prve generacije
-
Grubbsov katalizator druge generacije
Barvila v sončnih celicah
[uredi | uredi kodo]Rutenijevi polipiridilni kompleksi se uporabljajo v t. i. Graetzlovih celicah (ang. dye-sensitized solar cells) kot barvila za absorpcijo sončne svetlobe, saj so spojine intenzivno obarvane in absorbirajo svetlobo večjega dela vidnega in ultravijoličnega spektra.
-
Rutenijev kompleks s trikarboksiterpiridinom in tiocianatom, ki se uporablja v Graetzlovih sončnih celicah (t. i. "ruthenium black-dye")
-
Rutenijev amfifilni polipiridinski kompleks, ki sodi v novejšo generacijo rutenijevih barvil za sončne celice
Zdravila proti raku
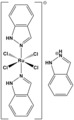
[uredi | uredi kodo]Eno najbolj uporabljanih in učinkovitih zdravil proti raku je cisplatin. Zadnjih deset let so se raziskave novih učinkovin razširile še na spojine drugih kovin, kot so železo, baker, titan, galij, zlato, iridij, osmij in rutenij. Izmed vseh neplatinskih zdravil sta samo dve rutenijevi spojini do sedaj uspešno prestali drugo fazo kliničnih testiranj. Prva spojina, NAMI-A, je bila pripravljena v laboratoriju prof. E. Alessia v Trstu in je učinkovita proti metastazam trdnih tumorjev. Druga, KP1019, je bila sintetizirana v laboratorijih prof. B. K. Kepplerja na Dunaju in je kot del kombinacije kemoterapavtikov učinkovita proti raku debelega črevesa.
-
NAMI-A
-
KP1019
Sklici
[uredi | uredi kodo]- ↑ Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ »Ruthenium: ruthenium(I) fluoride compound data«. OpenMOPAC.net. Pridobljeno 10. decembra 2007.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.