Organska kemija

Organska kemija je veja kemije, ki z znanstvenimi metodami preučuje zgradbo, lastnosti, sestavo, reakcije in pripravo (s sintezo ali kako drugače) ogljikovih spojin. Spojine poleg ogljika vsebujejo tudi mnoge druge elemente, med katerimi so najbolj pogosti vodik, dušik, kisik, halogeni elementi, fosfor, silicij in žveplo.[1][2][3] Elementarni ogljik in nekatere njegove spojine, na primer oksidi, karbonati in karbidi, se prištevajo k anorganskim spojinam.
Naziv "organska" kemija je posledica napačnega sklepanja, da so organske spojine vezane izključno na nek življenjski proces. Organske molekule seveda nastajajo tudi izven živih organizmov in ne samo to, saj je življenje odvisno tudi od anorganske kemije. Mnogi encimi imajo vgrajene prehodne kovine, na primer železo in baker, kosti in zobje pa so zgrajeni delno iz organskih delno iz anorganskih spojin.
Posebno področje organske kemije je biokemija, ki se ukvarja pretežno s kemijo naravnih biomolekul, na primer proteinov, sladkorjev in nukleinskih kislin.
Spojine z več ogljikovimi atomi so zaradi svojih specifičnih lastnosti zelo raznolike in imajo izredno široko področje uporabe. Organske spojine so osnova hrane, zdravil, barvil, plastičnih mas itd. in, razen redkih izjem, osnova vseh življenjskih procesov.
Zgodovina[uredi | uredi kodo]





Na začetku 19. stoletja je med kemiki še vedno prevladovalo mnenje, da so spojine iz živih organizmov preveč zapletene, da bi se jih dalo sintetizirati iz neživih snovi in da je za njihovo sintezo potrebna "življenjska sila" oziroma vitalizem, ki je lastnost živih bitij. Spojine so zato imenovali "organske", svoje raziskovanje pa so preusmerili na anorganske spojine, ki so se jim zdele bolj enostavne.
V prvi polovici 19. stoletja so znanstveniki spoznali, da se organske spojine lako sintetizirajo tudi v laboratoriju in zanimanje za organsko kemijo je začelo naraščati. Okrog leta 1816 je začel Michel-Eugène Chevreul preučevati mila, izdelana iz različnih vrst maščob in različnih alkalij. Izločil je nekaj različnih maščobnih kislin in iz njih z različnimi alkalijami izdelal milo. Čeprav je šlo samo za nekaj posameznih spojin, je s tem dokazal, da se lahko različne maščobe, ki so povsem organskega porekla, spremenijo tudi brez življenjske sile.[4]
Leta 1828 je Friedrich Wöhler iz anorganskega amonijevega cianata (NH4OCN) sintetiziral organsko spojino ureo (karbamid), ki je ena od sestavin urina.[5] Sinteza se po njem imenuje Wöhlerjeva sinteza. Čeprav je bil Wöhler takrat, pa tudi kasneje, oprezen pri trditvah, da je zrušil teorijo vitalne sile, velja njegova sinteza za prelomnico v razvoju organske kemije.
Naslednji velik korak v razvoju organske kemije je naredil William Henry Perkin, ki je leta 1856 med poskusi sintetiziranja kinina po naključju odkril prvo sintetsko organsko barvilo movein ali anilinski purpur.[6] Barvilo se po njem imenuje tudi Perkinov purpur. Njegovo odkritje je prineslo velike finančne dobičke, kar je močno povečalo zanimanje za organsko kemijo.
Leta 1874 je Othmar Zeidler v laboratoriju sintetiziral insekticid DDT, vendar so njegove insekticidne lastnosti odkrili mnogo kasneje.
Ključna prelomnica v teoriji organske kemije je bila ideja o kemijski strukturi, ki je vsebovala tudi idejo o kemijski valenci, ki sta jo leta 1857-1858 neodvisno drug od drugega razvila Friedrich August Kekulé[7][8] in Archibald Scott Couper.[9] Oba znanstvenika sta predvidevala, da se štirivalentni ogljikovi atomi lahko med seboj spajajo in tvorijo verige in obroče, podrobno strukturo molekule in vezi med atomi pa se lahko ugotovi s strokovno interpretacijo kemijskih reakcij.
Zgodovina organske kemije se je nadaljevala z odkritjem nafte in njeno frakcioniranje na posamezne komponente glede na njihova vrelišča. S pretvorbo različnih frakcij ali posameznih spojin v neke druge produkte se je začela razvijati petrokemijska industrija, ki zdaj masovno proizvaja sintetski gumij, organska lepila in plastične mase.
Farmacevtska industrija se je začela razvijati v zadnjem desetletju 19. stoletja, ko je tovarna Bayer začela proizvajati acetilsalicilno kislino, bolj znano kot aspirin.[10] Prvo zdravilo, ki je nastalo s sistematičnim razvojem, je bil arsfenamin (salvarzan),[11] ki se je uporabljal za zdravljenje sifilisa. Paul Ehrlich s sodelavci je za njegovo odkritje sistematično sintetiziral in preskušal številne derivate takrat že znane in izredno strupene arzenove organske spojine atoxil (arsanilinska kislina) in iskal spojino z največjo učinkovitostjo in najmanjšo toksičnostjo.
Odkritja prvih organskih reakcij in njihove aplikacije so bila v glavnem naključna, v 20. stoletju pa je organska kemija že tako napredovala, da je omogočala sintezo izbrane spojine in celo načrtovanje molekul s specifičnimi lastnostmi, na primer zdravil.
Zaporedje kemijskih reakcij, ki daje zahtevani produkt, se imenuje totalna sinteza. Totalna sinteza zapletenih naravnih spojin se je začela z ureo in nadaljevala z glukozo in terpineolom (α,α,4-trimetillcikloheks-3-en-1-metanol). Totalno sintezo je prvi komercializiral Gustaf Komppa leta 1903 s sintezo kafre. S sintezo holesterola in njemu podobnih spojin se je odprla pot sintezam zelo zapletenih človeških hormonov in njihovih modificiranih derivatov.
Biokemija, ki v steklu in v živo preučuje kemijo živih organizmov, se je začela razvijati na začetku 20. stoletja in odprla popolnoma novo in zelo obsežno poglavje organske kemije.
Karakterizacija organskih spojin[uredi | uredi kodo]
Organske spojine se pogosto nahajajo v zmeseh, zato so se za njihovo ločevanje in čiščenje razvile posebne tehnike, med katerimi sta posebno pomembni kromatografija in plinska kromatografija.[12][13] Med tradicionalne metode ločevanja spadajo destilacija, kristalizacija in ekstrakcija s topili.
Organske spojine so se v preteklosti karakterizirale z raznimi tradicionalnimi "mokrimi" metodami, katere so v zadnjem času večinoma nadomestile spektroskopija in druge računalniško podprte intenzivne analitske metode.[14] Med sodobnimi metodami so najpomembnejše:
- Jedrska magnetna resonančna spektroskopija (JMR) je najpogostejša metoda, ki pogosto omogoča popolno določanje povezav med atomi, s pomočjo korelacijske spektroskopije pa se lahko določi celo njihovo prostorsko razporeditev. Uporabo JMR v organski kemiji omogočata izotopa 13C in 1H, ki sta dovzetna za JMR.[15]
- Elementarna analiza je destruktivna metoda, s katero se določa elementarno sestavo molekule. Elementarno analizo je v veliki meri nadomestila masna spektrometrija.
- Masna spektrometrija se uporablja za določanje molekulske mase spojine, iz fragmentiranih vzorcev pa se lahko določi tudi njeno strukturo.[16][17] Masna spektrometrija z visoko razločljivostjo omogoča določanje natančne molekulske mase spojine in se uporablja namesto elementarne analize. V preteklosti je bila metoda omejena na nevtralne molekule, ki so bile vsaj malo hlapne, z razvojem ionizacijskih tehnik pa se je razširila na praktično vse organske spojine.
- Kristalografija je najbolj natančna metoda za določanje molekularne geometrije.[18] Njena uporabnost je omejena s tvorbo monokristalov, ki morajo biti tipični za preskušano spojino, to pa je v organski kemiji pogosto težko doseči. Kristalografija se zelo obširno uporablja v biokemiji za ugotavljanje zgradbe proteinov in ugotavljanje zgradbe organokovinskih katalizatorjev. Računalniška programska oprema omogoča, da so rezultati analize znani že v nekaj urah.
Značilnosti organskih spojin[uredi | uredi kodo]
Najbolj zanimive kvantitativne fizikalne lastnosti organski spojin so tališče, vrelišče in lomni količnik. Najbolj zanimive kvalitativne lastnosti so vonj, konsistenca, topnost in barva.
Tališče in vrelišče[uredi | uredi kodo]
Večina organskih spojin se v nasprotju z anorganskimi spojinami tali, nekatere pa celo vrejo. Temperaturi tališča in vrelišča sta bila nekdaj ključna podatka za prepoznavanje organske spojine in ugotavljaje njene čistosti. Tališča in vrelišča korelirajo s polarnostjo molekul in njihovo molekulsko maso. Nekatere organske spojine, predvsem simetrične, sublimirajo, se pravi da brez taljenja prehajajo iz trdnega v plinasto agregatno stanje. Dobro poznana snov, ki sublimira, je para-diklorbenzen, ki je ena od komponent v tabletah proti moljem. Organske spojine, razen nekaterih izjem, pri temperaturah nad 300 °C niso obstojne.
Topnost[uredi | uredi kodo]
Nevtralne organske spojine so bolj kot ne hidrofobne, zato so bolj topne v organskih topilih kot v vodi. Med izjeme spadajo spojine, ki imajo ionizirajoče skupine in majhno molsko maso. Takšne spojine so na primer nižji alkoholi, amini in karboksilne kisline, pri katerih nastajajo vodikove vezi. Organska topila so lahko čiste snovi, na primer eter ali etanol, ali zmesi različnih parafinskih topil, na primer petrol etrov ali težkih bencinov. Topnost v organskih topilih je odvisna od vrste topila in funkcionalnih skupin, če so prisotne.
Lastnosti trdnega stanja[uredi | uredi kodo]
Zanimive in uporabne so razne posebne lastnosti molekularnih kristalov in organskih polimerov s konjugiranimi sistemi, na primer piezoelektrčnost, električna prevodnost in elektro-optične lastnosti. S temi značilnostmi organskih spojin se iz zgodovinskih razlogov ukvarjata predvsem znanost o polimerih in zanost o materialih.
Tradicionalne spektroskopske metode v infrardečem, vidnem in ultravijoličnem delu svetlobnega spektra in optična sučnost dajejo relativno neznačilne podatke o strukturah spojin, vendar se še vedno uporabljajo za specifične razrede spojin.
Poimenovanje[uredi | uredi kodo]

Imena organskih spojin so ali sistematična, ki se podrejajo nizu pravil, ali nesistematična, ki so zapuščina raznih drugih načinov poimenovanja. Sistematična imena spojin predpisuje IUPAC.
Sistematično ime spojine je sestavljeno iz imena njene starševske strukture, kateremu se dodajajo predpone, pripone in številke, ki enoznačno opišejo njeno strukturo. Med starševske strukture spadajo nesubstituirani ogljikovodiki in heterociklične spojine in njihovi monofunkcionalni derivati. Glede na to, da je poznanih več milijonov organskih spojin, je lahko pretirano natančna uporaba sistematičnih imen tudi nadležna. Priporočila IUPAC se zato bolj dosledno uporabljajo samo za enostavnejše spojine, za bolj kompleksne pa ne.Nesistematična imena so, vsaj za organskega kemika, enostavnejša in enoznačna.
Nesistematična imena niso povezana s strukturo spojine in se uporabljajo predvsem za zapletene spojine, med katere spada večina naravnih produktov. Primer: spojina z nesistematičnim imenom dietil amid lizergove kisline, ki je bolj poznana kot LSD, ima sistematično ime (6aR,9R)-N,N-dietil-7-metil-4,6,6a,7,8,9-heksahidroindolo-[4,3-fg] kinolin-9-karboksiamid.
Uporaba računalnikov je sprožila razvoj novih metod za poimenovanje spojin, s katerimi imena tvori računalnik. Najbolj priljubljeni obliki imen sta SMILES in InChI.
Prikazi struktur[uredi | uredi kodo]

Organske spojine se najpogosteje prikazujejo z risbami ali strukturnimi formulami, kombinacijami risb in kemijskimi simboli.[19] Zaradi zapletenosti molekularnih struktur se je razvil poenostavljen zapis s skeletno formulo, ki je zelo pregleden in enoznačen. V skeletni formuli pomenijo začetek in konec črte ter vsi prelomi in presečišča po en ogljikov atom. Vodikovi atomi se lahko pišejo ali pa tudi ne, ker so razvidni implicitno iz števila prostih ogljikovih valenc. Takšen prikaz omogoča dejstvo, da tvori ogljik v skoraj vseh organskih spojinah štiri vezi, kisik dve, vodik eno in dušik tri. Pomanjkljivost skeletne fomule je, da jo je težko opisati z besedami, še večje težave pa povzroča pri tiskanju.
Razvrščanje organskih spojin[uredi | uredi kodo]
Razvrščanje organskih spojin se običajno začne pri ogljikovodikih, spojinah, ki vsebujejo samo ogljik in vodik. Drugi elementi (heterogeni) so vezani v tako imenovanih funkcionalnih skupinah.
Funkcionalne skupine[uredi | uredi kodo]

Funkcionalna skupina je ključni pojem organske kemije, ki omogoča razvrščanje spojin in predvidevanje njihovih lastnosti. Funkcionalna skupina je molekularni modul, za katerega se predpostavlja, da je z nekaj omejitvami v različnih molekulah približno enako reaktiven. Funkcionalne skupine imajo odločilen vpliv na kemijske in fizikalne lastnosti organskih spojin, na primer topnost v vodi, kislost oziroma bazičnost, reaktivnost in obstojnost proti oksidaciji.
Molekule se na osnovi njihovih funkcionalnih skupin razvrščajo v alkohole, karboksilne kisline, amine, amide itd. Alkoholi na primer vsebujejo podskupino -C-O-H. Vsi alkoholi so bolj ali manj hidrofilni, običajno tvorijo estre, in se lahko pretvorijo v halide. Večina funkcionalnih skupin vsebuje heteroatome, na primer O, N, S itd.
Nekatere funkcionalne skupine so tudi radikali, podobni tistim v anorganski kemiji. Definirani so kot polarne atomske skupine, ki v kemijski reakciji preidejo iz ene spojine v drugo ne da bi se pri tem spremenili.
Nekateri elementi, na primer O, S, N in halogeni, so lahko vezani tudi posamično, zato izraz funkcionalna skupina zanje morda ni najbolj primeren. Glede na to, da imajo odločilen vpliv na lastnosti ogljikovodikov, se kljub temu uvrščajo med funkcionalne skupine.
Skoraj vse funkcionalne skupine, ki se pojavljajo v alifatskih spojinah, najdemo tudi aromatskih in alicikličnih spojinah, če niso dehidrirane. Z dehidracijo namreč nastanejo nereaktivne kooptivne skupine.
Na funkcionalnih skupinah temelji tudi nomenklatura organskih spojin, čeprav so nekatera imena kljub priporočilom IUPAC izpeljana iz trivialnih imen. Razvrščanje spojin v podrazrede se zaplete, če ima spojina več kot eno funkcionalno skupino.
Alifatske spojine[uredi | uredi kodo]
V organski kemiji prevladujeta dve glavni kategoriji spojin: alifatske spojine z odprtimi verigami in ciklične spojine z zaprtimi verigami (obroči). Spojine, ki vsebujejo odprte in zaprte verige, se običajno uvrščajo med ciklične spojine.
Alifatski ogljikovodiki ali alifati se delijo na tri skupine homolognih vrst:
- alkane ali parafine, ki imajo izključno enojne vezi,
- alkene ali olefine, ki imajo najmanj eno dvojno vez in se glede na število dvojnih vezi delijo na alkene, diene, triene, poliene itd. in
- alkine, ki imajo vsaj eno trojno vez.
Ogljikovodiki, ki imajo samo enojne vezi, so nasičeni, ogljikovodiki z najmanj eno dvojno ali trojno vezjo pa so nenasičeni.
Alifatski ogljikovodiki imajo lahko ravne ali razvejane verige ali tvorijo obroče. Stopnja razvejanosti lahko zelo vpliva na njihove lastnosti. Značilen primer različnih lastnosti sta oktan in izooktan (2,2,4-trimetilpentan), ki imata zelo različni oktanski števili.
Aliciklične in aromatske spojine[uredi | uredi kodo]
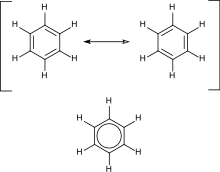
Alifatske spojine imajo tudi svoje ciklične različke, ki so lahko nasičeni ali nenasičeni. Najbolj stabilne so spojine s šestimi ogljikovimi atomi. Zelo pogoste so tudi spojine s petimi atomi, druge pa so bolj redke.
Ciklični ogljikovodiki se delijo na aliciklične ogljikovodike, ki so lahko nasičeni ali nenasičeni, vendar nimajo aromatskih lastnosti, in aromatske, ki se imenujejo tudi areni. Aliciklične spojine cikloalkani imajo same enojne vezi. Cikloalkeni in cikloalkini imajo vsaj eno dvojno oziroma trojno vez. Za nenasičene aliciklične spojine so značilni veliki obroči, imenovani makrocikli. Najpreprostejši cikloalkan je ciklopropan s tremi ogljikovimi atomi.

Aromatski ogljikovodiki vsebujejo konjugirane dvojne vezi. Njihov najenostavnejši predstavnik je benzen, ki ima šest ogljikovih atomov in tri konjugirane dvojne vezi. Njegovo strukturo je formuliral nemški kemik Friedrich August Kekulé, ki je prvi predvidel delokalizacijo elektronov in resonanco. Ciklične spojine spadajo med aromatske, če imajo 4n+2 delokaliziranih π-elektronov, n je naravno število. Posebno nestabilne (antiaromatske) so spojine s 4n konjugiranimi π-elektroni.
Lastnosti cikličnih ogljikovodikov se zelo spremenijo z vklučitvijo heteroatoma. Če je heteroatom vezan na obroč, so spojine eksociklične, če je vgrajen v obroč pa so endociklične oziroma heterocikične. Heterociklična aromata sta na primer piridin in furan, medtem ko sta piperidin in tetrahidrofuran aliciklična heterocikla. Heteroatomi v heterocikličnih molekulah so lahko kisik, žveplo ali dušik. Dušik je zlasti pogost v biokemijskih sistemih.
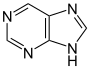
Obroči se lahko zlijejo z drugimi obroči. Če se zlijejo po robu, nastanejo policiklične spojine, kakršen je, na primer purin. Če se obroči zlijejo na vogalih, tako da ima en atom (praviloma ogljik) dve vezi na prvem in dve vezi na drugem obroču, nastanejo tako imenovane spiro spojine, ki igrajo pomembno vlogo v mnogih naravnih produktih.
Polimeri[uredi | uredi kodo]

Nekatere organske mlekule, imenovane monomeri, se lahko vežejo med seboj in tvorijo verige, mreže ali prostorske strukture. Njihovo spajanje se imenuje polimerizacija, produkti pa polimeri. Če med polimerizacijo nastajajo kakšni stranski produkti, na primer voda, se reakcija imenuje polikondenzacija.
Polimeri se razvrščajo v sintetske ali industrijske[20] in naravne ali biopolimere. Prvi sintetski polimer je bil bakelit, ki ga je v letih 1907–1909 razvil belgijski kemik Leo Hendrik Baekeland. Po njegovem odkritju je začelo število polimerov hitro naraščati. Nam najbolj znani polimeri so polietilen (polieten), polipropilen (polipropen), nylon (poliamid), teflon (politetrafluoroetilen, PTFE), polistiren, poliestri, polivinilklorid (PVC), polimetilmetakrilat (perspex in plexiglas), poliizobutilen (sintetski gumij) in polibutadien (komponenta sintetskega gumija).
Fizikalne in kemijske lastnosti polimerov so zelo različne in odločilno vplivajo na njihovo uporabnost. Na njihove lastnosti vplivajo predvsem kemijska sestava in pogoji polimerizacije, ki določajo dolžino in razvejanost verige ter taktičnost.
Polimeri iz istovrstnega monomera so homopolimeri, polimeri iz dveh ali več monomerov pa so heteropolimeri ali kopolimeri. Zelo uporaben kopolimer je ABS (akrilonitril-butadien-stiren). S kombiniranjem monomerov in njihove množine lahko nastanejo produkti z želenimi lastnostmi, kot so gostota, trdota, trdnost, odpornost na obrabo, termična obstojnost, barva itd.
Biomolekule[uredi | uredi kodo]

Živi organizmi proizvajajo množico zelo zapletenih multifunkcionalnih spojin, ki so pomembne za njihov obstoj. Nekatere biomolekule so biopolimeri z dolgimi verigami, med katere spadajo beljakovine, nukleinske kisline (DNA in RNA) ter polisaharidi (glikogen, škrob in celuloza). Druga velika skupina so enostavne spojine, na primer amino kisline, monosaharidi, nukleinske kisline in lipidi, ki so gradbeni elementi (monomeri) bolj zapletenih spojin. Tretja skupina so enostavne vmesne spojine (intermediati), ki v biokemiji živali sodelujejo v Krebsovem ciklu proizvodnje energije. Iz njih nastaja izopren, ki je najpogostejši živalski ogljikovodik. Iz živalskih izoprenov nastajajo pomembni steroidi, na primer holesterol, in steroidni hormoni, iz rastlinski izoprenov pa terpeni, terpenoidi in nekateri alkaloidi ter polizoprenoidi, ki so sestavni del lateksa.
Male molekule[uredi | uredi kodo]

V farmakologiji in biokemiji so male molekule vse organske spojine, ki so biološko aktivne, vendar niso polimeri. V praksi to pomeni, da mednje spadajo spojine z molsko maso manjšo od 1000 g/mol.
Fulereni[uredi | uredi kodo]
Fulereni so razred ogljikovih alotropov, katerih molekule so sestavljene izključno iz ogljikovih atomov. Fulereni imajo obliko kroglic, cevk (nanocevke) ali ploskev (grafen). Fulereni imajo podobno zgradbo kot grafit, zanimivi pa so predvsem zaradi izrednih električnih lastnosti.
Druge spojine[uredi | uredi kodo]
Organske spojine lahko poleg ogljika in vodika vsebujejo tudi druge elemente. Spojine s kisikom, dušikom in halogeni se običajno ne obravnavajo kot samostojni razredi spojin. Spojine z drugimi elementi se pogosto obravnavajo samostojno kot organožveplove, organokovinske, organofosforjeve in organosilicijeve spojine.
Organske reakcije[uredi | uredi kodo]
Organske reakcije so kemijske reakcije, v katerih so udeležene organske spojine.[21] Osnovne organske reakcije so adicije, eliminacije, substitucije, periciklične reakcije, prerazporeditve in redoks reakcije. Posebno področje reakcij so organske sinteze, s katerimi se ustvarjajo nove spojine, na primer zdravila, barvila in plastične mase.
Najstarejši organski reakciji sta zgorevanje organskih goriv in umiljenje maščob. Posebno znana reakcija je Wöhlerjeva sinteza sečnine (1828), ki velja za začetek sodobne organske kemije. Za odkritje specifičnih organskih reakcij je bilo podeljenih celo nekaj Nobelovih nagrad za kemijo: leta 1912 za Grignardovo reakcijo, leta 1950 za Diels-Alderjevo reakcijo, leta 1979 za Wittigovo reakcijo in leta 2005 za olefinsko metatezo.
Ogljikovodiki brez funkcionalnih skupin so omejeni na samo nekaj vrst reakcij, medtem ko je število reakcij spojin s funkcionalnimi skupinami mnogo večje. V splošno teorijo organskih reakcij je vključen temeljit študij lastnosti spojin, kot so elektronska afiniteta kjučnih atomov, jakost kemijskih vezi in sterične ovire. Te lastnosti lahko določajo relativno stabilnost kratko živečih reaktivnih vmesnih spojin, ki po navadi neposredno določajo reakcijsko pot. Pri vsaki reakciji je traba upoštevati tudi njene termodinamske značilnosti, na primer spremembo proste entalpije, ki določa spontanost reakcije, in reakcijsko entalpijo, ki določa ali bo reakcija eksotermna ali endotermna. Neustrezni reakcijski pogoji lahko povzročijo tvorbo stranskih produktov, ki so lahko nezaželeni ali pa jih je težko ločiti od ciljnega produkta.
Organske sinteze[uredi | uredi kodo]

Organske sinteze so posebna veja kemijskih sintez, ki se ukvarja z načrtovanjem, analiziranjem in sintezo organskih spojin. Organske molekule so praviloma mnogo bolj zapletene kot anorganske, zato se je njihova sinteza razvila v eno od najpomembnejših vej organske kemije. Organske sinteze so razdeljene na dve glavni področji: totalne sinteze in metodologijo.
Sinteze slonijo na več strategijah. Ena od sodobnih strategij je retrosinteza, ki jo je razvil E.J. Corey. Po tej metodi se sinteza začne pri ciljni molekuli, katero se z znanimi reakcijami sistematično razgrajuje do znanih spojin. Te spojine, ki so potencialni prekurzorji, se razgrajujejo še naprej, dokler razgradnja ne pripeje do enostavnih, dostopnih in cenenih začetnih spojin. Retrosintezo se zatem zapiše v obratnem zaporedju, tako da iz nje nastane sinteza. Sinteza ima običajno obliko drevesa, ker tudi prekurzorji zahtevajo večstopenjsko sintezo.
Sklici[uredi | uredi kodo]
- ↑ Robert T. Morrison, Robert N. Boyd in Robert K. Boyd, Organic Chemistry, 6. izdaja, Benjamin Cummings, 1992, ISBN 0-13-643669-2
- ↑ John D. Roberts, Marjorie C. Caserio, Basic Principles of Organic Chemistry, W. A. Benjamin, Inc., 1964
- ↑ Richard F. in Sally J. Daley, Organic Chemistry, Online organic chemistry textbook. http://www.ochem4free.info
- ↑ M.A. Chevreul, Recherches chimiques sur les corps gras d'origine animale, F. G. Levrault, Pariz (1823) http://books.google.com/?id=94_H7hfQfS0C&printsec=frontcover&dq=Michel+Eug%C3%A8ne+Chevreul.
- ↑ F. Wöhler, Ueber künstliche Bildung des Harnstoffs, Annalen der Physik und Chemie, 88, 2 (1828), str. 253-256.http://gallica.bnf.fr/ark:/12148/bpt6k15097k/f261.chemindefer.
- ↑ I. Holme. Sir William Henry Perkin: a review of his life, work and legacy. Coloration Technology, 122, 5 (2006), str. 235-251.
- ↑ A. Kekulé: Ueber die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale, Annalen der Chemie und Pharmacie, 104, 2. izdaja (1857), str. 129-150. DOI 10.1002/jlac.18571040202
- ↑ A. Kekulé: Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs, Annalen der Chemie und Pharmacie, 106, 2. izdaja (1858), str. 129–159. DOI 10.1002/jlac.18581060202.
- ↑ A. S. Couper: Sur une nouvelle théorie chimique, Annales de chimie et de physique, 53 (1858), str. 488-489.
- ↑ Jeffreys, Diarmuid (11. avgust 2005). Aspirin: The Remarkable Story of a Wonder Drug. Bloomsbury USA. str. 73. ISBN 1582346003.
- ↑ »Salvarsan«. Chemical & Engineering News. Pridobljeno 1. februarja 2010.
- ↑ J.C. Arsenault in P.D. McDonald [2009]: Beginners Guide to Liquid Chromatography HPLC Primer
- ↑ Touchstone, Joseph C. (1993). "History of Chromatography". Journal of Liquid Chromatography, 16, 8, str. 1647-1665.
- ↑ "The Systematic Identification of Organic Compounds" R.L. Shriner, C.K.F. Hermann, T.C. Morrill, D.Y. Curtin, and R.C. Fuson John Wiley & Sons, 1997 0-471-59748-1
- ↑ G.E Martin, A.S. Zekter (1988). Two-Dimensional NMR Methods for Establishing Molecular Connectivity. New York: VCH Publishers. str. 59.
- ↑ Spectrometric identification of organic compounds Silverstein, Bassler, Morrill 4th Ed.
- ↑ Organic spectroscopy William Kemp. 2. izdaja, ISBN 033342171
- ↑ J.P. Glusker, Brief hisstory of chemical crystallography, II. Organic compounds, Historical atlas of crystallography, J. Lima de Faria, str. 91-102, [1]
- ↑ J. Brecher, Graphical representation of stereochemical configuration (IUPAC Recommendations 2006), Pure and Applied Chemistry http://iupac.org/publications/pac/78/10/1897/
- ↑ "Industrial polymers, chemistry of.« Encyclopædia Britannica. 2006
- ↑ Strategic Applications of Named Reactions in Organic Synthesis Laszlo Kurti, Barbara Czako Academic Press (March 4, 2005) ISBN 0-12-429785-4
Viri[uredi | uredi kodo]
- C. Schorlemmer: Ursprung und Entwicklung der organischen Chemie, Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984.
- H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: Organische Chemie. 3. izdaja, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8.
- K.P.C. Vollhardt und N.E. Schore: Organische Chemie. 4. izdaja, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
- H.A. Staab: Hundert Jahre organische Strukturchemie. Angewandte Chemie 70(2), str. 37–41 (1958), ISSN 0044-8249.
- J. Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter, Berlin - New York, 3. izdaja, 2003, ISBN 978-3-11-014683-7.
- H. Laatsch: Die Technik der organischen Trennungsanalyse, Georg Thieme Verlag Stuttgart/New York 1988, ISBN 3-13-722801-8
- R. L. Shriner, R. C.Fuson, D. Y. Curtin, T. C. Morrill: The Systematic Identification of Organic Compounds - a laboratory manual, 6. izdaja, John Wiley & Sons New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-78874-0.
Zunanje povezave[uredi | uredi kodo]
- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal - Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Ochem4free.info, Home of a full, online, peer-reviewed organic chemistry text
- CEM.MSU.edu, Virtual Textbook of Organic Chemistry
- Organic Chemistry Resources WorldWide - A collection of Links
- Thinkquest.org, Organic Families and Their Functional Groups
- OrgChemInfo.8k.com Arhivirano 2010-06-16 na Wayback Machine., A collection of Organic chemistry Resources
- Study Organic Chemistry, Resources for Success in Organic Chemistry
- organic-reaction.com, Organic Chemistry from Patents
