Alkin
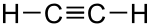

Alkin je nenasičen ogljikovodik, ki ima med ogljikovimi atomi vsaj eno trojno vez -C≡C-. Najenostavnejši alkin je etin (CH≡CH), bolj znan kot acetilen. Alkini tvorijo homologno vrsto s splošno formulo CnH2n-2.
Alkini niso topni v vodi, pač pa v nepolarnih topilih, na primer v etru, benzenu in tetraklorometanu. Njihova gostota je manjša od gostote vode. Njihova vrelišča naraščajo s številom ogljikovih atomov in so skoraj enaka vreliščem alkanov z enakim številom ogljikovih atomov. S kisikom zgorijo v ogljikov dioksid in vodo. Nekateri alkini tvorijo z zrakom eksplozivne zmesi.
Kemijske lastnosti[uredi | uredi kodo]
Alkini so zaradi trojne vezi mnogo bolj reaktivni in nestabilni od alkanov in alkenov.
Alkini s trojno vezjo za prvim ogljikovim atomom (terminalni alkini) in acetilen so proti pričakovanjem kisli: njihova pKa=25, kar je nekje med etanolom (pKa=16) in amonijakom (pKa=35). Kislost je pogojena s stabilnostjo nastale konjugirane baze, se pravi karboaniona, ta pa je pogojena z lastnostmi hibridne orbitale, ki vsebuje vezni elektronski par. V hibridni orbitali sp3 je udeležba orbitale s 25%, v orbitali sp2 33% in v orbitali sp 50%. Iz tega sledi, da je sp orbitala alkinov zaradi 50% deleža orbitale s bliže jedra, da je zato elektronski par elektrostatsko bolj stabilen, da se zato konjugirane baze alkinov laže tvorijo in so tudi bolj stabilne.[1]
Vez C-H v terminalnih alkinih kljub tem značilnostim ni močno kisla, zato so za tvorbo karboanionov potrebne močne baze, na primer natrij, natrijev amid, n-butillitij ali Grignardovi reagenti. V reakciji z bazami nastane anion terminalnega alkina oziroma njegova sol (acetilenid):
- 2RC≡CH + 2Na → 2RC≡CNa + H2
Reakcijo lahko posplošimo:
- RC≡CH + B → RC≡C− + HB+
pri čemer B pomeni močno bazo. Terminalni alkini lahko tvorijo acetilenide tudi z drugimi kovinami, na primer z bakrom in srebrom. Takšne spojine so zelo nestabilne in eksplozivne.
Acetilenidni anion je kot močan nukleofil zelo uporaben v organskih sintezah, na primer za formiranje novih vezi C-C.
Fizikalne lastnosti[uredi | uredi kodo]
V naslednji tabeli so prikazane nekatere fizikalne lastnosti najpomembnejših alkinov.[2]
| Ime | Formula | Tališče [°C] | Vrelišče [°C] | Gostota pri 20° [g cm-3]) |
| Etin | C2H2 | −83,8 | −80,8 | plin, 1,097 kg/m3 |
| Propin | C3H4 | -102,7 | -23,2 | 0,530 |
| But-1-in | C4H6 | -106 | 8,1 | 0,678 |
| But-2-in | C4H6 | -32,2 | 26,95 | 0,691 |
| Pent-1-in | C5H8 | -105 | 40,2 | 0,695 |
| Pent-2-in | C5H8 | -101 | 55 | 0,714 |
| Heks-1-in | C6H10 | -124 | 72 | 0,719 |
| Hept-1-in | C7H12 | -80 | 100 | 0,733 |
| Okt-1-in | C8H14 | -70 | 126 | 0,747 |
| Non-1-in | C9H16 | -65 | 151 | 0,763 |
| Dek-1-in | C10H18 | -35 | 181 | 0,770 |
Zgradba[uredi | uredi kodo]
Ogljikovi atomi v alkinih so sp hibridizirani: vsak atom ima dve p orbirali in dve hibridni sp orbitali. S prekrivanjem po ene sp orbitale iz vsakega ogljikovega atoma nastane σ-vez sp-sp, s prekrivanjem dveh p orbital iz vsakega ogljikovega atoma pa nastaneta dve π-vezi, skupaj torej tri vezi. Preostala sp orbitala tvori σ-vez s kakšnim drugim elementom, na primer z vodikom. σ-vezi, ki ležita na nasprotnih straneh trojne vezi, oklepata s trojno vezjo kot 180°.
V trojni vezi so udeleženi trije vezni elektronski pari, zato je vez močna: 839 kJ/mol. K tej energiji prispeva σ-vez 369 kJ/mol, prva π-vez 268 kJ/mol in druga π-vez 202 kJ/mol. Razdalja med ogljikovimi atomi je 1,21 Å, kar je mnogo manj kot pri alkenih (1,34 Å) in alkanih (1,53 Å).
Terminalni in interni alkini[uredi | uredi kodo]
Terminalni alkini so alkini, ki imajo vodikov atom vezan na najmanj en sp hibridizirani ogljikov atom, se pravi tisti, ki tvori trojno vez. Takšen je, na primer, propin (CH3-C≡CH):

in vsi alkini, ki imajo trojno vez za prvim in/ali pred zadnjim ogljikovim atomom.
Interni alkini imajo na sp hibridiziranem ogljiku namesto vodika vezan nek drug, običajno ogljikov, atom. Primer internega alkina je pent-2-in (2-pentin, CH3-C≡C-C2H5), v katerem je na eni strani trojne vezi metilna, na drugi strani pa etilna skupina:

Terminalni vodikov atom je rahlo kisel in se z zelo močnimi bazami odcepi in tvori soli. Ta lastnost je uporabna za ugotavljanje položaja trojne vezi: vzorcu se doda nekaj kapljic raztopine diaminosrebrovega(I) hidroksida (Ag(NH3)2OH), ki tvori s terminalnimi alkini belo oborino netopnega srebrovega acetilenida:
R-C≡CH + Ag(NH3)2OH → R-C≡CAg + NH4OH + NH3
Soli terminalnih alkinov s prehodnimi kovinami so v suhem stanju eksplozivne.
Ta lastnost je uporabna za podaljševanje verige ogljikovih atomov.
Sinteze[uredi | uredi kodo]
Alkini se običajno pripravljajo z eliminacijo vodikovih halogenidov (dehidrohalogeniranje) iz vicinalnih alkilnih dihalogenidov:
- R1-CHBr-CHBr-R2 → R1-C≡C-R2 + 2HBr
ali z reakcijo med acetilenidom in primarnim alkil halogenidom:
- R1-C≡CNa + Br-CH2-R2 → R1-C≡C-CH2-R2 + NaBr
Alkine se lahko sintetizira tudi iz vinil bromida s Fritsch-Buttenberg-Wiechellovo prerazporeditvijo:
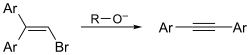
Na sliki je reakcija z aromatskim vinil bromidom, vendar poteče tudi z alifatskim vinilbromidom.[3]
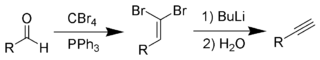
Alkini nastanejo tudi iz aldehidov s Corey-Fuchsovo reakcijo
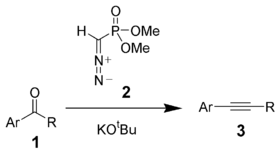
in iz aldehidov in ketonov s Seyferth-Gilbertovo homologacijo:
Reakcije[uredi | uredi kodo]
Alkini so zaradi trojne vezi mnogo bolj reaktivni kot alkani in alkeni in sodelujejo v mnogih kemijskih reakcijah.
Elektrofilna adicija[uredi | uredi kodo]
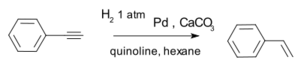
- Hidrogeniranje: z adicijo vodika nastanejo najprej alkeni in iz njih alkani. Primer: pretvorba fenilacetilena v stiren, ki jo učinkovito katalizira Lindlarjev katalizator:[4]
- Adicija halogena daje vinil ali alkil halogenide.
- Adicija vodikovega halogenida daje vinil ali alkil halogenide.
- Nicholasova reakcija.
- Adicija vode daje karbonilne spojine (pogosto preko enolnih intermediatov). Značilen primer adicije vode je hidroliza fenilacetilena v acetofenon z natrijevim tetraklorauratom v vodni raztopini metanola, ki je prikazana na naslednji reakcijski shemi.[5]. Reakcija poteče tudi z (Ph3P)AuCH3 [6].
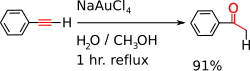
Cikloadicija[uredi | uredi kodo]
- Diels-Alderjeva reakcija z 2-pironom daje po eliminaciji ogljikovega dioksida aromatsko spojino.
- S Huisgenovo cikloadicijo azidov nastanejo triazoli.
- Bergmanova ciklizacija enedinov v aromatske spojine.
- Z alkinsko trimerizacijo nsatanejo aromatske spojine.
- Cikloadicija 2+2+1: s cikloadicijo med alkinom, alkenom in ogljikovim monoksidom (Pauson-Khandova reakcija) nastaneta α in β-ciklopentenon:[7][8]
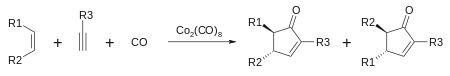
Metateza[uredi | uredi kodo]
- Alkinska metateza: iz alkinov nastanejo novi alkini.
- Eninska metateza: v reakciji z alkeni nastanejo butadieni.
Nukleofilna substitucija[uredi | uredi kodo]
- Z nukleofilnimi substitucijami kovinskih acetilenidov z alkilnimi halogenidi nastanejo nove vezi C-C.
Nulkeofilna adicija[uredi | uredi kodo]
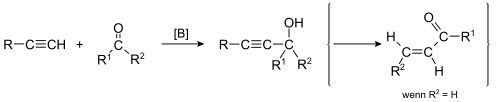
- V reakcijah kovinskih acetilenidov s karbonilnimi spojinami nastanejo najprej intermediati alkoksidi, iz njih pa s kislo obdelavo (reakcija Favorskega) hidroksialkini. Iz hidroksialkinov lahko s preureditvijo nastanejo nenasičeni ketoni:
Hidroboriranje[uredi | uredi kodo]
- Hidroboriranje alkinov z organskimi borani daje vinilne borane. Z naknadno oskidacijo vinilnih boranov z vodikovim peroksidom (H2O2) nastanejo aldehidi ali ketoni.
Oksidativno cepljenje[uredi | uredi kodo]
- Oksidativno cepljenje s kalijevim permanganatom (KMnO4) daje karboksilne kisline.
Migriranje trojne vezi[uredi | uredi kodo]
- Obdelava alkinov z močnimi bazami povzroči premik trojne vezi po ogljikovi verigi.
Pripajanje[uredi | uredi kodo]
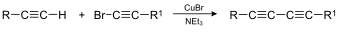
- Pripajanje alkinov na alkine povzroči nastanek dialkinov. Na reakcijski shemi je prikazano Cadiot-Chodkiewiczevo pripajane, znani pa sta tudi Glaserjevo in Eglintonovo pripajanje.
Reference[uredi | uredi kodo]
- ↑ »Francis A. Carey, Organic Chemistry«. Arhivirano iz prvotnega spletišča dne 26. oktobra 2008. Pridobljeno 15. februarja 2009.
- ↑ [Alkynes http://www.ucc.ie/academic/chem/dolchem/html/dict/alkynes.html]
- ↑ Rezaei, H.; Yamanoi, S.; Chemla, F.; Normant, J.F. (2000). »Fritsch-Buttenberg-Wiechell Rearrangement in the Aliphatic Series«. Org. Lett. 2 (4): 419–421. doi:10.1021/ol991117z.
- ↑ Organic Syntheses, Coll. Vol. 5, str. 880 (1973); Vol. 46, p.89 (1966). http://orgsynth.org/orgsyn/pdfs/CV5P0880.pdf
- ↑ Fukuda, Y.; Utimoto, K. "Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst". J. Org. Chem. 1991, 56, 3729–3731. DOI: 10.1021/jo00011a058
- ↑ Mizushima, E.; Cui, D.-M.; Nath, D. C. D.; Hayashi, T.; Tanaka, M. "Au(I)-Catalyzed hydratation of alkynes: 2,8-nonanedione". Organic Syntheses, Vol. 83, p.55 (2005). Link.
- ↑ P. L. Pauson and I. U. Khand. Ann. N.Y. Acad. Sci. 1977, 295, 2.
- ↑ Blanco-Urgoiti, J.; Añorbe, L.; Pérez-Serrano, L.; Domínguez, G.; Pérez-Castells, J. Chem. Soc. Rev. 2004, 33, 32. (doi:10.1039/b300976a)
