Vodikov peroksid
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
divodikov dioksid
| |||
| Druga imena
dioksidan, oksidanil
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.878 | ||
| EC število |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
| UN število | 2015 (>60% razt.) 2014 (20–60% razt.) 2984 (8–20% razt.) | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| H2O2 | |||
| Molska masa | 34,0147 g/mol | ||
| Videz | zelo svetlo modre barve, v raztopinah brezbarven | ||
| Vonj | rahlo oster | ||
| Gostota | 1,135 g/cm3 (20 °C, 30 %) 1,450 g/cm3 (20 °C, čist) | ||
| Tališče | −0,43 °C (31,23 °F; 272,72 K) | ||
| Vrelišče | 150,2 °C (302,4 °F; 423,3 K) | ||
| z vodo se meša | |||
| Topnost | topen v dietil etru in etanolu, netopen v bencinu | ||
| Kislost (pKa) | 11,75 | ||
| Lomni količnik (nD) | 1,4061 | ||
| Viskoznost | 1,245 cP (20 °C) | ||
| Dipolni moment | 2,26 D | ||
| Termokemija | |||
| Specifična toplota, C | 1,267 J/g·K (plinast) 2.619 J/g·K (tekoč) | ||
Std tvorbena
entalpija (ΔfH⦵298) |
-187,80 kJ/mol | ||
| Nevarnosti | |||
EU klasifikacija (DSD) (zastarelo)
|
|||
| R-stavki (zastarelo) | R5, R8, R20/22, R35 | ||
| S-stavki (zastarelo) | (S1/2), S17, S26, S28, S36/37/39, (S45) | ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | ni vnetljiv | ||
| Smrtni odmerek ali koncentracija (LD, LC): | |||
LD50 (srednji odmerek)
|
1518 mg/kg | ||
| Sorodne snovi | |||
| Sorodne snovi | voda ozon hidrazin vodikov disulfid dikisikov difluorid | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Vodikov peroksid je anorganska kemijska spojina s formulo H2O2. Je najenostavnejši peroksid, spojina z enojno vezjo med kisikovima atomoma. Čista spojina je modrikasta tekočina z malo večjo viskoznostjo od vode. Zaradi varnosti je običajno dostopen v vodnih raztopinah z različno koncentracijo. Koncentriran vodikov peroksid je močan oksidant in se uporablja kot pogonsko sredstvo v raketarstvu.[1]
Živi organizmi proizvajajo sledove vodikovega peroksida kot del imunskega sistema.
Lastnosti in zgradba[uredi | uredi kodo]
Lastnosti[uredi | uredi kodo]
Vrelišče vodikovega peroksida, dobljeno z ekstrapolacijo, je 150,2 °C, kar je približno 50 °C višje od vrelišča vode. V praksi pri tej temperaturi ni obstojen in je zaradi termičnega razpada potencialno eksploziven. Pri znižanem tlaku se lahko na več načinov varno destilira.[2]
Vodne raztopine[uredi | uredi kodo]

Lastnosti vodnih raztopin se zaradi vodikovih vezi med molekulami vode in peroksida razlikujejo od lastnosti čistega vodikovega peroksida. Vodikov peroksid in voda tvorita evtektično zmes z znižanim lediščem. Čista voda ima tališče pri 0 °C, čisti vodikov peroksid pri −0.43 °C, 50 vol % peroksid pa -51 °C. Enaka raztopina ima tudi nižje vrelišče od srednje vrednosti obeh vrelišč (125,1 °C). Njeno vrelišče je 14 °C višje od vrelišča čiste vode in 36,2 °C nižje od vrelišča čistega vodikovega peroksida.[3]
| H2O2 (v/v) | Gostota (g/cm3) | Temperatura (°C) |
|---|---|---|
| 3% | 1,0095 | 15 |
| 27% | 1,10 | 20 |
| 35% | 1,13 | 20 |
| 50% | 1,20 | 20 |
| 70% | 1,29 | 20 |
| 75% | 1,33 | 20 |
| 96% | 1,42 | 20 |
| 98% | 1,43 | 20 |
| 100% | 1,450 | 20 |
Zgradba[uredi | uredi kodo]
Vodikov peroksid ima neravninsko molekulo s simetrijo C2. Med atomoma O-O je enojna vez, vendar ima molekula relativno visoko rotacijsko oviro 2460 cm-1 (29,45 kJ/mol).[4] Rotacijska ovira etana je na primer samo 12,5 kJ/mol. Povišano oviro se pripisuje odboju med prostima elektronskima paroma na sosednjih kisikovih atomih, zaradi katerih je vodikov peroksid atropizomeren.
Molekularni zgradbi plinastega in kristaliničnega H2O2 sta povsem drugačni. Razliko se pripisuje vplivu vodikovih vezi, ki jih v plinastem stanju ni.[5] Kristali vodikovega peroksida so tetragonalni s prostorsko skupino .[6]
Primerjava z analogi[uredi | uredi kodo]
Vodikov peroksid ima številne strukturna analoge s splošno formulo Hm−E−E−Hn. V preglednici so prikazane tudi lastnosti vode, ki sicer ni njegov analog. Vodikov peroksid ima (teoretično) najvišje vrelišče v tem nizu spojin, v katerem je E lahko kisik, dušik ali žveplo. V primerjavi s hidrazinom in vodo ima tudi dokaj visoko tališče. Znatno laže kristalizira samo hidroksilamin, kar kaže na zelo močne vodikove vezi. Difosfan (H2P−PH2) in vodikov disulfid (HS−SH) imata poleg šibkih vodikovih vezi tudi majhno kemijsko podobnost z vodikovim peroksidom. Vsi našteti analogi so termodinamsko nestabilni in imajo neravninsko zgradbo molekule, ki je posledica odboja med neveznimi elektronskimi pari sosednjih atomov −E−E−.
| Ime | Formula | Molska masa (g/mol) | Tališče (°C) | Vrelišče (°C) |
|---|---|---|---|---|
| Vodikov peroksid | HOOH | 34,01 | −0,43 | 150,2* |
| Voda | HOH | 18,02 | 0,00 | 99,98 |
| Vodikov disulfid | HSSH | 66,15 | −89,6 | 70,7 |
| Hidrazin | H2NNH2 | 32,05 | 2 | 114 |
| Hidroksilamin | NH2OH | 33,03 | 33 | 58* |
| Difosfan | H2PPH2 | 65,98 | −99 | 63,5* |
Odkritje[uredi | uredi kodo]
Vodikov peroksid je prvi opisal Louis Jacques Thénard leta 1818. Pripravil ga je z obdelavo barijevega peroksida z dušikovo kislino.[7] V dodelani različici postopka se je namesto dušikove uporabila klorovodikova kislina, s kasnejšim dodatkom žveplove kisline pa se je iz reakcijske zmesi oboril stranski proizvod barijev sulfat. Thénardov postopek se je uporabljal od konca 19. do sredine 20. stoletja.[8]
Za čist vodikov peroksid se je dolgo domnevalo, da je nestabilen, ker so vsi zgodnji poskusi za njegovo pridobivanje iz vodne raztopine, spodleteli. Njegova nestabilnost je posledica sledov nečistoč, predvsem soli prehodnih kovin, ki katalizirajo njegov razpad. Čist vodikov peroksid je skoraj 80 let po njegovem odkritju prvi pridobil Richard Wolffenstein leta 1894 z vakuumsko destilacijo.[9]
Določitev zgradbe njegove molekule se je pokazala kot zelo težka. Njegovo molekulsko maso je leta 1892 določil italijanski fizikalni kemik Giacomo Carrara iz znižanja tališča, ki je potrdila, da je njegova kemijska formula H2O2.[10] Njegovo odkritje sta leta 1893 potrdila William Ridgely Orndorff in John White.[11] Strokovnjaki so predlagali najmanj šest molekularnih struktur. Kingzet je predlagal strukturoH2O=O.[12] Joseph Mellor je predlagal kar tri hipotetične strukture,[13] škotski fizik Gordon Sutherland pa je predlagal strukturo, ki je zelo podobna sedaj sprejeti in se je kasneje izkazala kot prava.[14][15]
Proizvodnja[uredi | uredi kodo]
Vodikov peroksid se je sprva proizvajal s hidrolizo amonijevega persulfata, ki se je proizvajal z elektrolizo raztopine amonijevega bisulfata (NH4HSO4) v žveplovi kislini:
- (NH4)2S2O8 + 2H2O → H2O2 + 2(NH4)HSO4
Sedaj se proizvaja skoraj izključno po antrakinonskem postopku, ki so ga odkrili leta 1936 in ga leta 1939 patentirali. Postopek se začne z redukcijo antrakinona, na primer 2-etilantrakinona ali 2-amilantrakinona, z vodikom na paladijevem katalizatorju. Antrahidrokinon se zatem z oksidacijo vrne v začetni antrakinon, pri čemer kot stranski produkt nastaja vodikov peroksid. V večini industrijskih procesov se antrahidrokinon oksidira z vpihavanjem komprimiranega zraka v reakcijsko razropino. Kisik iz zraka reagira z nestabilnimi vodikovimi atomi hidroksi skupin in tvori vodikov peroksid in hkrati regenerira antrakinon. Vodikov peroksid se zatem odstrani iz reakcijske raztopine in postopek se ponovi.[16][17]
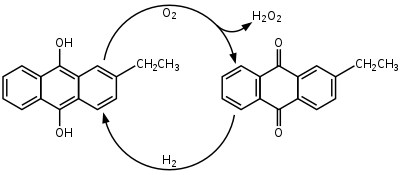
Proces se lahko zapiše s poenostavljeno kemijsko enačbo:[16]
- H+2O2 → H2O2
Gospodarnost postopka je zelo odvisna od učinkovitega recikliranja dragega kinona, topil za ekstrakcijo peroksida in katalizatorja za hidrogeniranje.
Že dolgo časa so poskušajo razviti tudi postopki za sintezo vodikovega peroksida iz vodika in kisika. Sinteza je s termodinamskega stališča težavna, ker v procesu mnogo laže nastaja voda. Večina razvitih postopkov temelji na fino dispergiranih kovinskih katalizatorjih.[18][19] Noben postopek še ni dodelan do te mere, da bi se lahko uporabil v industriji.
Dostopnost[uredi | uredi kodo]

Vodikov peroksid se prodaja v vodnih raztopinah. Za potrošnike je običajno na voljo v drogerijah in lekarnah v koncentracijah 3–6 vol %. Koncentracije se včasih izražajo tudi z volumnom sproščenega kisika: iz 1 ml raztopine z 20 vol % peroksida se pri popolnem razpadu razvije 20 mL kisika. Za laboratorijsko rabo je najpogostejša 30 % raztopina. Na razpolago so tudi 70-98% raztopine, ki so mnogo bolj nevarne za rokovanje in zahtevajo posebne skladiščne pogoje. Kupec mora zanje praviloma dovoliti dobaviteljeve inšpekcijske preglede.
Leta 1994 je bila svetovna proizvodnja H2O2 približno 1,9 milijona ton in je do leta 2006 narasla na 2,2 milijona ton.[20] Večina peroksida je imela koncentracijo največ 70 %.[21][22]
Reakcije[uredi | uredi kodo]
Razpad[uredi | uredi kodo]
Vodikov peroksid je termodinamsko nestabilen in razpade v vodo in kisik:
- 2H2O2 → 2H2O +O2; ΔHo = −98,2 kJ•mol−1, ΔS = 70.5 J•mol−1•K−1
Z naraščajočo temperaturo, koncentracijo in pH hitrost razpadanja raste. Najbolj stabilen je v hladnih razredčenih in kislih raztopinah. Razpadanje katalizirajo razne spojine, vključno z večino prehodnih kovin in njihovih spojin, na primer manganov dioksid, srebro in platina.[23] Nekateri kovinski ioni, na primer Fe2+ in Ti3+, sprožijo rasikalni mehanizem razpada, v katerem nastajajo prosti radikali HO· in HOO·.
Med nekovinske katalizatorje spada na primer kalijev jodid, ki povzroči še posebej hiter razpad. Razgrajujejo ga tudi encimi katalaze. Med razpadanjem se sproščata kisik in toplota, kar je lahko zelo nevarno pri razlitju koncentriranega peroksida po vnetljivih snoveh, ker sprožita takojšen požar.
Redoks reakcije[uredi | uredi kodo]
Vodikov peroksid ima oksidativne in reduktivne lastnosti, odvisne od pH. V kislih raztopinah je eden od najmočnejših znanih oksidantov, močnejši od klora, klorovega dioksida in kalijevega permanganata. S katalizatorji se lahko pretvori v hidroksilne radikale (•OH), ki so tudi zelo reaktivni.
| Oksidant/reducirani produkt | Oksidacijski potencial [V] |
|---|---|
| fluor/vodikov fluorid | 3,0 |
| ozon/kisik | 2,1 |
| vodikov peroksid/voda | 1,8 |
| kalijev permanganat/manganov dioksid | 1,7 |
| klorov dioksid/HClO | 1,5 |
| klor/klorid | 1,4 |
V kislih raztopinah oksidira Fe2+ v Fe3+:
- Fe2+(aq) + H2O2 + 2 H+(aq) → 2Fe3+(aq) + 2 H2O(l)
in sulfite (SO2−
3) v sulfate (SO2−
4), kalijev permanganat pa v kislem reducira v Mn2+. V alkalnih pogojih so nekatere reakcije reverzibilne. Mn2+ na primer se oksidira v Mn4+.
V bazični raztopinah lahko vodikov peroksid reducira različne anorganske ione. Tudi v teh reakcijah se sprošča kisik, zato se redukciji natrijevega hipoklorita (NaOCl) in kalijevega permanganata (KMnO4) uporabljata za pripravo kisika v kemijskih laboratorijih:
- NaOCl + H2O2 → O2 + NaCl + H2O
- 2KMnO4 + 3 H2O2 → 2 MnO2 + 2 KOH + 2H2O + 3 O2
Organske reakcije[uredi | uredi kodo]
Vodikov peroksid se v organski kemiji pogosto uporablja kot oksidant, na primer za oksidacijo tioetrov v sulfokside:[24][25]
- Ph−S−CH3 + H2O2 → Ph−S(O)−CH3 + H2O
Alkalni vodikov peroksid se uporablja za epoksidacijo elektronsko deficitarnih alkenov, na primer derivatov akrilne kisline, in alkilboranov v alkohole. Vodikov peroksid je tudi osnovni reagent v Dakinovih oksidacijskih procesih:

Osnova za druge peroksidne spojine[uredi | uredi kodo]
Vodikov peroksid je rahlo kisel in z mnogo kovinami tvori hidroperokside in peroksidne soli.
Kovinske okside pretvori v ustrezne perokside. Primer: kromova kislina (CrO3) se po obdelavi z vodikovim peroksidom pretvori v nestabilen moder peroksid CrO(O2)2. Tovrstne reakcije se uporabljajo za industrijsko proizvodnjo perokso anionov. V reakciji z boraksom na primer nastane natrijev perborat, ki se uporablja kot belilo v pralnih praških:
- Na2B4O7 + 4 H2O2 + 2 NaOH → 2 Na2B2O4(OH)4 + H2O
H2O2 pretvori karboksilne kisline (RCOOH) v peroksi kisline (RC(O)OH), ki se uporabljajo kot oksidanti. Z acetonom (H3C−CO−CH3) tvori aceton peroskid:

z ozonom pa vodikov trioksid (HOOOH), znan tudi kot trioksidan. V reakciji z ureo nastane adukt vodikov peroksid-urea, ki se uporablja za beljenje zob. Kislo-bazični adukt s trifenilfosfin oksidom se v nekaterih reakcijah uporablja kot nosilec H2O2.
Biološka vloga[uredi | uredi kodo]
Vodikov peroksid je ena od dveh glavnih kemikalij obrambnega sistema več vrst hroščev iz družine krešičev, ki popršijo napadalca z zmesjo hidrokinona in peroksida in ga odženejo.
Znanstveniki so odkrili, da igra vodikov peroksid pomembno vlogo v imunskem sistemu. Ugotovili so, da se v poškodovanih celicah ribic cebric poveča vsebnost vodikovega peroksida, ki usmeri bele krvničke proti poškodovanemu mestu, da začnejo zdraviti poškodbo. Če so geni, ki sprožijo razvijanje peroksida, okvarjeni, se bele krvničke ne zbirajo na poškodovanem mestu. Iz poskusov na ribah je mogoče sklepati, da se zaradi genske podobnosti enaki procesi morda dogajajo tudi pri ljudeh. Študije so pokazale tudi to, da imajo astmatiki v pljučih višjo raven vodikovega peroksida kot zdravi ljudje, kar bi lahko pojasnilo, zakaj imajo v pljučih neprimerno visoko raven belih krvničk.[27]
Vodikov peroksid ima pomembno vlogo signalizacijske molekule v krmiljenju zelo različnih bioloških procesov.[28] Je glavni dejavnik v radikalni teoriji staranja, ki temelji na tem, kako vodikov peroksid razpade v hidroksilne radikale in kako superoksidni radikali (O−
2) kot stranski produkt celične presnove reagirajo z vodo in tvorijo vodikov peroksid.[29] Hidroksilni radikali zlahka reagirajo in poškodujejo vitalne celične komponente, zlasti tistih v mitohondriju.[30] Najmanj ena študija poskuša povezati tvorjenje vodikovega peroksida z rakom.[31]
Vsebnost vodikovega peroksida v bioloških sistemih se lahko določa s fluorimetrijskim testom.[32]
Uporaba[uredi | uredi kodo]
Industrija[uredi | uredi kodo]
Približno 60 % svetovne proizvodnje vodikovega peroksida se porabi za beljenje celuloze in papirja.[20] Drugi največji porabnik je proizvodnja natrijevega perkarbonata in natrijevega perborata, ki se uporabljata kot blagi belili v pralnih praških.
Uporablja se tudi za proizvodnjo različnih organskih peroksidov, od katerih je najpogostejši benzoil peroksid, v polimerizacijah, kot sredstvo za beljenje moke in zdravljenje aken in proizvodnjo peroksi kislin, na primer peroksiocetne kisline in meta-kloroperoksibenzojeve kisline.
Vodikov peroksid se uporablja za obdelavo nekaterih odpadnih vod. V oksidacijskih procesih[33] nastajajo izredno reaktivni hidroksilni radikali (•OH). ki razgradijo tudi zelo trdožive organske nečistoče, na primer aromatske in halogenirane spojine, ki jih je sicer zelo težko odstraniti. Oksidirajo tudi žveplove spojine, s čimer se močno zmanjša predvsem neprijeten vonj.[34]
Zdravstvo[uredi | uredi kodo]
Razkužilo[uredi | uredi kodo]

Vodikov peroksid se prišteva med okolju prijazna belila in alternativo za klorova belila.
Uporablja se tudi za razkuževanje različnih površin,[35] ameriška FDA pa ga priznava tudi kot varno antimikrobno sredstvo.[36] V nekaterih bolnišnicah se je v nekaterih primerih izkazal kot neučinkovit, zato se za razkuževanje namesto njega priporoča klorova belila.[37]
V preteklosti se je uporabljal za razkuževanje ran, pogosto zaradi nizke cene in lažje dostopnosti v primerjavi z drugimi antiseptiki. Sedaj se nanj gleda kot na sredstvo, ki upočasnjuje celjenje in povzroča brazgotinjenje, ker uničuje novonastale kožne celice.[38] Zdravljenje lahko sproži samo v zelo nizkih koncentracijah in če se ne uporabi večkrat.[39] V kirurgiji lahko njegova uporaba povzroči plinsko embolijo.[40]
Pogonsko gorivo[uredi | uredi kodo]

Zelo koncentriran vodikov peroksid je lahko samostojno pogonsko gorivo za reakcijske motorje ali oksidant v kombinaciji z drugimi gorivi.
V prvem primeru se 70-98 % vodikov peroksid vbrizgava v reakcijsko komoro, v kateri na običajno srebrni ali platinski katalizatorski mrežici razpade v vodno paro in kisik. Plina s temperaturo preko 600 °C nato pod visokim tlakom izhajata skozi pogonsko šobo. Maksimalni specifični impulz vodikovega peroksida (Isp) je 161 s (1,6 kN·s/kg) in je mnogo manjši od specifičnega impulza hidrazina.
Če služi vodikov peroksid kot oksidant za druga goriva, lahko specifični impulz doseže vrednost 350 s (3,5 kN·s/kg) in je odvisen od goriva. Je nekoliko nižji od Isp tekočega kisika, peroksid pa je gostejši, lažji za skladiščenje, nekriogen in bolj enostaven za uporabo v plinskih turbinah. Uporaben je tudi za hlajenje raketnih motorjev. V drugi svetovni vojni se je izkazal kot uspešen oksidant v nemških reakcijskih motorjih (T-Stoff za reakcijsko letalo Messerschmitt Me 163 Komet).
V 1940. in 1950. letih se je za pogon podmornic med plovbo pod površino uporabljala Walterjeva turbina na vodikov peroksid. Turbina je bila preglasna in je zahtevala več vzdrževanje v primerjavi z dizelskim motorjem, zato so jo opustili. Vodikov peroksid se je uporabljal tudi kot gorivo ali oksidant v nekaterih vrstah torpedov, vendar so ga zaradi varnosti opustili. Iztekanje vodikovega peroksida je bil domneven vzrok za potopitev britanske podmornice Sidon (P259) in ruske podmornice Kursk. Japonci so med preskušanjem torpedov ugotovili, da koncentriran vodikov peroksid na pravokotnih kolenih cevovodov pogosto povzroča eksplozije v podmornicah in torpedih. Torpedo 2000, ki ga je razvil SAAB in ga uporablja švedska vojna mornarica, poganja batni motor na kerozin in vodikov peroksid.[41][42]
Eksplozivi[uredi | uredi kodo]
Vodikov peroksid se uporablja za pripravo eksplozivov na osnovi organskih peroksidov, na primer aceton peroksida, ki se uporablja v improviziranih eksplozivnih napravah.[43] Peroksidni eksplozivi hitro razpadajo in so zato neprimerno za komercialno ali vojaško rabo.
Druga raba[uredi | uredi kodo]
V gospodinjstvih se uporablja predvsem kot čistilo in razkužilo.
Kemične svetilke[uredi | uredi kodo]

Vodikov peroksid reagira z nekaterimi estri, na primer z difenil oksalatom in fenil oksalatom, in povzroči kemiluminiscenco. Pojav se najpogosteje izkorišča v kemičnih svetilkah.
Vrtičkarstvo[uredi | uredi kodo]
Nekateri vrtičkarji in hidroponiki zagovarjajo uporabo zelo razredčene raztopine vodikovega peroksida v zalivanje posevkov. Med njegovim spontanim razpadom se sprošča kisik, ki krepi koreninski sistem rastline in pomaga zdraviti celično korensko smrt zaradi pomanjkanja kisika in zatira številne škodljivce.[44][45][46]
Akvaristika[uredi | uredi kodo]
Laboratorijski testi, ki so jih opravili v zadnjih letih, so pokazali, da se vodikov peroksid lahko varno uporablja kot vir kisika za majhne akvarijske ribe. Razpadanje peroksida sprožijo katalizatorji, na primer manganov dioksid.[47]
Varnost[uredi | uredi kodo]
Razredčen vodikov peroksid s koncentracijami do 6 % je praviloma dostopen v lekarnah in drogerijah.
Bolj koncentrirane raztopine so nevarne in neprimerna za uživanje in morajo biti zato opremljene z varnostnim listom. Zelo koncentriran peroksid je močan oksidant, ki najeda številne materiale, med njimi tudi človeško kožo. Vodikov peroksid s koncentracijami preko 40 % je nevaren tudi za okolje.
Vodikov peroksid se mora hraniti v hladnem, suhem in dobro prezračevanem prostoru, v katerem ni vnetljivih ali gorljivih snovi.[48] Posode morajo biti iz inertnih gradiv, kot so nerjaveče jeklo, steklo, plastika in aluminijeve zlitine.[49] Posode morajo biti neprozorne, ker ga svetloba hitro razgradi. Laboratorijske steklenice so zato običajno iz rjavega stekla, ki filtrira svetlobo.
Razredčen in koncentriran vodikov peroksid lahko povzroči več nevarnosti, od katerih je najbolj nevarna tvorba eksplozivnih zmesi z organskimi spojinami.[50] Zelo koncentriran vodikov peroksid je nestabilen in lahko povzroči eksplozijo preostale tekočine. Destilacija vodikovega peroksida pri običajnih tlakih je torej zelo nevarna. Razredčene raztopine za domačo rabo so jedke in dražijo oči, sluznico in kožo.[51] Še posebej nevarno je zaužitje, ker se v želodcu razgradi in sprosti veliko količino plina, ki povzroči notranje krvavitve. Vdihavanje več kot 10 % vodikovega peroksida lahko povzroči hudo draženje pljuč.[52]
Pare vodikovega peroksida so zaradi znatnega parnega tlaka (1,2 kPa pri 50 °C)[53] lahko nevarne. Meja neposredne nevarnosti za zdravje in življenje je samo 75 ppm.[54] Ameriški Nacionalni inštitut za zdravje in varstvo pri delu je na podlagi osemurnega ponderiranega povprečja izračunal zgornjo dopustno koncentracijo v zraku 1 ppm.[50] Vodikov peroksid je razvrščen tudi med »snovi, ki pri živalih povzročajo raka, z neznanim vplivom na človeka«.[55]
Zgodovinski dogodki[uredi | uredi kodo]
- 16. julija 1934 je v Kummersdorfu, Nemčija, eksplodirala raketa s pogonom na vodikov peroksid. V eksploziji so umrli trije ljudje, zato se je Wernher von Braun odločil, da vodikovega peroksida ne bo več uporabljal.
- Med drugo svetovno vojno so zdravniki v nemških koncentracijskih taboriščih delali poskuse za ubijanje ljudi z vbrizgavanjem vodikovega peroksida.[56]
- 28. oktobra 1998 je več ljudi dobilo manjše poškodbe med razlitjem vodikovega peroksida na letalu, ki je letelo iz Orlanda v Memphis.[57]
- Vodikov peroksid naj bi bil ena od sestavin v bombah v Londonu 21. julija 2005, ki na srečo niso eksplodirale.[58]
- 12. avgusta 2000 je eksplodirala ruska podmornica K-141 Kursk. Edino zanesljivo poročilo o dogodku navaja, da je eksplozijo povzročila napaka ne enem od torpedov s pogonom na vodikov peroksid, ki je verjetno uhajal skozi korodirano ohišje torpeda. Podobna nesreča se je zgodila leta 1955 na britanski podmornici HMS Sidon.
- 15. avgusta 2010 je v 15. nadstropju zgradbe na Times Squareu v New Yorku izteklo približno 110 litrov čistila, za katerega so gasilci trdili, da je bil vodikov peroksid. Med razlitjem ni bil nihče poškodovan.[59]
Sklici[uredi | uredi kodo]
- ↑ C. N. Hill (2001). A Vertical Empire: The History of the UK Rocket and Space Programme, 1950–1971. Imperial College Press. ISBN 978-1-86094-268-6.
- ↑ Riley (1963). Handbook of preparative inorganic chemistry. 1. del. 2. dopolnjena izdaja. New York, N.Y.: Academic Press. str. 140. ISBN 978-0121266011.
- ↑ Varnostni list 60 vol % H2O2 Arhivirano 2021-04-26 na Wayback Machine..
- ↑ R.H. Hunt, R.A. Leacock, C.W. Peters, T. Karl (1965). Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential. The Journal of Chemical Physics 42 (6): 1931. doi: 10.1063/1.1696228.
- ↑ D.A. Dougherty, E.V. Anslyn (2005). Modern Physical Organic Chemistry. University Science. str 122. ISBN 1-891389-31-9.
- ↑ S.C. Abrahams, R.L. Collin, W. N. Lipscomb (1. januar 1951). The crystal structure of hydrogen peroxide. Acta Crystallographica 4 (1): 15–20. doi: 10.1107/S0365110X51000039.
- ↑ L. J. Thénard (1818). Observations sur des nouvelles combinaisons entre l’oxigène et divers acides. Annales de chimie et de physique 8: 306–312.
- ↑ C. W. Jones, J. H. Clark (1999). Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry.
- ↑ R. Wolffenstein (oktober 1894). Concentration und Destillation von Wasserstoffsuperoxyd. Berichte der deutschen chemischen Gesellschaft, 27 (3): 3307–3312. doi: 10.1002/cber.189402703127.
- ↑ G. Carrara (1892). Sul peso molecolare e sul potere rifrangente dell' acqua ossigenata. Atti della Reale Accademia dei Lincei, 5, 1 (2): 19-24.
- ↑ W.R. Orndorff, J. White (1893).
- ↑ C.T. Kingzett (29. september 1882). On the activity of oxygen and the mode of formation of hydrogen dioxide. The Chemical News, 46 (1192): 141-142.
- ↑ J.W. Mellor (1922). A Comprehensive Treatise on Inorganic and Theoretical Chemistry. 1. del. London: Longmans, Green and Co.. str. 952-956.
- ↑ W.G. Penney, G.B.B.M. Sutherland (1934). The theory of the structure of hydrogen peroxide and hydrazine. Journal of Chemical Physics, 2 (8) : 492-498.
- ↑ W.G. Penney, G.B.B.M. Sutherland (1934). A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation. Transactions of the Faraday Society, 30: 898-902.
- ↑ 16,0 16,1 Campos-Martin, Jose M.; Blanco-Brieva, Gema; Fierro, Jose L. G. (27. oktober 2006). »Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process«. Angewandte Chemie International Edition. 45 (42): 6962–6984. doi:10.1002/anie.200503779. PMID 17039551.
- ↑ H. Riedl, G. Pfleiderer. U.S. Patent 2,158,525 (2. oktober 1936 v ZDA in 10. oktober 1935 v Nemčiji) v korist I. G. Farbenindustrie, Nemčija.
- ↑ M. Noritaka, G. Centi, S. Perathoner, S. Abate (2009). Direct Synthesis of Hydrogen Peroxide: Recent Advances. Modern Heterogeneous Oxidation Catalysis: Design, Reactions and Characterization. Wiley-VCH. doi: 10.1002/9783527627547.ch8.
- ↑ Edwards, Jennifer K.; Solsona, Benjamin; N, Edwin Ntainjua; Carley, Albert F.; Herzing, Andrew A.; Kiely, Christopher J.; Hutchings, Graham J. (20. februar 2009). »Switching Off Hydrogen Peroxide Hydrogenation in the Direct Synthesis Process«. Science. 323 (5917): 1037–1041. doi:10.1126/science.1168980.
- ↑ 20,0 20,1 R. Hage, A. Lienke (2005). Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching. Angewandte Chemie International Edition 45 (2): 206–222. doi: 10.1002/anie.200500525. PMID 16342123.
- ↑ Hydrogen Peroxide Synthesis researchgate.
- ↑ Research for Ministry of Science and Technology. Government of India.
- ↑ R.H. Petrucci (2007). General Chemistry: Principles & Modern Applications. 9. Izdaja. Prentice Hall. str. 606. ISBN 0-13-149330-2.
- ↑ K. S. Ravikumar, V. Kesavan, B. Crousse, D. Bonnet-Delpon, J-P. Bégué (2003). Mild and Selective Oxidation of Sulfur Compounds in Trifluoroethanol: Diphenyldisulfide and Methyl phenyl Sulfoxide. Org. Synth. 80, 184. doi: 10.15227/orgsyn.080.0184.
- ↑ W. L. Xu, Y. Z. Li, Q. S. Zhang, H. S. ; Zhu (2004). A Selective, Convenient, and Efficient Conversion of Sulfides to Sulfoxides. Synthesis (2): 227. doi: 10.1055/s-2004-44387.
- ↑ Z. Wang, urednik (2009). Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey. Str. 829. ISBN 978-0-471-70450-8.
- ↑ Niethammer P; Grabher C; Look AT; Mitchison TJ (2009). »A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish«. Nature. Zv. 459, št. 7249. str. 996–9. doi:10.1038/nature08119. PMC 2803098. PMID 19494811.
- ↑ Veal EA; Day AM; Morgan BA (2007). »Hydrogen peroxide sensing and signaling«. Mol Cell. Zv. 26, št. 1. str. 1–14. doi:10.1016/j.molcel.2007.03.016. PMID 17434122.
- ↑ Weindruch R (1996). »Calorie Restriction and Aging«. Scientific American. str. 49–52.
- ↑ Giorgio M; Trinei M; Migliaccio E; Pelicci PG (2007). »Hydrogen peroxide: metabolic by-product or a common mediator of ageing signals?«. Nat Rev Mol Cell Biol. Zv. 8, št. 9. str. 722–8. doi:10.1038/nrm2240. PMID 17700625.
- ↑ López-Lázaro M (2007). »Dual role of hydrogen peroxide in cancer: possible relevance to cancer chemoprevention and therapy«. Cancer Lett. Zv. 252, št. 1. str. 1–8. doi:10.1016/j.canlet.2006.10.029. PMID 17150302.
- ↑ Rapoport R; Hanukoglu I; Sklan D (1994). »A fluorimetric assay for hydrogen peroxide, suitable for NAD(P)H-dependent superoxide generating redox systems«. Anal Biochem. Zv. 218, št. 2. str. 309–13. doi:10.1006/abio.1994.1183. PMID 8074285.
- ↑ A. Matthew, urednik (2003). Chemical degradation methods for wastes and pollutants environmental and industrial applications. New York: M. Dekker. str. 165. ISBN 9780203912553.
- ↑ G. Goor, J. Glenneberg, S. Jacobi (2007). Hydrogen Peroxide. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi: 10.1002/14356007.a13_443.pub2.
- ↑ J.M. Ascenzi (1996). Handbook of Disinfectant and Antiseptics. CRC Press. Str. 161. ISBN 0824795245.
- ↑ Sec. 184.1366 Hydrogen peroxide. U.S. Government Printing Office. 1. april 2001. Pridobljeno 7. julija 2007.
- ↑ Bleach vs. Hydrogen Peroxide. Canadian Agency for Durgs and Technology in Health website.
- ↑ T.A. Wilgus, V.K. Bergdall, L.A. Dipietro, T.M. Oberyszyn (2005). Hydrogen peroxide disrupts scarless fetal wound repair. Wound Repair Regen 13 (5): 513–9. doi: 10.1111/j.1067-1927.2005.00072.x. PMID 16176460.
- ↑ A.E.K. Loo, Y.T. Wong, R. Ho, M. Wasser, T. Du, W.T. Ng, B. Halliwell, J. Sastre (13. november 2012). Effects of Hydrogen Peroxide on Wound Healing in Mice in Relation to Oxidative Damage. PLoS ONE 7 (11): e49215. doi: 10.1371/journal.pone.0049215.
- ↑ A. Shaw, A. Cooperman, J. Fusco (1967). Gas embolism produced by hydrogen peroxide. N Engl J Med 277: 238–241.
- ↑ R. Scott (november 1997). Homing Instincts. Jane's Navy Steam generated by catalytic decomposition of 80–90% hydrogen peroxide was used for driving the turbopump turbines of the V-2 rockets, the X-15 rocketplanes, the early Centaur RL-10 engines and is still used on Soyuz for that purpose to-day. International.
- ↑ Soyuz using hydrogen peroxide propellant Arhivirano 2013-08-05 na Wayback Machine.. NASA website.
- ↑ Tiny cheap deadly hydrogen peroxide bombs. NBC News. 2009. Pridobljeno 11. novembra 2014.
- ↑ B. Fredrickson. Hydrogen Peroxide and Horticulture. Pridobljeno 25. januarja 2009.
- ↑ Ways to use hydrogen peroxide in the garden.
- ↑ S.P. Bhattarai, N. Su, D.J. Midmore (2005). Unlocks Yield Potentials of Crops in Oxygen-Limited Soil Environments. Advances in Agronomy. Advances in Agronomy 88: 313–377. doi: 10.1016/S0065-2113(05)88008-3. ISBN 9780120007868.
- ↑ http://www.great-lakes.org/Wkly_news/07-07-03.html#Oxygen great-lakes.org.
- ↑ Hydrogen Peroxide 30-50%. Material Safety Data Sheet Arhivirano 2015-02-11 na Wayback Machine.. Pridobljeno 12. novembra 2014.
- ↑ Material Compatibility with Hydrogen Peroxide (H2O2). Pridobljeno 12. novembra 2014.
- ↑ 50,0 50,1 Occupational Safety and Health Guideline for Hydrogen Peroxide Arhivirano 2013-05-13 na Wayback Machine..
- ↑ Varnostni list 3 % vodikovega peroksida. Pridobljeno 12. novembra 2014.
- ↑ http://www.atsdr.cdc.gov/toxfaqs/tfacts174.pdf Hydrogen Peroxide. Agency for Toxic Substances and Disease Registry. Pridobljeno 12. novembra 2014.
- ↑ Handbook of Chemistry and Physics. 76. izdaja. 1995–1996.
- ↑ Documentation for Immediately Dangerous to Life or Health Concentrations (IDLH): NIOSH. National Institute for Occupational Safety and Health. Chemical Listing and Documentation of Revised IDLH Values. Datum: 3. januar 1995.
- ↑ Threshold Limit Values for Chemical Substances and Physical Agents & Biological Exposure Indices, ACGIH.
- ↑ R.J. Lifton. The Nazi Doctors Arhivirano 2007-09-15 na Wayback Machine..
- ↑ Hazardous Materials Incident Brief DCA-99-MZ-001. Spill of undeclared shipment of hazardous materials in cargo compartment of aircraft. National Transportation Safety Board. 28. oktober 1998.
- ↑ Four Men Found Guilty in Plot to Blow Up London's Transit System. FOXNews.com. 9. julij 2007.
- ↑ S. Wheaton (16. avgust 2010). Bleach Spill Shuts Part of Times Square. The New York Times.
Viri[uredi | uredi kodo]
- J. Drabowicz in drugi (1994), G. Capozzi in drugi (urednik). The Syntheses of Sulphones, Sulphoxides and Cyclic Sulphides. Chichester UK: John Wiley & Sons. str. 112–116. ISBN 0-471-93970-6.
- N.N. Greenwood, A. Earnshaw (1997). Chemistry of the Elements. 2. izdaja. Oxford UK: Butterworth-Heinemann. A great description of properties & chemistry of H2O2.
- J. March (1992). Advanced Organic Chemistry. 4. izdaja. New York: Wiley. str. 723.
- W.T. Hess (1995). Hydrogen Peroxide. Kirk-Othmer Encyclopedia of Chemical Technology 13 (4. izdaja). New York: Wiley. str. 961–995.






