Aromatičnost
Aromatičnost je kemijska lastnost nekaterih organskih cikličnih spojin, ki daje konjugiranim obročem z nenasičenimi vezmi, neveznimi elektronskimi pari ali praznimi orbitalami večjo stabilnost, kot bi jo pričakovali od same konjugacije. Večja stabilnost je posledica ciklične delokalizacije elektronov in njihove resonance.[1][2][3]
Delokalizacija elektronov pomeni, da elektroni prosto krožijo okrog krožno razporejenih atomov, med katerimi se izmenjujejo enojne in dvojne vezi. Kemijske vezi so torej nekakšni hibridi enojnih in dvojnih vezi, tako da so vse vezi v obroču identične. Takšen ustaljen model aromatskih obročev je razvil nemški kemik Friedrich August Kekulé na podlagi šestčlenskega ogljikovega obroča benzena, v katerem si izmenično sledijo enojne in dvojne vez (cikloheksatrien). Model benzena je sestavljen iz dveh resonančnih struktur, ki se stalno preklapljata.
Teorija[uredi | uredi kodo]

Resonančne strukture se zapisujejo podobno kot povratne kemijske reakcije – z dvema puščicama. Takšen zapis seveda ne pomeni dveh različnih spojin, pač pa dve možni hipotetični strukturi. Takšen zapis ne predstavlja niti natančne aktualne spojine, ki je nekakšen hibrid oziroma povprečje teh struktur.
Dokaz za takšno hibridno strukturo je benzen. V ogljikovodikih meri enojna vez C−C 154 pm. Dvojna vez C=C je nekoliko krajša in meri 134 pm. Ker je benzen idealen šesterokotnik, pomeni, da so vse vezi med ogljikovimi atomi enako dolge, njihova dolžina pa mora biti nekje med dolžino enojne in dvojne vezi. Meritve so pokazale da je vez dolga 139 pm.
Boljši od zapisa s puščicami je zapis z včrtanim krogom, ki predstavlja enakomerno porazdelitev gostote elektronov π-vezi nad obročem in pod njim oziroma po celem aromatskem obroču.
Enojne ali σ-vezi med ogljikovimi atomi nastanejo s čelnim prekrivanjem ogljikovih sp2 hibridiziranih orbital. Dvojne vezi so sestavljene iz ene σ-vezi in ene π-vezi, ki nastane s stranskim prekrivanjem ogljikovih pz orbital. Ker so v benzenu pzorbitale izven ravnine ogljikovih atomov, lahko elektroni med seboj vzajemno delujejo in se delokalizirajo. To pomeni, da elektroni niso strogo vezani na »svoj« ogljikov atom, ampak postanejo last vseh šestih ogljikovih atomov v benzenovem obroču. Rezultirajoča molekularna orbitala ima simetrijo π.
Zgodovina[uredi | uredi kodo]
Izraz aromatski za spojine, ki vsebujejo fenilni radikal, je prvi uporabil August Wilhelm Hofmann leta 1855.[4] Če je bila to res prva uporaba tega izraza, bi bilo zanimivo vedeti, zakaj je Hofmann izbral ravno ta izraz, saj imajo samo nekatere aromatske spojine resnično zaznaven vonj, po drugi strani pa spada mnogo najbolj dišečih spojin med terpene, ki v kemijskem smislu niso aromati. Terpeni in aromati imajo kljub temu neko skupno lastnost: oboji so mnogo bolj nenasičeni kot alifatske spojine, zato Hofmann med njimi očitno ni delal nobenih razlik.
Zgradbo 1,3,5-cikloheksatriena je benzenu prvi pripisal Friedrich August Kekulé leta 1865. V naslednjih nekaj desetletjih je večina kemikov prelagano strukturo sprejela, ker je ustrezala večini takrat znanih izomerij v kemiji aromatov. Edino odprto vprašanje, na katero niso znali odgovoriti, je bila benzenova izredna nereaktivnost v adicijskih reakcijah. Odkritelj elektrona Joseph John Thomson, na primer, je v letih 1897–1906 med ogljikove atome v benzenu postavljal tri ekvivalentne elektrone.
Razlago izjemne stabilnosti benzena se običajno pripisuje angleškemu kemiku in Nobelovemu nagrajencu Robertu Robinsonu, ki je leta 1925[5] skoval izraz aromatski sekstet za skupino šestih elektronov, ki se upirajo ločitvi.
Pojem je v resnici starejši. Predstavila sta ga ga je že Ernest Crocker leta 1922[6] in Henry Edward Armstrong, ki je leta 1890 v članku z naslovom Zgradba cikličnih ogljikovodikov (angleško: The structure of cycloid hydrocarbons) zapisal, da znotraj obroča deluje (šest) centričnih afinitet, da bi se benzen lahko prikazal z dvojnim obročem in da se pri tvorbi adicijskih spojin notranji obroč afinitet prekine, sosednji ogljikovi atomi, na katere se ni vezala nobena skupina, pa preidejo v etilensko stanje.[7]
Armstrong je v svojem članku opisal najmanj štiri sodobne pojme. Prvi pojem, afiniteta, danes imenujemo elektron, ki ga je sedem let kasneje odkril Joseph John Thomson. V nadaljevanju opisuje elektrofilno aromatsko substitucijo (drugi pojem), ki poteka preko Whelandovega intermediata (tretji pojem), tako da se prekine konjugacija aromatskega obroča (četrti pojem). Uvedel je simbol C v sredini obroča, ki predstavlja notranji obroč (iz angleškega inner cycle), ki je predhodnik današnjega včrtanega kroga. Verjetno je predvidel tudi lastnosti valovne mehanike, ker je spoznal, da imajo afinitete smer in niso zgolj točkasti delci, kot celota pa imajo porazdelitev, ki se lahko spremeni z uvedbo substituent na benzenov obroč.
Kvantno mehansko poreklo stabilnosti ali aromatičnosti je prvi modeliral Erich Hückel leta 1931. Hückel je bil tudi prvi, ki je vezne elektrone razdelil na σ-elektrone in π-elektrone.
Lastnosti aromatskih (arilnih) spojin[uredi | uredi kodo]
Aromatske spojine vsebujejo niz kovalentnih vezi s specifičnimi lastnostmi. Spojine imajo:
- delokaliziran konjugiran π-sistem, v katerem se najpogosteje izmenjujejo enojne in dvojne vezi,
- koplanarno zgradbo z vsemi atomi v isti ravnini,
- sodelujoči atomi so razporejeni v enem ali več obročih,
- število delokaliziranih π-elektronov je parno, vendar ni deljivo s 4. Število π-elektronov je torej enako 4n + 2, pri čemer je n = 0, 1, 2, 3 itd. Zakonitost je znana kot Hücklovo pravilo.
Primer: benzen je aromat, ker ima 6 delokaliziranih π-elektronov iz treh dvojnih vezi, ciklobutadien pa to ni, ker ima samo 4 π-elektrone, kar je seveda deljivo s 4. Ciklobutadienov 2- ion je aromat, ker ima 6 π-elektronov.
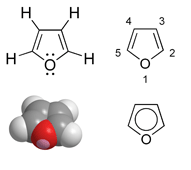
Atom v aromatskem sistemu ima lahko še druge elektrone, ki niso del aromatskega sistema in zato ne spadajo v pravilo 4n+2. Takšen primer je kisikov atom v furanu, ki je sp2 hibridiziran. En nevezni elektronski par sodeluje v π-sistemu, drug par pa je v ravnini obroča, enako kot atomi vodika v skupinah C−H na drugih položajih v obroču. Število π-elektronov je enako 6, zato je furan aromatska spojina.
Za aromatske molekule je značilna velika kemijska stabilnost v primerjavi s podobnimi nearomatskimi molekulami, zato molekule, ki bi lahko bile aromatske, težijo k temu, da bi spremenile svojo elektronsko ali konformacijsko strukturo in to postale. Dodatna stabilnost spremeni kemijo molekule: aromatske spojine so podvržene elektrofilnim aromatskim substitucijam in nukleofilnim aromatskim substitucijam, elektrofilnim adicijam, ki so značilne za dvojno vez C=C, pa ne.
Mnoge zgodaj znane aromatske spojine, na primer benzen in toluen, imajo značilen prijeten vonj. Ta njihova lastnost je pripeljala do imena aromati, ki velja za celo skupino spojin, po odkritju elektronov pa do izraza aromatičnost, ki velja za njihove elektronske lastnosti.

Krožeči π-elektroni v aromatski molekuli povzročajo obročne tokove, ki se upirajo vsiljenemu magnetnemu polju v NMR. NMR signali protonov na ravnini aromatskega obroča so pomaknjeni po polju mnogo bolj navzdol kot signali protonov nearomatskih sp2 ogljikov. Ta pojav je pomemben za odkrivanje aromatičnosti. Enak mehanizem povzroči, da so signali protonov, ki so bliže središča obroča, pomaknjeni po polju navzgor.
Aromatske molekule so sposobne med seboj delovati v tako imenovanem π-π skladanju (angleško: π-π stacking): π-sistemi tvorijo dva vzporedna obroča, ki sta orientirana v smeri ravnina-ravnina. Aromatske spojine medsebojno delujejo tudi v smeri ravnina-rob, ker se rahlo pozitivni naboj substituent na atomih v obroču in rahlo negativni naboj aromatskega sistema sosednje molekule rahlo privlačita.

Planarne monociklične molekule, ki vsebujejo 4n π-elektronov se imenujejo antiaromatske in so, na splošno, destabilizirane. Molekule, ki bi morale biti antiaromatske, se zato želijo temu izogniti in težijo k spremembi svoje elektronske ali konformacijske zgradbe, tako da postanejo nearomatske. Primer takšne molekule je cikooktatetraen, ki se odmakne od ravnine in pretrga prekrivanje π-elektronov med sosednjima dvojnima vezema.
Pomembnost aromatskih spojin[uredi | uredi kodo]
Aromatske spojine so industrijsko pomembne spojine, med katerimi so najbolj zanimive benzen, toluen ter orto- in para-ksilen. Njihova svetovna letna proizvodnje presega 35 milijonov ton. Pridobivajo se z rafiniranjem nafte in z destilacijo premogovega katrana in so osnova za proizvodnjo pomembnih kemikalij in polimerov, na primer stirena, fenola, anilina, poliestrov in poliamidov. Fenol je največ v rabi za uporabo duroplastov. Glavna uporaba fenilamina je proizvodnja antioksidantov v industiriji kavčuka. Pomemben pa je tudi kot izhodna surovina za proizvodnjo barvil, zdravil in fotografskih kemikalij.
Aromatske spojine igrajo ključno vlogo tudi v biokemiji vseh živih organizmov. Aromatske aminokisline fenilalanin, triptofan in tirozin so tri od dvajsetih osnovnih gradbenih elementov beljakovin. Aromatske spojine so tudi vsi nukleotidi (adenin, timin, citozin, guanin in uracil), ki tvorijo sekvence genske kode v DNA in RNA in spadajo med purine oziroma pirimidine. In ne nazadnje je aromatska tudi molekula hema, ki vsebuje sistem z 22 π-elektroni. Podoben aromatski sistem ima klorofil.
Vrste aromatskih spojin[uredi | uredi kodo]
Velika večina aromatskih spojin so spojine ogljika, ki pa niso nujno tudi ogljikovodiki.
Heterociklične spojine[uredi | uredi kodo]

Heterociklični aromati (heteroaromati) imajo v aromatskem obroču vsaj en atom elementa, ki ni ogljik. Heteroatom običajno zmanjša aromatičnost obroča in s tem poveča njegovo reaktivnost. Heterociklični aromati so furan, piridin, imidazol, pirazol, oksazol, tiofen in njihovi benzanulizani analogi, na primer benzimidazol.
Policiklične spojine[uredi | uredi kodo]
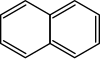
Policiklični aromatski ogljikovodiki so spojine, ki vsebujejo dva ali več enostavnih aromatskih obročev, ki si delijo dva sosednja ogljikova atoma. Takšne spojine so naftalen, antracen, fenantren in drugi.
Substituirani aromati[uredi | uredi kodo]
Mnoge kemijske spojine imajo na aromatski obroč vezane razne atomske skupine. Mednje spadajo trinitrotoluen (TNT), acetilsalicilna kislina (aspirin), paracetamol in nukleotidi DNA.
Atipične aromatske spojine[uredi | uredi kodo]


Aromatičnost ni značilna samo za spojine, ampak tudi za ione: kation ciklofenil ima sistem 2e, anion ciklopentadienil sistem 6e, tropilijev ion 6e in ciklooktatetraenski dianion 10e. Aromatske lastnosti se pripisujejo tudi ne-benzoidnim spojinam, na primer troponu (2,4,6-cikloheptatrien-1-on). Aromatske lastnosti se preskušajo tudi v razredu spojin, imenovanih ciklofani.
Poseben primer aromatičnosti je homoaromatičnost, v kateri je konjugacija prekinjena z enim sp3 hibridiziranim ogljikovim atomom. Če je eden od ogljikovih atomov v benzenu zamenjan z nekimi drugim elementom (borabenzen, silabenzen, germanobenzen, stanobenzen, fosforin in pirilijeve soli), se aromatičnost ohrani.
Aromatičnost se pojavlja tudi v spojinah, ki niso zgrajene iz ogljika. Poznane so anorganske spojine s šestčlenskim obročem, analognim benzenovemu obroču. Strukturno analogna benzenu sta silikazin (Si6H6) in borazin (B3N3H6), v katerih je ogljik zamenjan s silicijem oziroma borom in dušikom. V borazinu sta bor in dušik vgrajena izmenično.
Kovinska aromatičnost verjetno obstoja tudi v nekaterih kovinskih klastrih aluminija. Poseben primer aromatičnosti je Möbiusova aromatičnost.
Fizikalne lastnosti[uredi | uredi kodo]
Večina aromatskih spojin, ki imajo na benzenov obroč vezano eno samo majhno funkcionalno skupino, so pri sobni temperaturi tekočine. Izjemi sta fenol, C6H5OH, ki ima temperaturo tališča pri 43 °C, ter benzojska kislina, C6H5COOH s temperaturo tališča pri 122 °C. Pri obeh so molekule namreč vezane z vodikovimi vezmi. Večina aromatskih spojin je topna v organskih topilih predvsem zaradi medsebojnih disperzijskih sil. Vse aromatske spojine absorbirajo ultravijolično svetlobo, kar lahko vzbudi elektron v delokaliziranem π-sistemu na višji nivo. Kadar je na benzenov obroč vezanih več kromoforov, je energija vzbujanja nižja in jo lahko prispevajo že fotoni vidne svetlobe. Zato so take spojine barvane. Enostavne aromatske spojine so brezbarvne, vendar zlahka oksidirajo v obarvane produkte. Prisotnost teh produktov v obliki primesi povzroča obarvanje laboratorijskih kemikalij. Na tak način lahko zlahka ločimo fenol (pogosto rožnat) od fenilamina (pogosto temnorjav).
Sklici[uredi | uredi kodo]
- ↑ P. v. R. Schleyer, »Aromaticity (Editorial)«, Chemical Reviews, 2001, 101, 1115-1118. DOI: 10.1021/cr0103221 Abstract.
- ↑ A. T. Balaban, P. v. R. Schleyer and H. S. Rzepa, »Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons«, Chemical Reviews, 2005, 105, 3436-3447. DOI: 10.1021/cr0103221 Abstract.
- ↑ P. v. R. Schleyer, »Introduction: Delocalization-π and σ (Editorial)«, Chemical Reviews, 2005, 105, 3433-3435. DOI: 10.1021/cr030095y Abstract.
- ↑ A. W. Hofmann, »On Insolinic Acid,« Proceedings of the Royal Society, 8 (1855), 1-3.
- ↑ «CCXI.—Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases« James Wilson Armit and Robert Robinson Journal of the Chemical Society, Transactions, 1925, 127, 1604–1618 Abstract.
- ↑ E.C. Crocker, Application of the octet theory to single-ring aromatic compounds, J. Am. Chem. Soc.; 1922; 44(8) str. 1618–1630; Abstract
- ↑ The structure of cycloid hydrocarbons Henry Edward Armstrong Proceedings of the Chemical Society (London), 1890, 6, 95 - 106 Abstract
