Železo
 | |||||||||||||||||||||||||||||||||||||||||
| Železo | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [ʒɛˈlɛːzɔ] | ||||||||||||||||||||||||||||||||||||||||
| Alotropi | glej Alotropi železa | ||||||||||||||||||||||||||||||||||||||||
| Videz | svetleča kovina s sivim nadihom | ||||||||||||||||||||||||||||||||||||||||
| Standardna atomska teža Ar, std(Fe) | 55,845(2)[1] | ||||||||||||||||||||||||||||||||||||||||
| Železo v periodnem sistemu | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Vrstno število (Z) | 26 | ||||||||||||||||||||||||||||||||||||||||
| Skupina | skupina 8 | ||||||||||||||||||||||||||||||||||||||||
| Perioda | perioda 4 | ||||||||||||||||||||||||||||||||||||||||
| Blok | blok d | ||||||||||||||||||||||||||||||||||||||||
| Razporeditev elektronov | [Ar] 3d6 4s2 | ||||||||||||||||||||||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||
| Fizikalne lastnosti | |||||||||||||||||||||||||||||||||||||||||
| Faza snovi pri STP | trdnina | ||||||||||||||||||||||||||||||||||||||||
| Tališče | 1538 °C | ||||||||||||||||||||||||||||||||||||||||
| Vrelišče | 2862 °C | ||||||||||||||||||||||||||||||||||||||||
| Gostota (blizu s.t.) | 7,874 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| v tekočem stanju (pri TT) | 6,98 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Talilna toplota | 13,81 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Izparilna toplota | 340 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Toplotna kapaciteta | 25,10 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Parni tlak
| |||||||||||||||||||||||||||||||||||||||||
| Lastnosti atoma | |||||||||||||||||||||||||||||||||||||||||
| Oksidacijska stanja | −4, −2, −1, 0, +1,[2] +2, +3, +4, +5,[3] +6, +7[4] (amfoterni oksid) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 1,83 | ||||||||||||||||||||||||||||||||||||||||
| Ionizacijske energije |
| ||||||||||||||||||||||||||||||||||||||||
| Atomski polmer | empirično: 126 pm | ||||||||||||||||||||||||||||||||||||||||
| Kovalentni polmer | spodnji spin: 132±3 pm gornji spin: 152±6 pm | ||||||||||||||||||||||||||||||||||||||||
| Druge lastnosti | |||||||||||||||||||||||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | ||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | telesno centrirana kubična (tck) a=286,65 pm | ||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | ploskovno centrirana kocka (pck) med 1185–1667 K; a=364,680 pm | ||||||||||||||||||||||||||||||||||||||||
| Hitrost zvoka tanka palica | 5120 m/s (pri r.t.) (elektrolitski) | ||||||||||||||||||||||||||||||||||||||||
| Temperaturni raztezek | 11,8 µm/(m⋅K) (pri 25 °C) | ||||||||||||||||||||||||||||||||||||||||
| Toplotna prevodnost | 80,4 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Električna upornost | 96,1 nΩ⋅m (pri 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Curiejeva točka | 1043 K | ||||||||||||||||||||||||||||||||||||||||
| Magnetna ureditev | feromagneten | ||||||||||||||||||||||||||||||||||||||||
| Youngov modul | 211 GPa | ||||||||||||||||||||||||||||||||||||||||
| Strižni modul | 82 GPa | ||||||||||||||||||||||||||||||||||||||||
| Stisljivostni modul | 170 GPa | ||||||||||||||||||||||||||||||||||||||||
| Poissonovo razmerje | 0,29 | ||||||||||||||||||||||||||||||||||||||||
| Mohsova trdota | 4 | ||||||||||||||||||||||||||||||||||||||||
| Trdota po Vickersu | 608 MPa | ||||||||||||||||||||||||||||||||||||||||
| Trdota po Brinellu | 200–1180 MPa | ||||||||||||||||||||||||||||||||||||||||
| Številka CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||
| Zgodovina | |||||||||||||||||||||||||||||||||||||||||
| Odkritje | pred 5. tisočletjem pr. n. št. | ||||||||||||||||||||||||||||||||||||||||
| Simbol | "Fe": iz lat. ferrum | ||||||||||||||||||||||||||||||||||||||||
| Najpomembnejši izotopi železa | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Železo je kemični element s simbolom Fe (iz latinskega ferrum) in vrstnim številom 26. Je kovina iz prvega niza prehodnih elementov.[5]
Po masi je najpogostejši element na Zemlji, saj tvori večino Zemljinega zunanjega in notranjega jedra. V Zemljini skorji je četrti najpogostejši element. Njegovo obilje v kamnitih planetih, kakršna je Zemlja, je posledica njegovega obilnega nastajanja v jedrskem zlivanju v zelo masivnih zvezdah (zvezdna nukleosinteza), v katerem v zadnji eksotermni jedrski reakciji 56Ni, razpade na najpogostejša železova izotopa 56Fe (~ 92 %) in 54Fe (~ 6 %). Z eksplozijo supernove se nikelj in železo razpršita po vesolju in sta zato najpogostejši kovini v kovinskih meteoritih in skorjah planetov, kakršna je Zemlja.
Železo spada skupaj z rutenijem in osmijem v 8. stransko skupino periodnega sistema elemetov in ima zato mogoča oksidacijska stanja od -2 do +6. Najpogostejši stanji sta +2 in +3. Kot element se pojavlja v meteoroidih in okoljih z nizko vsebnostjo kisika. V stiku z vodo in kisikom železo oksidira. Sveža površina železa je bleščeče srebrno siva, vendar se na vlažnem zraku hitro prevleče s hidriranimi železovimi oksidi, bolj znanimi kot rja. V nasprotju z nekaterimi kovinami, ki se na zraku pasivirajo in s tem prekinejo proces oksidacije, imajo železovo oksidi večji volumen od kovine in se odluščijo, s čimer izpostavijo koroziji novo svežo površino.
Pridobivanje železa (železna doba) se je začelo okoli leta 3000 pr. n. št., na ozemlju Slovenije okoli leta 1000 pr. n. št. Pred železom se je uporabljal baker in njegovi zlitini medenina in bron, ki imajo nižja tališča. Čisto železo je relativno mehko. Njegovo trdoto in trdnost močno povečajo nečistoče, zlasti ogljik, s katerim se onesnaži v plavžu. Železa z 0,002-2,1 % ogljika so ogljikova jekla, ki so do 1000 krat trša od čistega železa.
Surovo železo se proizvaja v plavžih, v katerih se železova ruda reducira s koksom do elementarnega železa. Nadaljnja obdelava surovega železa s kisikom zniža vsebnost ogljika na raven, primerno za jekla. Jekla in železove zlitine z nizko vsebnostjo ogljika so poleg zlitin z drugimi kovinami (jeklene zlitine) zaradi svoje široke palete koristnih lastnosti in obilja železovih rud daleč najpogostejše industrijske kovine.
Zelo uporabne so tudi železove spojine. Zmes železovega(III) oksida (Fe2O3) in uprašenega aluminija je termit, ki se uporablja za varjenje in rafiniranje rud. Železo tvori s halogeni in halkogeni binarne spojine. Med njegovimi najbolj znanimi organokovinskimi spojinami je ferocen (bis(η5-ciklopentadienil)železo, C10H10Fe), ki je bil prva odkrita sendvičasta spojina.
Železo igra pomembno vlogo tudi v biologiji, ker v hemoglobinu in mioglobinu tvori komplekse z molekularnim kisikom. Obe spojini sta proteina, ki v vretenčarjih prenašata kisik za celično dihanje. Železo je vezano tudi na aktivnih mestih v mnogo pomembnih redukcijsko-ksidacijskih encimih in sodeluje v redukcijsko-oksidacijskih procesih v rastlinah in živalih.
Značilnosti[uredi | uredi kodo]
Mehanske lastnosti[uredi | uredi kodo]
| Železo/jeklo | NT (MPa) |
TB (Brinell) |
|---|---|---|
| Monokristalna vlakna | 11000 | |
| Cementirano jeklo | 2930 | 850–1200 |
| Martenzitno jeklo | 2070 | 600 |
| Bajnitno jeklo | 1380 | 400 |
| Perlitno jeklo | 1200 | 350 |
| Hladno obdelano železo | 690 | 200 |
| Drobnozrnato železo | 340 | 100 |
| Železo z ogljikom | 140 | 40 |
| Čisto monokristalno železo | 10 | 3 |
Mehanske lastnosti železa in njegovih zlitin se vrednotijo na različne načine. Trdoto, na primer, se lahko določa z Brinellovo, Rockwellovo ali Vickersovo metodo. Podatki za železo so tako skladni, da se pogosto uporabljajo za umerjanje instrumentov ali za primerjavo preskusov.[7] Mehanske lastnosti železa so zelo odvisne od nečistoč. Monokristali zelo čistega železa, ki se uporablja v znanstvenih raziskavah, so mehkejši od aluminija.[6] Najčistejše industrijsko proizvedeno železo s čistočo 99,99 % ima Brinellovo trdoto 20-30.[8] Z naraščanjem vsebnosti ogljika sprva zelo narasteta tako trdota kot natezna trdnost. Maksimalno trdoto 65 Rc ima železo z 0,6 % ogljika, ki ima po drugi strani zelo majhno natezno trdnost.[9]

Zaradi pomembnosti železa v jedrih planetov so se obširno raziskovale tudi njegove lastnosti pri visokih tlakih in temperaturah. S preskusi so ugotovili, da se nizkotlačna oblika železa, stabilna pri standardnih pogojih, šele pri tlaku približno 16 GPa pretvori v visokotlačno obliko.
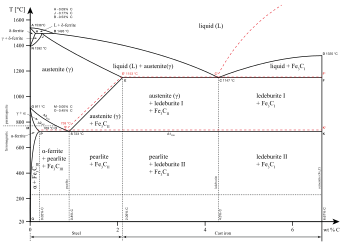
Fazni diagram in alotropi[uredi | uredi kodo]
Železo je zgleden primer alotropije kovin. Ima najmanj štiri alotropne oblike, znane kot α, γ, δ, in ε-železo. Nekaj, sicer spornih poskusov kaže, da je pri zelo visokih tlakih in temperaturah stabilno tudi β-železo.[10]

Ohlajajoče se raztaljeno železo začne kristalizirati pri 1538 °C kot δ-alotrop, ki ima kristalno strukturo telesno centrirane kocke. Z nadaljnjim ohlajanjem se pri 1394 °C pretvori v γ-alotrop (avstenit), ki ima kristalno strukturo ploskovno centrirane kocke. Pri temperaturi 912 °C se struktura ponovno pretvori v telesno centrirano kocko ali α-železo (ferit). Pri 770 °C (Curiejeva temperatura, Tc) se železo še zadnjikrat pretvori in postane magnetno. Pri prehodu skozi Curiejevo temperaturo se kristalna struktura ne spremeni, pač pa se spremeni »domena strukture«, v kateri vsebuje vsaka domena železo s posebnim elektronskim spinom. V nemagnetiziranem železu so vsi elektronski spini atomov znotraj ene domene obrnjeni v eno smer, v drugi domeni pa v drugo smer, tako da se njihov učinek izniči. Rezultat je nemagnetno železo. V magnetiziranem železu so vsi elektronski spini usklajeni, tako da se magnetni učinki sosednjih domen medsebojno krepijo. Četudi vsebuje vsaka domena več milijard atomov, je zelo majhna in ima premer samo približno 10 mikrometrov.[11] Pri tlakih nad približno 10 GPa in temperaturah nekaj sto K ali manj, se struktura α-železa pretvori v heksagonalni gosti sklad, znan tudi kot ε-železo. Pri višjih temperaturah se v ε-železo pretvori tudi γ-železo, vendar je zato potrebna višja temperatura. β-faza, če sploh obstaja, bi se lahko pojavila šele pri tlaku najmanj 50 GPa in temperaturi najmanj 1500 K. Zanjo se domneva, da bi lahko imela ortorombsko strukturo ali strukturo z dvojnim gostim skladom.[10]
Bolj kot železo so pomembne njegove zlitine z nekaterimi kovinami in ogljikom. Obstaja veliko vrst jekla z zelo različnimi lastnostmi, za njihovo razumevanje in proizvodnjo pa je ključno poznavanje alotropov železa.
α-železo ali ferit je pri normalnih temperaturah najbolj stabilna oblika železa. Je precej mehka kovina, v kateri se lahko raztopi samo majhna količina ogljika, pri 910 °C ne več kot 0,021 masnih %.[12]
Pri temperaturah med 912 in 1400 °C se struktura α-železa pretvori iz telesno centrirane v ploskovno centrirano kocko - γ-železo ali avstenit. Ta oblika železa je približno enako mehka, vendar se v njej lahko raztopi več ogljika, pri 1146 °C kar 2,04 masnih %. Avstenit je uporaben za proizvodnjo nekaterih vrst nerjavnih jekel, primernih za izdelavo nožev ter bolnišnične in kuhinjske opreme.[11]
Visokotlačne faze železa so pomembne kot končni člen modelov za trdne dele jeder planetov. Za notranje jedro Zemlje se na splošno domneva, da je sestavljeno večinoma iz zlitine železa in niklja s strukturo ε (ali morda β).
Tališče železa je eksperimentalno dobro določeno za tlake do približno 50 GPa. Za višje tlake so različne študije določile trojno točko γ-ε-tekočina pri tlakih, ki se razlikujejo za več deset GPa in so prinesli razlike v tališčih, večje od 1000 K. Na splošno gledano kažeta računalniška simulacija molekularne dinamike taljenje železa in poskusi z udarnimi valovi višja tališča in veliko bolj strme naklone talilnih krivulj kot statični poskusi, izvedeni v celicah z diamantnim nakovalom.[13]
Izotopi[uredi | uredi kodo]
Naravno železo sestavljajo štirje stabilnih izotopi: 54Fe (5,845 %), 56Fe (91,754 %), 57Fe (2,119 %) in 58Fe (0,282 %), od katerih ima samo 57Fe spin (−1⁄2). Za nuklid 54Fe se domneva, da je podvržen dvojnemu beta razpadu, vendar tega pojava nikoli niso opazili. Določili so samo spodnjo mejo razpolovnega časa, ki znaša t1/2 > 3,1×1022 let.
60Fe je ugasel radionuklid z dolgim razpolovnim časom (2,6 milijona let).[14] Na Zemlji ga niso odkrili. Njegov končni razpadni produkt je stabilen nuklid 60Ni.
Večina preteklega dela pri merjenju izotopske sestava železa se je osredotočala na določanje zazličkov 60Fe, nastalih v procesih, ki spremljajo nukleosintezeo, se pravi na študije meteoritov, in procese nastajanja rud. V zadnjem desetletju je napredek v masni spektrografiji omogočil detekcijo in kvantifikacijo minutnih naravnih sprememb v razmerjih stabilnih železovih izotopov. Gonilna sila teh raziskav so še vedno znanstvene skupnosti, ki preučujejo Zemljo in planete, čeprav so se v zadnjem času začele pojavljati tudi aplikacije za biološke in industrijske sisteme.[15]
Za jedrske znanstvenike je še zlasti zanimiv najpogostejši železov izotop 56Fe, ki je hkrati najpogostejši zadnji člen nuleosinteze. Pogosto se napačno navaja, da je izotop z najvišjo vezno energijo, čeprav je to v resnici 62Ni.[16] Ker se 56Ni brez težav proizvaja iz lažjih jeder v alfa procesih jedrskih reakcij v supernovah, je prav on (14 alfa delcev, se pravi helijevih jeder) končni člen fuzijskih verig znotraj izjemno masivnih zvezd, saj bi dodajanje še enega helijevega jedra, ki bi dalo 60Zn, zahtevalo veliko več energije. 56Ni, katerega razpolovni čas je približno šest dni, se v teh zvezdah sicer masovno proizvaja, vendar hitro razpada, najprej do radioaktivnega 60Co in nato do stabilnega 56Fe. Slednji nuklid je zato v vesolju zelo pogost v primerjavi z drugimi kovinskimi elementi s približno enako atomsko maso.
V fazah na meteoritih Semarkona in Chervony Kut je korelacija med koncentracijo 60Ni, hčerinskega produkta 60Fe, in vsebnostjo stabilnih železovih izotopov, kar dokazuje obstoj 60Fe v času nastanka našega Osončja. Energija, ki se je sprostila z razpadom 60Fe, je skupaj z energijo, ki se je sprostila z razpadom radionukleida 26Al, morda povzročila pretalitev in diferenciacijo asteroidov po njihovem nastanku pred približno 4,6 milijarde let. Še globlji vpogled v rojstvo in našega Osončja bi lahko omogočila pogostost 60Ni v izvenzvezdnem gradivu.[17]
Jedra železovih atomov imajo eno od najvišjih veznih energij na nukleon, katero presega samo nikljev izotop 62Ni, ki nastaja z jedrskim zlivanjem v zvezdah. Zelo majhen delček energije bi se sicer še lahko pridobil s sintezo 62Ni, vendar razmere za to sintezo na zvezdah niso primerne. V porazdelitvi elementov na Zemlji železo močno presega nikelj, kar predvidoma velja tudi za tvorjenje elementov v supernovah.[18]
56Fe je najtežji stabilni izotop, ki nastaja z alfa procesi v zvezdni nukleosintezi. Elementi, težji od železa in niklja, zahtevajo za svoj nastanek supernovo. Železo je najpogostejši element v jedrih rdečih velikanov in najpogostejša kovina v železnih meteoritih in v gostih jedrih planetov, kakršna je Zemlja.
Nukleosinteza[uredi | uredi kodo]
Železo proizvajajo ekstremno velike in ekstremno vroče zvezde (več kor 2,5 milijona K) v procesih zgorevanja silicija. Železo je najtežji stabilni element, ki lahko nastane na ta način. Proces se začne z drugim največjim stabilnim jedrom, ki nastaja z zgorevanjem silicija, se pravi s kalcijem. Ko se stabilno kalcijevo jedro zlije s helijevim jedrom, nastane nestabilen titan. Preden titan razpade, se lahko zlije z drugim helijevim jedrom, tako da nastane nestabilen krom. Krom se lahko pred razpadom zlije z naslednjim helijevim jedrom, tako da nastane nestabilno železo. Železo se lahko pred razpadom zlije s še enim helijevim jedrom, pri čemer nastane nestabilen 56Ni. Vsako nadaljnje zlivanje ne sprošča energije, ampak jo porablja, zato po pretvorbi vse snovi v 56Ni zvezda ne proizvaja več energije, ki bi preprečila zrušenje jedra. 56Ni nazadnje razpade v nestabilen 56Co, ki se pretvori v stabilno 56Fe. Ko se jedro zvezde zruši, nastane supernova, v kateri nastaja dodatno stabilno železo v procesu r.
Nahajališča[uredi | uredi kodo]
Nahajališča na planetih[uredi | uredi kodo]

Železo je četrti najpogostejši element v vesolju in najpogostejši element, ki je odporen na visoke temperature.[19] Nastal je v zadnji eksotermni stopnji zvezdne nukleosinteze z zlivanjem jeder silicija v masivnih zvezdah.
Kovinsko ali samorodno železo je na Zemljini površini redko, ker na zraku hitro oksidira. Zaloge njegovih oksidov so izredno velike in spadajo med primarne železove rude. V Zemljini skorji ga je približno 5 %, kar ga postavlja na četrto mesto najpogostejših elementov,[20][21] za notranje in zunanje Zemljino jedro pa se domneva, da je sestavljeno večinoma iz železo-nikljeve zlitine, ki predstavlja 35 % celotne Zemljine mase.
Največ železa je v njegovih oksidnih mineralih, kot sta hematit (Fe2O3) in magnetit (Fe3O4). Velika nahajališča železovih rud so običajno slojasta. V njih se tanki sloji železovih oksidov izmenjujejo s sloji z železom revnih skrilavcev in kremena. Slojaste tvorbe so nastale pred 3,7-1,8 milijarde let.[22][23]
Eden od dvajset meteoritov je zgrajen iz edinstvenih železo-nikljevih mineralov taenita s 35-80 % železa in kamacita z 90-95 % železa. Železovi meteoriti so glavni vir samorodnega železa na Zemljini površini.[24]
Rdeča barva površine planeta Marsa je posledica z železom bogatega minerala regolita, kar so potrdili z Mössbauerjevo spektroskopijo.[25]
Železo v uporabi[uredi | uredi kodo]
Po podatkih, ki jih je objavil International Resource Panel, znašajo svetovne zaloge železa v uporabi 2200 kg na prebivalca. Večina tega železa je v bolj razvitih državah, kjer znaša 7000–14000 kg na prebivalca. Zaloge v manj razvitem svetu znašajo približno 2000 kg na prebivalca.
Kemija in spojine[uredi | uredi kodo]
| Oksidacijsko stanje |
Značilna spojina |
|---|---|
| −2 | dinatrijev tetrakarbonilferat (Collmanov reagent) |
| −1 | |
| 0 | železov pentakarbonil |
| 1 | ciklopentadienil železo dikarbonil dimer |
| 2 | železov(II) sulfat, ferocen |
| 3 | železov triklorid, ferocenijev tetrafluoroborat |
| 4 | barijev ferat(IV) |
| 5 | |
| 6 | kalijev ferat |
Železo je v večini spojin v oksidacijskih stanjih +2 in +3. Železove(II) spojine so znane tudi kot fero, železove(III) spojine pa kot feri spojine. Železo se pojavlja tudi v višjih oksidacijskih stanjih, na primer +6 v purpurnem kalijevem feratu (K2FeO4). V oksidacijskem stanju +4 je pogost vmesni produkt v številnih biokemijskih oksidacijskih reakcijah.[26][27] V številnih organokovinskih spojinah ima tudi formalna oksidacijska stanja +1, 0, -1 ali celo -2. Oksidacijska stanja in druge značilnosti vezi se pogosto preučujejo z Mössbauerjevo spektroskopijo.[28] Obstaja tudi veliko spojin, v katerih ima železo mešano valenco. Barvilo prusko modro (Fe4(Fe[CN]6)3), na primer, vsebuje centre Fe2+ in Fe3+.[27] Barvilo se je uporabljalo za tradicionalno modro fotografsko kopiranje tehničnih načrtov.[29]
Najmasovnejši industrijsko proizvedeni železovi spojini sta železov(II) sulfat (FeSO4•7H2O) in železov(III) klorid) (FeCl3). Prvi je najpogostejši vir ionov Fe2+, vendar je manj stabilen proti oksidaciji na zraku kot Mohrova sol ((NH4)2Fe(SO4)2•6H2O). Železove(II) spojine so na zraku nagnjene k oksidaciji v železove (III) spojine.
Železo v nasprotju z večino drugih kovin ne tvori amalgamov z živim srebrom. To značilnost se izkorišča za skladiščenje živega srebra v standardnih 34 kg železnih steklenicah.[30]
Binarne spojine[uredi | uredi kodo]

Železo reagira s kisikom iz zraka in tvori različne okside. Najpogostejša sta železov(II,III) oksid (Fe3O4) in železov(III) oksid (Fe2O3). Obstaja tudi železov(II) oksid, ki je pri sobni temperaturi nestabilen. Oksidi so glavne železove rude za proizvodnjo železa v talilnih pečeh in plavžih. Uporabljajo se tudi za proizvodnjo feritov, medijev za magnetno shranjevanje podatkov v računalnikih, in pigmentov. Železo tvori dva sulfida: železov(II) sulfid (FeS) in železov(IV) sulfid (FeS2), bolj znan kot pirit (FeS2),[27] ki ima zlat lesk in je spodbudil Frana Erjavca k pisanju pripovedi »Ni vse zlato, kar se sveti«.[31]
Dobro znani so tudi binarni fero in feri halidi, z izjemo feri jodida. Fero halidi nastanejo v reakcijah železa s halogenvodikovimi kislinami in tvorijo pripadaloče hidrirane soli.[27]
- Fe + 2 HX → FeX2 + H2
Feri halidi nastajajo v reakcijah železa s fluorom, klorom in bromom. Najpomembnejši je feri klorid (FeCl3):
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
Kompleksne in organokovinske spojine[uredi | uredi kodo]

Železo tvori več cianidnih kompleksov, od katerih je najbolj znano prusko modro (Fe4(Fe[CN]6)3). Znana sta tudi kalijev fericianid in kalijev ferocianid. Prusko modro se uporablja kot protistrup pri zastrupitvah s talijem in radioaktivnim cezijem.[32][33] V pralnicah se porablja za modrenje rumenega odtenka belega perila, ki ga povzročajo v vodi prisotne železove soli.

Znanih je tudi več železovih karbonilnih spojin. Primer železove(0) spojine je pentakarbonil (Fe(CO)5), ki se uporablja za proizvodnjo karbonilnega železovega prahu, zelo reaktivne oblike kovinskega železa. S termičnim razpadom železovega pentakarbonila nastane trojedrni grozd triželezov dodekakarbonil (Fe3(CO)12). Collmanov reagent, dinatrijev tetrakarbonilferat (Na2[Fe(CO)4]), ki vsebuje železo oskidacijskem stanju -2, je koristen reagent v organski kemiji. Ciklopentadienilželezo je dikarbonilni dimer, ki vsebuje železo v redkem oksidacijskem stanju 1.[34]
Ferocen je izredno stabilen kompleks in prva odkrita spojina v obliki sendviča. V središču kompleksa je Fe2+, na katerega sta preko vseh deset ogljikovih atomov vezana dva ciklopentadienilna liganda. Odkritje takšne razporeditve atomov je bila šokantna novost,[35] ki je odprla povsem novo področje organokovinske kemije. Ferocen sam se lahko uporabi kot hrbtenica ligandov, na primer 1,1'-bis(difenilfosfino)ferocena (dppf). Z oksidacijo ferocena nastane ferocenijev kation (Fc+). Ferocen/ferocenijev člen se pogosto uporablja kot referenca v elektrokemiji.[36]
Zgodovina[uredi | uredi kodo]
Kovno železo[uredi | uredi kodo]

Zelo stari predmeti iz železa so zaradi korozije železa precej redkejši kot predmeti iz zlata ali srebra.[37] Železne koralde, izdelane leta 3500 pred n. št. ali prej, ki so jih odkrili v Gerzah, Egipt, vsebujejo 7,5 % niklja. Prisotnost niklja kaže na njihov meteorski izvor, ker je vsebnost niklja v Zemljini skorji izredno majhna. Meteorsko železo je bilo zaradi njegovega nebeškega izvora zelo cenjeno in se je pogosto uporabljalo za izdelovanje orožja. Znani so tudi celi primerki, razstavljeni v cerkvah.[37][38] Drugi železni predmeti, najdeni v Egiptu, so bili izdelani verjetno v letih 2500-3000 pr. n. št..
Železna vojaška oprema je imela v primerjevi z bronasto več prednosti. Bila je mnogo trša in trpežnejša, čeprav je bila dovzetna za rjavenje. Trditev je nekoliko sporna, saj hetitolog Trevor Bryce trdi, da se je orožje iz meteorskega železa, ki so ga uporabljale vojske v Mezopotamiji pred razvojem naprednih tehnik obdelave železa v Indiji, zaradi visoke vsebnosti ogljika v boju pogosto zdrobilo.[39]
Proizvodnja železa iz rude se je začela v srednji bronasti dobi, vendar je trajalo več stoletij, da je železo izpodrinilo bron. Najstarejši znani vzorci metalurško proizvedenega železa iz Asmarja v Mezopotamiji in Tel Chagar Bazarja v severni Siriji so iz obdobja 2700-3000 pr. n. št.[40] Zgleda, da so bili Hetiti prvi, ki so doumeli pridobivanje železa iz njegovih rud in ga zelo cenili. Železo so začeli proizvajati v letih 1500 in 1200 pr. n. št., po propadu njihovega imperija leta 1180 pr. n. št. pa se je njegova proizvodnja razširila po celem Bližnjem vzhodu.[40] Začela se je tako imenovana železna doba, ki je dosegla Evropo dvesto let kasneje, Zimbabwe v južni Afriki pa šele v 8. stoletju n. št.[40] Na Kitajskem se je proizvodnja železa začela okoli leta 500-700 pr. n. št.,[41] kamor je prišla preko Srednje Azije.[42] Najzgodnejša dokazana uporaba plavža na Kitajskem datira v 1. stoletje n. št.,[43] uporaba kupolne peči pa v čas vojskujočih se držav (403-221 pr. n. št.).[44] Uporaba plavža in kupolne peči se je v obdobju dinastij Song in Tang razširila po celi Kitajski.[45]
Artefakti metalurškega železa, najdeni v Indiji, so iz obdobja 1800-1200 pr. n. št.,[46] primerki iz Levanta pa približno iz leta 1500 pr. n. št..[47][48]
V Svetem pismu je železo prvič omenjeno v Prvi Mojzesovi knjigi, ki pravi, da je »Cila rodila Tubál Kajina, ki je koval vsakovrstno orodje iz brona in železa«.[49] Rudarjenje je omenjeno v Jobu 28:2: »Železo pridobivajo iz zemlje in baker talijo iz kamna«, železno pisalo v Jobu 19:24: »Da bi jih z železnim pisalom in s svincem za vselej vklesal v kamen!«, vigenj v Tobitu 4:20, železni vozovi v Jozuetu 17:16, železo za žeblje in skobe v Prvi kroniški knjigi 22:3, žage, klini in sekire v Drugi Samuelovi knjigi 12:31 in železna ponev v Ezekielu 4:3.[50] Železo je omenjeno tudi v Novi zavezi, na primer v Apostolskih delih 12:10, kjer so omenjena železna mestna vrata Antiohije.[51]

V Grčiji so začeli obdelovati železo v poznem 11. stoletju pr. n. št..[52] Od tam se je vzporedno s širjenjem Keltov razširilo na srednjo in zahodno Evropo. Po pisanju Plinija starejšega je bila raba železa v rimskem obdobju nekaj vsakdanjega.[38] Letna proizvodnja železa v Rimskem mperiju je ocenjena na 84.750 ton,[53] medtem ko je v istem obdobju v približno enako naseljenem kitajskem cesarstvu Han znašala približno 5.000 ton.[54]
Med industrijsko revolucijo v Združenem kraljestvu je začel industrijalec Henry Cort predelovati surovo železo v kovaško železo z manj kot 0,08 % ogljika in leta 1873 patentiral pudlanje, postopek za rafiniranje surovega železa. Postopek so kasneje večkrat izboljšali.
Lito železo[uredi | uredi kodo]

Sivo litino so prvič proizvedli na Kitajskem v 5. stoletju pr. n. št..[55] V Evropi se je proizvodnja začela šele v srednjem veku.[56][57] Najstarejše ulite predmete so arheologi odkrili v sedanji kitajski pokrajini Luhe. Lito železo se je uporabljalo v vojski, poljedelstvu in arhitekturi.[58] V Evropi se je v srednjem veku iz sive litine (točneje grodlja) s kovanjem proizvajalo tudi kovno železo. Za vse metalurške in kovaške procese se je za gorivo uporabljalo lesno oglje.
Srednjeveški plavži so bili zidani iz ognjeodporne opeke in visoki približno 3 m. Zrak se je vpihaval z ročno gnanimi mehovi.[57] Največji sodobni plavž ima prostornino 5.580 m3 in proizvede več kot 10.000 ton železa dnevno.[59]
Leta 1709 je Abraham Darby I. oglje zamenjal s koksom. Uvedba koksa je pocenila in povečala proizvodnjo železa in bila eden od dejavnikov, ki so vodili do industrijske revolucije. Proti koncu 18. stoletja je lito železo zaradi nižje cene začelo nekaterih področjih zamenjavati kovno železo. Razlik v lastnostih kovnega železa, litega železa in jekla do 18. stoletja niso povezovali z vsebnostjo ogljika.[40]
Ker je železo postalo cenejše in bolj dostopno, se je uveljavilo tudi v gradbeništvu, zlasti po izgradnji inovativnega prvega železa mostu leta 1778.
Jeklo[uredi | uredi kodo]
Jeklo, ki vsebuje manj ogljika kot surovo železo in več kot kovno železo, so prvič proizvedli v antiki v fužinah. Kovači v Luristanu v zahodnem Iranu so dobro jeklo proizvajali že okoli leta 1000 pr. n. št..[40] Izboljšani različici sta bili wootzovo jeklo, ki so ga razvili v Indiji okoli leta 300 pr. n. št., in damaščansko jeklo, ki so ga razvili okoli leta 500 pr. n. št.. Obe proizvodni metodi sta bili specializirani, zato se jeklo ni uveljavilo vse do 50. let 19. stoletja.[60]
V 17. stoletju so razvili nove metode proizvodnje jekla z ogljičenjem ingotov in s cementiranjem. V industrijski revoluciji so razvili proizvodnjo ingotov brez ogljika, kar so kasneje uporabili tudi v proizvodnji jekla. V drugi polovici 50. let 19. stoletja je Henry Bessemer iznašel nov postopek za proizvodnjo jekla v tako imenovani besemerjevi hruški, ki je vključeval vpihavanje zraka v surovo železo. Proizvodnja jekla se je s tem pocenila in povečala, proizvodnja kovnega železa pa opustila.[61]
Utemeljitev sodobne kemije[uredi | uredi kodo]
Antoine Lavoisier je z reakcijo vodne pare s kovinskim železom v žareči železni cevki proizvedel vodik, s čimer je postavil temelje zakona o ohranitvi mase. V anaerobnih oksidacijah železa z vodno paro potekajo naslednje reakcije:
- Fe + H2O → FeO + H2
- 2 Fe + 3 H2O → Fe2O3 + 3 H2
- 3 Fe + 4 H2O → Fe3O4 + 4 H2
Proizvodnja[uredi | uredi kodo]
Industrijski postopki[uredi | uredi kodo]
Proizvodnja železa ali jekla je postopek, sestavljen iz dveh glavnih korakov. V prvem koraku se iz rude v visoki peči ali plavžu proizvede surovo železo ali grodelj. V drugem koraku se surovo železo pretvori v kovno železo ali jeklo.
Za nekatere posebne namene, na primer za jedra elektromagnetov, se čisto železo proizvaja z elektrolizo raztopine železovega(II) sulfata.
Proizvodnja surovega železa[uredi | uredi kodo]


Industrijska proizvodnja železa se začne z železovo rudo, večinoma s hematitom (Fe2O3) in magnetitom (Fe3O4). Limonit, siderit in piritni ogorki so za proivodnjo manj primerni. Proizvodnja železa iz železove gobe je povsem opuščena.
Za redukcijo železovih oksidov v kovinsko železo se uporablja ogljik, praviloma koks. Redukcija običajno poteka v plavžu pri temperaturi približno 2000 °C. V proces vstopa tudi apnenec (CaCO3), ki deluje kot talilo in iz rude odstrani silikatne minerale, ki bi sicer zamašili plavž. Ruda, koks in apnenec se vsipata na vrhu plavža, v spodnjem delu pa se v plavž vpihuje vroč zrak. Poraba zraka je približno štiri tone na tono železa.[57]
V plavžu se koks s kisikom iz vpihanega zraka oksidira v ogljikov monoksid:
- 2 C + O2 → 2 CO
Ogljikov monoksid reducira železove okside v tekoče železo in se oksidira v ogljikov dioksid:
- Fe2O3 + 3 CO → 2 Fe + 3 CO2
- Fe3O4+ 4 CO → 3 Fe + 4 CO2
V spodnjem, zelo vročem delu plavža, nekaj oksidov reagira neposredno s koksom:
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2
- Fe3O4 + 2 C → 3 Fe + 2 CO2
Talilo, praviloma apnenec (CaCO3) in dolomit (CaMg(CO3)2), raztalita nečistoče. Dodajajo se lahko tudi posebna talila, odvisna od sestave rude. Apnenec se v plavžu pretvori v kalcijev oksid, bolj znan kot živo apno:
- CaCO3 → CaO + CO2
Nastali kalcijev oksid se veže s silicijevim dioksidom in tvori tekočo žlindro:
- CaO + SiO2 → CaSiO3
Tekoča žlindra se nabira v spodnjem delu plavža nad gostejšim raztaljenim železom in se skozi stransko odprtino ločeno od železa izpušča iz plavža. Uporabna je za gradnjo cest ali v poljedelstvu za izboljšanje sestave z minerali revne prsti.[57] Glavni proizvod plavža je surovo železo ali grodelj.
Železova ruda je zelo poceni. Njeno ceno določajo predvsem stroški prevoza. Cena železa je potemtakem odvisna od cene goriva in od stroškov drugih za proizvodnjo potrebnih snovi. Za 1000 ton železa je potrebno okoli 2000 ton rude, 1000 ton koksa, 600 ton dodatkov (npr. apnenca), 4000 ton zraka in 30 000 ton tehnološke vode za hlajenje in izpiranje. Iz masne bilance procesa je razvidno, da vsakih 1000 ton železa proizvede 600 ton trdnih odpadkov, 125 ton prahu in 5900 ton plavžnih plinov.
Neposredna redukcija[uredi | uredi kodo]

Zaradi skrbi za okolje so se razvile alternativne metode proizvodnje železa. Z neposredno redukcijo železove rude z zemeljskim plinom (metan) nastane prah, imenovan »gobasto« ali »direktno« železo, ki je primeren za proizvodnjo jekla.[57] Med neposredno redukcijo potekata dve glavni reakciji. V prvi se zemeljski plin katalitsko delno oksidira:
- 2 CH4 + O2 → 2 CO + 4 H2
Nastala zmes plinov v peči reducira železovo rudo v trdno gobasto železo:
- Fe2O3 + CO + 2 H2 → 2 Fe + CO2 + 2 H2O
Kremen iz železove rude se odstrani na že opisan način z dodajanjem apnenca.
Nadaljnja obdelava surovega železa[uredi | uredi kodo]
Surovo železo ali beli grodelj ni čisto, ampak vsebuje 4-5 % raztopljenega ogljika in manjše količine drugih nečistoč, med njimi žveplo, magnezij, fosfor in mangan. Glavna nečistoča je ogljik, zaradi katerega je železo krhko in trdo. Primerno je za proizvodnjo neketerih ulitih izdelkov, na primer peči, cevi, radiatorjev, stebrov uličnih svetilk in železniških tirnic.
Surovo železo se lahko predela ali v jeklo z vsebnostjo ogljika do 2 % ali v kovno železo (tržno čisto železo). Za proizvodnjo teh produktov so potrebni različni metalurški procesi, na primer kovanje, pudlanje, prepihavanje z zrakom v Besssemerjevem ali Thomasovem konverterju, Siemens-Matinovi peči, po Linz-Donawitzovem postopku ali v električni peči. Namen vseh postopkov je oksidacija vsega (ali samo dela) ogljika in drugih nečistoč. K tako pripravljenemu železu se lahko zatem z dodajanjem drugih kovin, najpogosteje Si, Mn, Ni, Cr in W, proizvajajo zelo različne jeklene zlitine.
Žilavljenje je postopek, v katerem se kosi jekla nekaj ur segrevajo pri 700-800 in nato počasi ohladijo. Tako obdelano jeklo je mehkejše in bolj kovno.
Laboratorijske metode[uredi | uredi kodo]
V laboratoriju se železo pripravlja praviloma na dva načina: z elektrolizo železovega(II) klorida na železno katodo in redukcijo železovh oksidov z vodikom pri 500 °C.[62]
Železarstvo na slovenskem ozemlju[uredi | uredi kodo]
Železarstvo na našem ozemlju ima zelo dolgo tradicijo.
Fužinarstvo[uredi | uredi kodo]
Fužinarstvo je zgodovinska gospodarska dejavnost pridobivanja in predelave kovin, predvsem železa, v polizdelke in končne izdelke. Na slovenskem ozemlju so bile fužine (iz beneškoitalijanske narečne besede fusina - topilnica, kovačnica) sprva omejene na lokalne vire železove rude – bobovca, kasneje tudi na bolj oddaljene vire, in lokalne vire energije, predvsem lesnega oglja. Najbolj znane so bile fužine v Bohinju, Savi (Jesenice), Javorniku, Tržiču, Ajdovščini, Dvoru pri Žužemberku in Mežiški dolini. Nanje še vedno spominjajo številna ledinska in krajevna imena, predvsem na severozahodu in severu Slovenije.[63]
Postavitev fužin je bila pogojena s podelitvijo vladarskega ali deželnoknežjega privilegija. Glede na namen so se navadno delile na fužine za razkosanje ali velike laške fužine, fužine za presnanje, fužine za izkovanje ali brescianske fužine, fužine za jeklo, fužine za pločevino in fužine za proizvodnjo specialnih jekel. Med industrijsko revolucijo, ki se je v Angliji začela že v 17. stoletju, na Slovenskem pa mnogo kasneje, so jih zaradi zastarele tehnologije opustili, njihovo vlogo pa so prevzele železarne in jeklarne.[63]
Železarstvo in jeklarstvo[uredi | uredi kodo]
Med industrijsko revolucijo je na Slovenskem delovalo pet večjih železarskih obratov: na Jesenicah, v Štorah, na Ravnah na Koroškem, na Prevaljah in v Dvoru pri Žužemberku. Eno vidnejših vlog pri razvoju železarstva so imele Jesenice, kjer so odkrili postopek za pridobivanje feromangana v plavžu.
Jesenice[uredi | uredi kodo]
Predhodnica jeseniške železarne je bila delniška Kranjska industrijska družba, ustanovljena leta 1869. Na Jesenicah je bilo že pred tem nekaj fužin, katerih lastniki so se pogosto menjavali. Obrate na Savi so leta 1766 prevzeli Ruardi, obrate na Plavžu in Javorniku pa leta 1752 Zoisi. Obrati so sprva cveteli, med industrijsko revolucijo pa so postali nekonkurenčni. Ker lastniki niso bili finančno dovolj močni, da bi jih posodobili, so z ljubljanskim lastnikom parnega mlina Lambertom Karlom Lukmannom in veletrgovcema Karlom Kanutom Holzerjem in Vincencom Sunigom ustanovili Kranjsko industrijsko družbo, ki naj bi prevzela upravljanje industrijskih in rudarskih podjetij.
Družba je leta 1870 od Zoisovih dedičev odkupila plavže in fužine na Javorniku, v Radovni, Mostah, Bohinjski Bistrici in Stari Fužini. Leto kasneje je od Viktorja Ruarda odkupila plavž na Savi, dve pudlarski peči z žagami in mlini, fužine v Mojstrani in Globokem, rudnik Savske jame in rudnik manganove rude na Begunjščici. Leta 1873 je sledil še nakup fužin v Slapu pri Tržiču. Posel kljub temu ni cvetel, kot so pričakovali, zato so morali že leta 1882 prodati del posesti.
V jeseniški železarni so iznašli postopek za proizvodnjo feromangan]a, kar ji je prineslo svetovno slavo[64] in zlato medaljo na svetovni razstavi na Dunaju leta 1873. Postopek so kasneje izpopolnili in proizvajali železo s stalno vsebnostjo 40 % mangana, največ v plavžu na Savi. Najvišja vsebnost mangana je dosegla 54 %. Ko je Kranjska industrijska družba zgradila večje in sodobnejše plavže v Trstu, so savske in javorniške plavže leta 1897 in 1904 ugasnili in uvedli predelovalne obrate in proizvodnjo jekla v Siemens-Martinovi peči.
Železarna Jesenice je dosegla ponoven razcvet v 1960. letih in se po razpadu Jugoslavije v 1990. letih preoblikovala v več manjših podjetij. Vodilno podjetje je SŽ Acroni d.o.o., ustanovljeno 23. decembra 1992, ki stalno širi in posodablja proizvodnjo in skrbi tudi za varstvo okolja. V njen proizvodni program spadajo nerjavna, trda, konstrukcijska, orodna in specialna jekla, elektro pločevina in nikljeve zlitine.[64]

Ravne na Koroškem[uredi | uredi kodo]
Štore[uredi | uredi kodo]
V Štorah se je železarstvo začelo leta 1850, ko je Tirolec Andrieu dobil koncesijo za postavitev pudlarne in valjarne. Oba obrata so odprli leta 1860 in nato dozidali livarno in kovačnco s parnimi kladivi. Leta 1876 je lastnik železarne postal Karel Neufeldt, ki je svojo železarsko in premogovniško posest združil v podjetje Berg-und Hűttenwerk Store s sedežem na Dunaju. Leta 1912-1913 so pudlarske peči odstranili, zgradili novo martinarno z 20-tonsko Siemens-Martinovo pečjo za proizvodnjo jekla, novo toplotno centralo s tremi parnimi kotli in dvema parnima strojema in modernizirali valjarno.[65]
Leta 1950 so začeli izdelovati valje in leta 1959 prvi v Jugoslaviji izdelali valje iz nodularne litine. Leta 1954 so zgradili elektroplavž, ki je pokrival vse lastne potrebe po belem in sivem grodlju, in se v valjarni preusmerili na proizvodnjo vzmeti in specialnih profilov. Leta 1968 se je v livarni II začela proizvodnja specialnih jekel.[65]
Na začetku 1970. let so Siemens-Martinovo peč ustavili in septembra 1973 pognali novo Brlecovo obločno peč za proizvodnjo specialnih jekel. V naslednjih letih so začeli proizvajati tudi traktorje. Po letu 1990 se je zaradi izgube tržišč v razpadli Jugoslaviji proizvodnja jekel prepolovila. Železarna se je reorganizirala v več samostojnih podjetij, ki nadaljujejo štorsko železarsko tradicijo.[65]
Dvor pri Žužemberku[uredi | uredi kodo]


Železarna na Dvoru pri Žužemberku je obratovala od leta 1796 do 1896. Spadala je med največje industrijskih obrate na Slovenskem. Leta 1820 se je usmerjena v železolivarstvo in sredi 19. stoletja ostala edina na našem ozemlju, ki se je ukvarjala s tako imenovanim umetniškim livom. Železovo rudo je dobivala iz Soteske, Repče gore in Hmeljnika, oglje pa iz gozdov bližnjega Kočevskega Roga.
Leta 1806 je posebni odposlanec Jurija Karađorđa na Dvoru naročil 60 topov in možnarjev, vendar je avstrijska vlada pogodbo razveljavila. Livarne na Dvoru so nekaj topov kljub temu na skrivaj izdelale in poslale naročniku.[66]
Leta 1822 je železarno prevzel nov nadzornik Ignacij von Panz in jo še povečal, s čimer je postala največje tovrstno podjetje južno od Alp. Leta 1834 je železarna dobila naziv »Cesarsko-kraljeva privilegirana tovarna za litoželezno in kovano blago kneza Auersperga«. Zaposlovala je več kot petsto delavcev in imela za proizvodnjo svojih izdelkov izdelane natančne predpise. Takšni predpisi so bili takrat v Evropi redki in so pomenili velik napredek v podjetništvu.
Na Dvoru so izdelovali različne železne predmete, od preprostih predmetov za vsakdanjo rabo (kotli, žeblji, pločevina...) do zahtevnih litoželeznih izdelkov, ki so jih tudi izvažali. Na Dvoru so med drugim ulili železno konstrukcijo nekdanjega Mrtvaškega mosta v Ljubljani (sedanji Hradeckega most) in prve vagončke za železnico v Postojnski jami.
Leta 1869 je železarna pogorela, kar je povzročilo zmanjšanje proizvodnje in krčenje železarne. Železarna se ni nikoli več povsem pobrala in zaradi hude konkurence povsem propadla. Zadnji obrat so zaprli leta 1896.
Fužine ob Hublju[uredi | uredi kodo]
Zgodovina ajdovskih fužin se je začela 12. novembra 1561, ko je cesar Ferdinand I. Habsburški izdal koncesijo za dva plavža ob Hublju in v dolini Vodic.[67]
Železo se je proizvajalo iz limonita iz rudnika Napredalo med Podkrajem in Vodicami. Fužine so bile od samega začetka usmerjene v proizvodnjo kovnega železa. Ko so peči predelali v plavž, je proizvodnja narasla na 45 in celo 200 ton letno. Nova železarna je proizvajala kovno železo, jeklo in grodelj.[67]
Lesno oglje so kuhali v Trnovskem gozdu in Hrušici. Železo so predelovali v lastnih kovačijah, opremljenih s kovaškimi ognjišči ter kladivi in mehovi na vodni pogon. Kovali so ročna orodja za lastne potrebe, za delo na polju in v vinogradu ter v gozdu in rudniku, izdelovali so granate in krogle ter okovja za ladijske topove. Ulivali so celo retorte za žganje cinabarita v rudniku živega srebra v Idriji.[67]
Fužine so s krajšim presledkom delovale od leta 1561 do leta 1700.
Uporaba[uredi | uredi kodo]
Metalurgija[uredi | uredi kodo]
| Država | Železova ruda |
Surovo železo |
Neposredno reducirano železo |
Jeklo |
|---|---|---|---|---|
| Kitajska | 1.114,9 | 549,4 | 573,6 | |
| Avstralija | 393,9 | 4,4 | 5,2 | |
| Brazilija | 305,0 | 25,1 | 0,011 | 26,5 |
| Japonska | 66,9 | 87,5 | ||
| Indija | 257,4 | 38,2 | 23,4 | 63,5 |
| Ruska federacija | 92,1 | 43,9 | 4,7 | 60,0 |
| Ukrajina | 65,8 | 25,7 | 29,9 | |
| Južna Koreja | 0,1 | 27,3 | 48,6 | |
| Nemčija | 0,4 | 20,1 | 0,38 | 32,7 |
| Svet | 1.594,9 | 914,0 | 64,5 | 1.232,4 |
Železo je najpogosteje uporabljena kovina, saj predstavlja 95 % svetovne proizvodnje kovin. Zaradi nizke cene in visoke trdnosti je nepogrešljivo na primer v strojegradnji, gradbeništvu, ladjedelništvu in avtomobilski industriji. Ker je čisto železo zelo mehko, se najpogosteje legira z drugimi kovinami.
Tržno železo se razvršča na podlagi čistosti in vsebnosti dodatkov. Surovo železo ima 3,5-4,5 % ogljika[69] in različne količine nečistoč, najpogosteje žvepla, silicija in fosforja. Zanimivo je samo kot vmesni produkt za proizvodnjo litine in jekla. Z zmanjšanjem vsebnosti nečistoč, kot sta žveplo in fosfor, ki slabšajo lastnosti železa, nastane siva litina, ki vsebuje 2-4 % ogljika, 1-6 % silicija in manjšo količino mangana. Tališče sive litine je 1140-1200 °C in je nižje od tališč obeh njenih glavnih komponent. Njene mehanske lastnosti so zelo odvisne od oblike ogljika v zlitini.
Bele litine vsebujejo ogljik v obliki železovega karbida (cementit, Fe3C), ki je zelo trd in krhek in igra glavno vlogo v mehanskih lastnostih belih litin. Litine so trde in neodporne na udarce. Na prelomih je polno drobnih ploskev zelo svetlega srebrnega in svetlečega se zdrobljenega železovega karbida.

V sivem železu je ogljik v obliki ločenih lističev grafita, ki povzročajo stresna mesta. Železo je zaradi ostrih robov delcev grafita krhko. Novejšim različicam sivega žleza, imenovanega raztezno ali žilavo železo, so po posebnem postopku dodani sledovi magnezija, ki lističe grafita pretvorijo v sferoide ali nodule, s čimer se zelo povečata žilavost in trdnost.
Kovaško železo vsebuje manj kot 0,25 % ogljika in veliko žlindre, ki je v obliki tankih vlaken ujeta v kovino.[69] Železo je zato žilavo in kovno in bolj obstojno proti koroziji kot jeklo, vendar ne tako taljivo kot surovo železo. Nabrušeni robovi kovine hitro otopijo. V kovaštvu so ga skoraj v celoti izpodrinila lahka ogljikova jekla z 0,05–0,15 % % ogljika. Lahko jeklo je bolj podvrženo koroziji kot kovaško železo, vendar je cenejše in mnogo bolj dostopno.
Ogljikova jekla vsebujejo do 2 % ogljika[70] in majhne količine mangana, žvepla, fosforja in silicija. Jeklene zlitine vsebujejo poleg različnih količin ogljika tudi druge kovine, med njimi krom, vanadij, molibden, nikelj, volfram in druge. Legirni elementi povečajo ceno jekel, zato se uporabljajo samo v posebne namene. Najpogostejša in najbolj znana zlitina je nerjavno jeklo.
V metalurgiji železa so nedavno razvili vrsto mikrolegiranih jekel (HSLA iz angleškega High-strength low-alloy steel) z izredno majhnimi vsebnostmi legirnih elementov, ki z minimalnimi stroški povečajo trdnost. Pogosto izredno povečajo tudi žilavost.
Železo se, med drugim, uporablja tudi za zaščito pred ionizirajočim sevanjem. Njegov učinek je sicer manjši kot pri drugih zaščitnih materialih, ima pa višjo mehansko odpornost.
Glavna pomanjkljivost železa, jekla in večine zlitin je njihova majhna odpornost proti koroziji. Železo se pred vodo in kisikom zaščiti s premazi, galvanizacijo, pasivacijo, plastificiranjem, bruniranjem ali katodno zaščito.
Spojine[uredi | uredi kodo]
Pomen železovih spojin je v primerjavi s pomenom železa v metalurgiji zelo majhen, saj imajo spojine samo nekaj nišnih aplikacijh. Železovi katalizatorji se tradicionalno uporabljajo v Haber-Boschevem procesu proizvodnja amonijaka in Fischer-Tropschevem procesu pretvarjanja ogljikovega monoksida v ogljikovodike za goriva in maziva.[71] Uprašeno železo v kislih topilih se je uporabljalo za redukcino nitrobenzena v anilin.[72]
Železov(II) klorid se uporablja za čiščenje odpadnih voda, barvanje tkanin, kot barvni aditiv v premazih, aditiv v živalski hrani in jedka za baker v proizvodnji tiskanih vezij.[73] Raztopljen v etanolu tvori železovo tinkturo. Drugi železovi halidi so omejeni na laboratorijsko rabo.
Železov(II) sulfat je prekurzor za druge železove spojine. Uporablja se tudi za redukcijo kromatov v cementu in kot prehranski dodatek za zdravljenje slabokrvnosti, ki je posledica pomanjkanja železa. Železov(III) sulfat se uporablja za obarjanje trenutnih drobnih delcev v rezervoarjih za pitno vodo. Železov(II) klorid se uporablja kot redukcijski flokulant, kemikalija za tvorjenje železovih kompleksov, proizvodnjo magnetnih železovih oksidov in reducent v organskih sintezah.
Železo v človeškem organizmu[uredi | uredi kodo]
Železo je eden najpomembnejših biogenih elementov človeškega organizma. Skupna količina železa v telesu zdravega odraslega človeka znaša 4,5 g. Je sestavni del več sto proteinov in encimov, med katerimi so najpomembnejši:
- železo v hemu je sestavni del hemoglobina in mioglobina, ki prenašata kisik in omogočata celično dihanje
- hem je kofaktor citokromov, ključnih encimov biotransformacije ksenobiotikov,
- hem je kofaktor številnih encimov, ki sodelujejo pri mitohondrijskem prenosu elektronov oz. v dihalni verigi,
- železo vsebujoči proteini z nehemsko strukturo, kot sta NADH dehidrogenaza in sukcinat dehidrogenaza, so ključni encimi primarnega metabolizma,
- katalaze in peroksidaze so hemski proteini, ki sodelujejo pri razgradnji vodikovega peroksida ter varujejo celice pred škodljivimi kisikovimi zvrstmi,
- hemski encim mieloperoksidazo uporabljajo nevtrofilci pri sintezi hipoklorove kisline, slednjo pa uporabljajo pri uničenju bakterij,
- človeški organizem uporablja železo vsebujoč encim prolil hidroksilazo kot enega izmed senzorjev za hipoksijo ter tako omogoča prilagodljivost človeškega telesa življenju na različnih nadmorskih višinah,
- ribonukleotid reduktaza je železo vsebujoč encim, udeležen pri sintezi DNA
Z uravnoteženo prehrano se v telo dnevno vnese 10 do 30 mg železa. Naravni viri so tako rastlinskega kot živalskega izvora. V naslednji preglednici je prikazana vsebnost železa v posameznih živilih na 100 g živila.
| Živilo | Železo (mg) |
|---|---|
| Leča | 11,1 |
| Školjke | 10,9 |
| Goveja jetra | 10,8 |
| Sezam | 10,4 |
| Sojino zrnje | 9,7 |
| Piščančja jetra | 9,2 |
| Rdeč fižol | 6,4 |
| Ostrige | 5,1 |
| Govedina na žaru | 4,25 |
| Mandlji | 4,0 |
| Suhe marelice | 3,2 |
| Jajce | 2,0 |
| Piščančje prsi | 1,9 |
| Tofu | 1,2 |
| Losos | 1,2 |
| Brokoli | 1,0 |
Absorbcija železa v človeškem organizmu je omejena s fizikalno-kemijskimi lastnostmi železovih ionov in s fiziološkim stanjem železa v organizmu. Železo v živilih živalskega izvora je vezano na proteine, v živilih rastlinskega izvora pa v soleh anorganskih kislin. Železo, ki se uporablja v terapiji per os, je v obliki soli anorganskih kislin. V organizmu zdravega, odraslega moškega se absorbira 0,5 do 1,0 mg železa, v organizmu zdrave, odrasle ženske 1,0 do 1,5 mg dnevno. V stanjih povečanih potreb je ta količina bistveno večja. Iz živil živalskega izvora se železo absorbira sorazmerno dobro (20-odstotno), iz živil rastlinskega izvora pa bistveno slabše (10-odstotno). Železo v teh živilih je trivalentno, zato se mora pred absorbcijo reducirati v dvovalentno železo.
Absorbcija poteka po celi dolžini tankega črevesa, največ v dvanajstniku. V celicah črevesa se veže s proteinom apoferitinom v feritin. Absorbcija preneha, ko je porabljen ves apoferitin. Železo se po potrebi sprošča iz feritina, sproščeni apoferitin pa se vrne v ciklus. Absorbcija železa je torej omejena s količino prostega apoferitina (mukozna blokada). Če so potrebe po železu majhne, zaloge pa velike, se celotna količina absorbiranega železa prenese v feritin. Organizem se s tem zavaruje pred preveliko absorpcijo železa. Pred vstopom v plazmo se železo veže na feriglobulin in nastane transferin, s katerim se prenaša do ciljnega organa, kjer se veže na specifične receptorje. V procesu endocitoze transferin vstopa v eritroblast, sprošča železo in se uporablja v sintezi hemoglobina. Ena molekula transferina lahko veže največ 2 fero iona. Z merjenjem vsebnosti transferina se lahko določi kapaciteta možnega vezanega železa. Neuporabljeno železo se deponira v jetrih, vranici in kostnem mozgu kot rezervno železo. Železo se vskladišči v dveh oblikah. Pogostejši je feritin, topen v vodi, ki je sestavljen iz kristalov železovega hidroksida, prekritega z luskami beljakovine apoferitin. Druga oblika je v vodi netopen hemosiderin. Vsebnost plazmatskega feritina se lahko uporabi za oceno zalog železa v organizmu. Absorpcija in prenosna kapaciteta se lahko povečata pri pomanjkanju železa, hipoksiji, anemiji, pri povečani sintezi transferina.
Nekateri dejavniki bodisi povečujejo bodisi zmanjšujejo absorbcijo železa. Med pospeševalce absorbcije spadajo:
- askorbinska kislina (vitamin C), ki reducira trovalentno železo v dvovalentno in tvori komplekse z dvovalentnim železom, ki ima visoko biološko uporabnost; trovalentno železo se praktično ne absorbira
- druge organske kisline, kot so citronska, maleinska in mlečna kislina, ki vse po vrsti tvorijo različne komplekse z železovimi ioni Fe2+, in tako olajšajo njihovo absorbcijo
- rdeče meso, ribe in perutnina razen tega, da vsebujejo železo v hemu, pospešujejo absorpcijo nehemskega železa
Zaviralci absorpcije so naslednji:
- fitinska kislina je prisotna v stročnicah, žitaricah in rižu; majhne količine fitinske kisline (5 do 10 mg) lahko zavrejo absorpcijo nehemskega železa do 50 %, zaradi česar je absorpcija železa iz stročnic (soja, fižol, leča, grah) izjemno nizka
- polifenoli iz sadja, zelenjave, kave, čaja, vina in začimb lahko znatno zavrejo absorpcijo železa
- sojini proteini močno zavirajo absorpcijo železa, kar deloma sovpada s količino fitatov.
Priporočeni dnevni odmerki železa po starostnih obdobjih so predstavljeni v naslednji preglednici:
| Življenjsko obdobje |
Starost | Moški (mg/dan) |
Ženske (mg/dan) |
|---|---|---|---|
| Dojenčki | 0-6 mesecev | 0,27 | 0,27 |
| Dojenčki | 7-12 mesecev | 11 | 11 |
| Otroci | 1-3 leta | 7 | 7 |
| Otroci | 4-8 let | 10 | 10 |
| Otroci | 9-13 let | 8 | 8 |
| Adolescenti | 14-18 let | 11 | 15 |
| Odrasli | 19-50 let | 8 | 18 |
| Odrasli | >51 let | 8 | 8 |
| Nosečnice | vse starosti | - | 27 |
| Dojilje | 18 let in mlajše | - | 10 |
| Dojilje | 19 let in starejše | - | 9 |
Pomanjkanje železa[uredi | uredi kodo]
Pomanjkanje železa je najpogostejša oblika pomanjkanja mikroelementov v svetu. Poznamo tri ravni pomanjkanja železa:
- izčrpane so zaloge, vendar funkcionalnega pomanjkanja še ni,
- zgodnje funkcionalno pomanjkanje železa že moti nastajanje rdečih krvnih celic,
- daljše pomanjkanja železa povzroči mikrocitno hipokromno slabokrvnost (anemijo), za katero so značilne majhne rdeče krvne celice z nizko vsebnostjo hemoglobina. Simptomi, kot so bledica, utrujenost, slabost, so posledica nezadostne oskrbe s kisikom. Ravno tako je moten potek vseh telesnih procesov, v katerih sodelujejo snovi, ki vsebujejo železo. Anemija zaradi pomanjkanja železa se zdravi z železovimi prehranskimi dopolnili.
Vzroki za pomanjkanje so lahko:
- hitra rast,
- nosečnost, v kateri so potrebe po železu povečane zaradi oskrbe zarodka in posteljice ter povečanja volumna krvi,
- kronična krvavitev v nekaterih boleznih,
- akutna krvavitev, ki običajno povzroči le kratkotrajno pomanjkanje, saj se izčrpajo samo zaloge železa v krvi,
- bolezni, ki povzročajo slabšo absorbcijo železa v črevesju (celiakija, infekcija),
- vegetarijanstvo, ker je biološka razpoložljivost železa iz rastlinskih virov precej manjša kot biološka razpoložljivost iz živalskih virov; vegetarijanci morajo zaužiti približno 80 % več železa in paziti, da zaužijejo dovolj snovi, ki optimirajo absorbcijo železa,
- redna in intenzivna telesna vadba; potrebe telesno aktivnih ljudi so lahko do 30 % višje kot pri neaktivni populaciji.
Pri pomanjkanju železa pridejo v poštev prehranska dopolnila, ki vsebujejo železo v različnih oblikah in z različno vsebnostjo elementarnega železa:
- železov (II) sulfat heptahidrat, 22 % elementarnega železa,
- železov (II) sulfat monohidrat, 33 % elementarnega železa,
- železov (II) glukonat, 12 % elementarnega železa,
- železov (II) fumarat, 33 % elementarnega železa.
Toksičnost[uredi | uredi kodo]
Primeri zastrupitev z železom so redki. Pojavljajo se pri namernem jemanju velikih odmerkov ali pri obolenjih hemokromatoze, katerih vzrok je podedovana motnja čezmerne absorpcije železa. Smrtna doza je med 200 in 250 mg/kg telesne teže, simptomi akutne zastrupitve pa se lahko pojavijo že pri 20–60 mg/kg telesne teže. Simptomi se lahko pojavijo v štirih fazah:
- 1-6 ur po zaužitju lahko pride do slabosti, bruhanja, šibkega srčnega utripa, nizkega krvnega tlaka, letargije in bolečin v trebušnem predelu,
- če zastrupitev ne povzroči takojšnje smrti, se lahko simptomi umirijo za naslednjih 12-24 ur,
- 12-48 ur po zaužitju se simptomi vrnejo in lahko vključujejo še odpovedovanje srčno-žilnega sistema, jeter, ledvic in centralnega živčnega sistema,
- 2-6 tednov po zaužitju se lahko razvijejo kronične poškodbe jeter, želodca in centralnega živčnega sistema.
Interakcije[uredi | uredi kodo]
- Železo lahko vstopa v interakcije z mnogimi zdravili, pa tudi z določeno hrano in sestavinami hrane. Mleko, jajca, kava, črni čaj, fitinska kislina, celulozna vlakna zmanjšujejo absorpcijo železa, medtem ko jo alkohol znatno povečuje, kar lahko povzroči tudi toksičnost.
- Tetraciklinski antibiotiki: hkratna uporaba železa in tetraciklinskih antibiotikov lahko povzroči klinično pomembno interakcijo in zmanjša terapevtsko koncentracijo antibiotika, zato se uživanje železa priporoča najmanj dve uri pred antibiotikom ali po njem.
- Etidronat: klinično pomembna interakcija lahko nastane pri hkratni uporabi železa in etidronata, v kateri se pomembno zmnanjšuje absorpcija etidronata, zato se priporoča ločeno jemanje.
- Fluorokinoloni: hkratna uporaba železa in fluorokinolonov lahko izzove heliranje fluorokinolonov in tako zmanjša absorpcijo ter povzroča znižanje terapevtske vrednosti v seču in serumu. Da bi se zmanjšala možnost te klinično pomembne interakcije, se priporoča ločeno jemanje.
- Cimetidin, antacidi, kalcijeve spojine: lahko zmanjšajo absorpcijo železa, zato se mora povečati skupni dnevni vnos.
- Vitamin E: večji odmerki železa lahko katalizirajo oksidacijo in povečajo potrebe po vitaminu E.
Zunanje povezave[uredi | uredi kodo]
- železo v periodnem sistemu video posnetkov (Univerza v Nottinghamu)
Sklici[uredi | uredi kodo]
- ↑ Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Ram, R. S.; Bernath, P. F. (2003). »Fourier transform emission spectroscopy of the g4Δ–a4Δ system of FeCl«. Journal of Molecular Spectroscopy. 221 (2): 261. Bibcode:2003JMoSp.221..261R. doi:10.1016/S0022-2852(03)00225-X.
- ↑ Demazeau, G.; Buffat, B.; Pouchard, M.; Hagenmuller, P. (1982). »Recent developments in the field of high oxidation states of transition elements in oxides stabilization of six-coordinated Iron(V)«. Zeitschrift für anorganische und allgemeine Chemie. 491: 60–66. doi:10.1002/zaac.19824910109.
- ↑ Lu, J.; Jian, J.; Huang, W.; Lin, H.; Li, J; Zhou, M. (2016). »Experimental and theoretical identification of the Fe(VII) oxidation state in FeO4−«. Physical Chemistry Chemical Physics. 18 (45): 31125–31131. Bibcode:2016PCCP...1831125L. doi:10.1039/C6CP06753K. PMID 27812577.
- ↑ Periodni sistem elementov Arhivirano 2015-08-22 na Wayback Machine.. IUPAC.
- ↑ 6,0 6,1 Kohl, Walter H. (1995). Handbook of materials and techniques for vacuum devices. Springer. str. 164–167. ISBN 1-56396-387-6.
- ↑ 7,0 7,1 Kuhn, Howard; Medlin, Dana, ur. (2000). ASM Handbook – Mechanical Testing and Evaluation (PDF). Zv. 8. ASM International. str. 275. ISBN 0-87170-389-0.
- ↑ K. Takaji, O. Toshikatsu (1964). Properties of Various Pure Irons: Study on pure iron I. Tetsu-to-Hagane 50 (1): 42–47.
- ↑ V. Raghavan (2004). Materials Science and Engineering. PHI Learning Pvt. Ltd., str. 218. ISBN 81-203-2455-2.
- ↑ 10,0 10,1 R. Boehler (2000). High-pressure experiments and the phase diagram of lower mantle and core materials. Review of Geophysics (American Geophysical Union) 38 (2): 221–245.
- ↑ 11,0 11,1 B.L. Bramfitt, A.O. Benscoter (2002). The Iron Carbon Phase Diagram. Metallographer's guide: practice and procedures for irons and steels. ASM International. str. 24–28. ISBN 978-0-87170-748-2.
- ↑ M.J. Wilson (2007). Concise encyclopedia of the structure of materials. Elsevier. str. 183. ISBN 0-08-045127-6.
- ↑ R. Boehler, M. Ross (2007). Properties of Rocks and Minerals_High-Pressure Melting. Mineral Physics. Treatise on Geophysics 2. Elsevier. str. 527–541. doi: 10.1016/B978-044452748-6.00047-X.
- ↑ G. Rugel, T. Faestermann, K. Knie, G. Korschinek, M. Poutivtsev, D. Schumann, N. Kivel, I. Günther-Leopold, R. Weinreich, M. Wohlmuther (2009). New Measurement of the 60Fe Half-Life. Physical Review Letters 103 (7). doi: 10.1103/PhysRevLett.103.072502. ISSN 0031-9007.
- ↑ N. Dauphas, O. Rouxel (2006). Mass spectrometry and natural variations of iron isotopes. Mass Spectrometry Reviews 25 (4): 515–550. doi: 10.1002/mas.20078. PMID 16463281.
- ↑ M.P. Fewell (1995). The atomic nuclide with the highest mean binding energy. American Journal of Physics 63 (7): 653. Bibcode: 1995AmJPh..63..653F. doi: 10.1119/1.17828.
- ↑ S. Mostefaoui, G.W. Lugmair, P. Hoppe, A. El Goresy (2004). Evidence for live 60Fe in meteorites. New Astronomy Reviews 48: 155. Bibcode: 2004NewAR..48..155M. doi: 10.1016/j.newar.2003.11.022.
- ↑ M.A. Bautista, A.K. Pradhan (1995). Iron and Nickel Abundances in H~II Regions and Supernova Remnants. Bulletin of the American Astronomical Society 27: 865. Bibcode: 1995AAS...186.3707B.
- ↑ I. McDonald, G.C. Sloan, A.A. Zijlstra, N. Matsunaga, M. Matsuura, K.E. Kraemer, J. Bernard-Salas, A.J. Markwick (2010). Rusty Old Stars: A Source of the Missing Interstellar Iron?. The Astrophysical Journal Letters 717 (2): L92–L97. arXiv: 1005.3489. Bibcode: 2010ApJ...717L..92M. doi: 10.1088/2041-8205/717/2/L92.
- ↑ Iron: geological information. WebElements. Pridobljeno 23. maja 2010.
- ↑ J.W. Morgan, E. Anders (1980). Chemical composition of Earth, Venus, and Mercury. Proc. Nat. Acad. Sci. 77 (12): 6973–6977. Bibcode: 1980PNAS...77.6973M. doi: 10.1073/pnas.77.12.6973. PMC 350422. PMID 16592930.
- ↑ T.W. Lyons, C.T. Reinhard (2009). Early Earth: Oxygen for heavy-metal fans. Nature 461 (7261): 179–181. Bibcode: 2009Natur.461..179L. doi: 10.1038/461179a. PMID 19741692.
- ↑ P. Cloud (1973). Paleoecological Significance of the Banded Iron-Formation. Economic Geology 68 (7): 1135–1143. doi: 10.2113/gsecongeo.68.7.1135.
- ↑ C. Emiliani (1992). Planet earth: cosmology, geology, and the evolution of life and environment. Cambridge University Press. str. 152. ISBN 978-0-521-40949-0.
- ↑ G. Klingelhöfer, R.V. Morris, P.A. Souza, D. Rodionov, C. Schröder (2007). Two earth years of Mössbauer studies of the surface of Mars with MIMOS II. Hyperfine Interactions 170: 169–177. Bibcode: 2006HyInt.170..169K. doi: 10.1007/s10751-007-9508-5.
- ↑ W. Nam (2007). High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions. Accounts of Chemical Research 40 (7): 522–531. doi: 10.1021/ar700027f. PMID 17469792.
- ↑ 27,0 27,1 27,2 27,3 A.F. Holleman, E. Wiberg, N. Wiberg (1985). Iron. Lehrbuch der Anorganischen Chemie. 91.–100. izdaja. Walter de Gruyter. str. 1125–1146. ISBN 3-11-007511-3.
- ↑ W.M. Reiff, G.J. Gary (1984). Mössbauer Spectroscopy and the Coordination Chemistry of Iron. Mössbauer spectroscopy applied to inorganic chemistry. Springer. str. 245–283. ISBN 978-0-306-41647-7.
- ↑ M. Ware (1999). An introduction in monochrome. Cyanotype: the history, science and art of photographic printing in Prussian blue. NMSI Trading Ltd. str. 11–19. ISBN 978-1-900747-07-3.
- ↑ L. Gmelin (1852). Mercury and Iron. Hand-book of chemistry 6. Cavendish Society. str. 128–129.
- ↑ Janez Dolenc. Motivi za Erjavčevo pripoved »Ni vse zlato, kar se sveti!«. Pridobljeno 31. marca 2015.
- ↑ Questions and Answers on Prussian Blue. Pridobljeno 6. junija 2009.
- ↑ D.F. Thompson, E.D. Callen (2004). Soluble or Insoluble Prussian Blue for Radiocesium and Thallium Poisoning?. Annals of Pharmacotherapy 38 (9): 1509–1514. doi: 10.1345/aph.1E024. PMID 15252192.
- ↑ N.N. Greenwood, A. Earnshaw (1984). Chemistry of the Elements. Oxford: Pergamon Press. str. 1282–1286. ISBN 0-08-022057-6.
- ↑ P. Laszlo, R. Hoffmann (2000). Ferrocene: Ironclad History of Rashomon Tale?. Angewandte Chemie 39 (1): 123–124. doi: 10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z. PMID 10649350.
- ↑ N. Federman, A. Pelegrino, A. Caramori, V.A. Darin (2004). Ferrocene: 50 Years of Transition Metal Organometallic Chemistry—From Organic and Inorganic to Supramolecular Chemistry. ChemInform 35 (43). doi: 10.1002/chin.200443242.
- ↑ 37,0 37,1 Weeks 1968, str. 29.
- ↑ 38,0 38,1 Weeks 1968, str. 31.
- ↑ T. Bryce (2007). Hittite Warrior. Osprey Publishing. str. 22–23. ISBN 978-1-84603-081-9.
- ↑ 40,0 40,1 40,2 40,3 40,4 Weeks 1968, str. 32.
- ↑ R.D. Sawyer, Mei-chün Sawyer. The Seven Military Classics of Ancient China. Boulder: Westview 1993). str. 10.
- ↑ V.C. Pigott (1999). str. 8.
- ↑ P.J. Golas (25. februar 1999). Science and Civilisation in China. Volume 5, Chemistry and Chemical Technology, Part 13, Mining. Cambridge University Press. str. 152. ISBN 978-0-521-58000-7.
- ↑ V.C. Pigott (1999). The Archaeometallurgy of the Asian Old World. Philadelphia: University of Pennsylvania Museum of Archaeology and Anthropology. ISBN 0-924171-34-0, str. 191.
- ↑ The Coming of the Ages of Steel. Brill Archive. 1961. str. 54. GGKEY:DN6SZTCNQ3G.
- ↑ R. Tewari. The origins of Iron Working in India: New evidence from the Central Ganga plain and the Eastern Vindhyas. State Archaeological Department. Pridobljeno 23. maja 2010.
- ↑ E. Photos (1989). The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results. World Archaeology 20 (3): 403–421. doi: 10.1080/00438243.1989.9980081. JSTOR 124562.
- ↑ J.D. Muhly (2003). Metalworking/Mining in the Levant. Near Eastern Archaeology 180: 174–183.
- ↑ 1 Mojzes 4,22. BIBLIJA.net.
- ↑ Weeks 1968, str. 29–30.
- ↑ Weeks 1968, str. 30.
- ↑ J. Riederer, R.-B. Wartke. Iron. Brill's New Pauly, Brill 2009.
- ↑ P.T. Craddock (2008). Mining and Metallurgy. The Oxford Handbook of Engineering and Technology in the Classical World. Oxford University Press. ISBN 978-0-19-518731-1, str. 108.
- ↑ D.B. Wagner. The State and the Iron Industry in Han China. NIAS Publishing, Copenhagen 2001, ISBN 87-87062-77-1, str. 73.
- ↑ D.B. Wagner (2003). Chinese blast furnaces from the 10th to the 14th century. Historical Metallurgy 37 (1): 25–37.
- ↑ E. Giannichedda (2007). Metal production in Late Antiquity. Technology in Transition AD 300–650 Lavan. Brill, Leiden; ISBN 90-04-16549-5, str. 200.
- ↑ 57,0 57,1 57,2 57,3 57,4 V. Biddle, G. Parker. Chemistry, Precision and Design. A Beka Book, Inc.
- ↑ D.B. Wagner (1993). Iron and Steel in Ancient China. Brill. str. 335–340. ISBN 978-90-04-09632-5.
- ↑ Only together we shall susseed!. Pridobljeno 20. maja 2008.
- ↑ J.S. Spoerl. A Brief History of Iron and Steel Production. Saint Anselm College.
- ↑ P. Enghag (8. januar 2008). Encyclopedia of the Elements: Technical Data - History - Processing - Applications. str. 190–191. ISBN 9783527612345.
- ↑ H. Lux. Metallic Iron. Handbook of Preparative Inorganic Chemistry, 2. izdaja. Academic Press, 1963, NY. 2. zvezek. str. 1490-1491.
- ↑ 63,0 63,1 Fužinarstvo Arhivirano 2015-04-12 na Wayback Machine.- Pridobljeno 6. aprila 2006.
- ↑ 64,0 64,1 sij.acroni Arhivirano 2015-10-16 na Wayback Machine.. Pridobljeno 7. aprila 2015.
- ↑ 65,0 65,1 65,2 Železarstvo v Štorah Arhivirano 2015-04-11 na Wayback Machine.. Pridobljeno 6. aprila 2015.
- ↑ Darinka Kladnik (1994). Sto slovenskih krajev.
- ↑ 67,0 67,1 67,2 12. novembra 1561 so pričele delovati fužine ob Hublju. Občina Ajdovščina. Pridobljeno 26. februarja 2019.
- ↑ Steel Statistical Yearbook 2010 Arhivirano 2012-07-01 na Wayback Machine.. World Steel Association.
- ↑ 69,0 69,1 C.J. McIntyre, F.C. Blaine (1920). The Making, Shaping and Treating of Steel. Pittsburgh: Carnegie Steel Company. str. 173–174. ISBN 1-147-64423-3.
- ↑ Classification of Carbon and Low-Alloy Steel. Pridobljeno 4. aprila 2015.
- ↑ K.W. Kolasinski (2002). Where are Heterogenous Reactions Important. Surface science: foundations of catalysis and nanoscience. John Wiley and Sons. str. 15–16. ISBN 978-0-471-49244-3.
- ↑ J.J. McKetta (1989). Nitrobenzene and Nitrotoluene. Encyclopedia of Chemical Processing and Design: Volume 31 – Natural Gas Liquids and Natural Gasoline to Offshore Process Piping: High Performance Alloys. CRC Press. str. 166–167. ISBN 978-0-8247-2481-8.
- ↑ E. Wildermuth, H. Stark, G. Friedrich, F.L. Ebenhöch, B. Kühborth, J. Silver, R. Rituper (2000). Ullmann's Encyclopedia of Industrial Chemistry. doi: 10.1002/14356007.a14_591. ISBN 3527306730.
Viri[uredi | uredi kodo]
- Vovk Tomaž, Obreza Aleš. Prehranska dopolnila I: minerali in vitamini. Fakulteta za farmacijo, Ljubljana 2009
- Medić-Šarić Marica, Buhač Ines, Bradamante Vlasta. Vitamini in minerali. Ins obs medicus, Ptuj 2002
- Pokorn Dražigost. Prehrana v različnih življenjskih obdobjih: prehranska dopolnila v prehrani. Marbona, Ljubljana 2005
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Elements Known to the Ancients. Discovery of the Elements. Easton, PA: Journal of Chemical Education. str. 29–40. ISBN 0-7661-3872-0. LCCN 68-15217
Zunanje povezave[uredi | uredi kodo]
 Predstavnosti o temi železo v Wikimedijini zbirki
Predstavnosti o temi železo v Wikimedijini zbirki



