Blok s
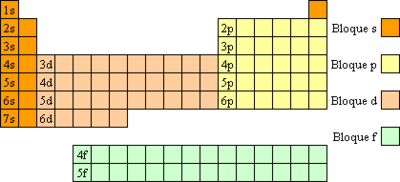
Blok s periodnega sistema elementov sestavljajo elementi iz prve in druge skupine elementov (alkalijske in alkalijske zemeljske kovine) ter vodik in helij. Zanje je značilno, da so v osnovnih stanjih atomov njihovi energetsko najbogatejši elektroni na orbitalah s. Vsi atomi, razen vodika in helija, te elektrone zelo lahko oddajo in tvorijo katione z nabojem 1+ (elementi iz prve skupine in vodik) ali 2+ (elementi iz druge skupine). Elektronska konfiguracija helija je kemijsko izredno stabilna, zato ne tvori nobene znane stabilne spojine in ga prištevamo med žlahtne pline.
Vsi elementi, razen helija, s so izredno močni reducenti, zato jih v naravi nikoli ne najdemo v elementarni obliki. Elementi v kovinski obliki se pridobivajo z elektrolizo talin njihovih soli. Pridobivanje z elektrolizo vodnih raztopin njihovih soli ni mogoče, ker takoj po nastanku reagirajo z vodo v hidrokside in vodik. Vse kovine iz bloka s, razne litija, berilija, rubidija in cezija, je leta 1807 in 1808 izoliral Sir Humphry Davy. Berilij sta neodvisno drug od drugega izolirala F. Wooler in A.A. Bussy leta 1828. Litij je izoliral Robert Bunsen leta 1854. Leta 1864 je izoliral še rubidij in s spektroskopijo odkril cezij. Cezij je šele leta 1881 izoliral Carl Setterberg z elektrolizo raztaljenega cezijevega cianida.
Trdota kovin iz bloka s je zelo različna: vse alkalijske kovine so izredno mehke, berilij pa je precej trd. Vse kovine, razen berilija in magnezija, so zelo reaktivne in zato neuporabne za pripravo zlitin. Izjema so zlitine s svincem, v katerih je njihova vsebnost manjša od 2%. Berilij in magnezij se kljub visoki ceni uporabljata v lahkih in trdnih zlitinah in kot reducenta v organski kemiji in pri pridobivanju titana, cirkonija in tantala iz njihovih rud.
Vse kovine iz bloka s so na zraku vnetljive in zahtevajo pazljivo ravnanje. Vse, razen berilija in magnezija, se morajo skladiščiti v argonu ali v inertnih tekočih ogljikovodikih. Z vodo burno reagirajo in sproščajo vodik. Izjemi sta magnezij, ki reagira počasi, in berilij, ki reagira samo amalgamiran z živim srebrom, ki razgrajuje nastali oksidni sloj.
Vir[uredi | uredi kodo]
- Wiberg, Egon: Lehrbuch der anorganischen Chemie, Walter de Gruyter & Co., Berlin (1964)
