Lantan
 | |||||||||||||||||||||||
| Lantan | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [lantán] | ||||||||||||||||||||||
| Videz | srebrno bel | ||||||||||||||||||||||
| Standardna atomska teža Ar, std(La) | 138,90547(7)[1] | ||||||||||||||||||||||
| Lantan v periodnem sistemu | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Vrstno število (Z) | 57 | ||||||||||||||||||||||
| Skupina | n/a | ||||||||||||||||||||||
| Perioda | perioda 6 | ||||||||||||||||||||||
| Blok | blok f | ||||||||||||||||||||||
| Razporeditev elektronov | [Xe] 5d1 6s2 | ||||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 18, 18, 9, 2 | ||||||||||||||||||||||
| Fizikalne lastnosti | |||||||||||||||||||||||
| Faza snovi pri STP | trdnina | ||||||||||||||||||||||
| Tališče | 920 °C | ||||||||||||||||||||||
| Vrelišče | 3464 °C | ||||||||||||||||||||||
| Gostota (blizu s.t.) | 6,162 g/cm3 | ||||||||||||||||||||||
| v tekočem stanju (pri TT) | 5,94 g/cm3 | ||||||||||||||||||||||
| Talilna toplota | 6,20 kJ/mol | ||||||||||||||||||||||
| Izparilna toplota | 400 kJ/mol | ||||||||||||||||||||||
| Toplotna kapaciteta | 27,11 J/(mol·K) | ||||||||||||||||||||||
Parni tlak (ekstrapoliran)
| |||||||||||||||||||||||
| Lastnosti atoma | |||||||||||||||||||||||
| Oksidacijska stanja | 0,[2] +1, +2, +3 (močno bazični oksid) | ||||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 1,10 | ||||||||||||||||||||||
| Ionizacijske energije |
| ||||||||||||||||||||||
| Atomski polmer | empirično: 187 pm | ||||||||||||||||||||||
| Kovalentni polmer | 207±8 pm | ||||||||||||||||||||||
| Druge lastnosti | |||||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | ||||||||||||||||||||||
| Kristalna struktura | dvojna heksagonalna gosto zložena (dhgz) | ||||||||||||||||||||||
| Hitrost zvoka tanka palica | 2475 m/s (pri 20 °C) | ||||||||||||||||||||||
| Temperaturni raztezek | α, poly: 12,1 µm/(m⋅K) (at r.t.) | ||||||||||||||||||||||
| Toplotna prevodnost | 13,4 W/(m⋅K) | ||||||||||||||||||||||
| Električna upornost | α, poly: 615 nΩ⋅m (at r.t.) | ||||||||||||||||||||||
| Magnetna ureditev | paramagnetik[3] | ||||||||||||||||||||||
| Magnetna susceptibilnost | +118.0·10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||
| Youngov modul | α form: 36,6 GPa | ||||||||||||||||||||||
| Strižni modul | α form: 14,3 GPa | ||||||||||||||||||||||
| Stisljivostni modul | α form: 27,9 GPa | ||||||||||||||||||||||
| Poissonovo razmerje | α form: 0,280 | ||||||||||||||||||||||
| Mohsova trdota | 2,5 | ||||||||||||||||||||||
| Trdota po Vickersu | 360–1750 MPa | ||||||||||||||||||||||
| Trdota po Brinellu | 350–400 MPa | ||||||||||||||||||||||
| Številka CAS | 7439-91-0 | ||||||||||||||||||||||
| Zgodovina | |||||||||||||||||||||||
| Odkritje | Carl Gustaf Mosander (1838) | ||||||||||||||||||||||
| Najpomembnejši izotopi lantana | |||||||||||||||||||||||
| |||||||||||||||||||||||
Lantan (latinsko lanthanum) je kemijski element s simbolom La in vrstnim številom 57. Lantan je srebrno bela kovina, ki spada v 3. skupino periodnega sistema elementov in v skupino lantanoidov. V naravi se nahaja v nekaterih redkozemeljskih mineralih, običajno v kombinaciji s cerijem in drugimi redkozemeljskimi elementi. Lantan je kovna, raztezna in mehka kovina, ki na zraku hitro oksidira. Proizvaja se iz mineralov monazita in bastnezita z zapleteno večstopenjsko ekstrakcijo. Lantanove spojine se uporabljajo kot katalizatorji, aditivi za steklo, ogljene elektrode za obločne luči, kresilne kamenčke za vžigalnike, elektronske katode, scintilatorje itd. Lantanov karbonat (La2(CO3)3) je zdravilo proti hiperfosfatemiji.
Lastnosti[uredi | uredi kodo]
Fizikalne lastnosti[uredi | uredi kodo]
Lantan je kovna, raztezna in mehka srebrno bela kovina, ki ima pri sobni temperaturi heksagonalno kristalno strukturo. Pri 310 °C preide v ploskovno centrirano kocko, pri 865 °C pa v telesno centrirano kocko.[5] Na zraku hitro oksidira (centimeter debel vzorec bi popolnoma oksidiral v enem letu),[6] zato v elementarnem stanju ni uporaben.
Posamezni atomi lantana se lahko vgradijo v molekulo fulerena.[7] Če se z lantanom inkapsuliranim fulerenom napolnijo ogljikove nanocevke in se nato žarijo, nastanejo v njih nanoverige kovinskega lantana.[8]
Kemijske lasnosti[uredi | uredi kodo]
Lantan se pojavlja v oksidacijskih stanjih +3 in +2, od katerih je prvo mnogo bolj stabilno. LaH3 je zato bolj stabilen od LaH2.[9] Lantan pri 150 °C zlahka zgori v lantanov(III) oksid:
- 4La + 3O2 → 2La2O3
V vlažnem zraku se pri sobni temperaturi pretvori v hidratiziran oksid, pri čemer se močno poveča njegov volumen.[9]
Lantan je precej elektropozitiven in počasi reagira s hladno vodo, z vročo vodo pa hitro in tvori lantanov hidroksid:
- 2La(s) + 6H2O(l) → 2La(OH)3(aq) + 3H2(g)
Kovinski lantan reagira z vsemi halogeni. Reakcija je pri temperaturi preko 200 °C burna:
- 2La(s) + 3F2(g) → 2LaF3(s)
- 2La(s) + 3Cl2(g) → 2LaCl3(s)
- 2La(s) + 3Br2(g) → 2LaBr3(s)
- 2La(s) + 3I2(g) → 2LaI3(s)
Z lahkoto se raztaplja v razredčeni žveplovi kislini in tvori raztopino, v kateri so La3+ ioni, ki so obstojni kot kompleksi [La(OH2)9]3+:[10]
- 2La(s) + 3H2SO4(aq) → 2La3+(aq) + 3SO2−4(aq) + 3H2(g)
Pri povišani temperaturi se spaja z dušikom, ogljikom, žveplom, fosforjem, borom, selenom, silicijem in arzenom in tvori binarne spojine.[9]
Izotopi[uredi | uredi kodo]
Naravni lantan je sestavljen iz stabilnega izotopa 139La (99,91 %) in radioaktivnega izotopa 138La (0,01 %). Razpolovna doba 238La je 1,05·1011 let. Ostali izotopi so proizvedeni umetno. Med njimi je najbolj stabilen 237La z razpolovno dobo 60.000 let. Drugi izotopi imajo razpolovne dobe manjše od 24 ur, večina celo manjše od ene minute. Lantan ima tudi tri meta stanja.
Lantanovi izotopi imajo velik razpon relativnih atomskih mas, in sicer od 117 do 155 g/mol.
Zgodovina[uredi | uredi kodo]
Ime lantan izvira iz grške besede starogrško λανθάνειν [lanthanein], ki pomeni "skrit". Odkril ga je švedski kemik Carl Gustav Mosander leta 1839, ko je s segrevanjem delno razgradil vzorec cerijevega nitrata in nastalo sol raztopil v razredčeni dušikovi kislini. Lantan v relativno čisti obliki so izolirali leta 1923.[9]
Nahajališča[uredi | uredi kodo]

Lantan spada v skupino redkozemeljskih elementov, vendar v naravi sploh ni redek. Vsebnost lantana v zemeljski skorji je relativno velika – 32 ppm. Redke zemlje so dobile takšno ime, ker so resnično redke v primerjavi z "navadnimi" zemljami kot sta apnenec CaCO3 ali magnezit MgCO3 in se nahajajo samo na redkih nahajališčih.[9]
Najpomembnejša lantanova minerala sta monazit (Ce, La, Th, Nd, Y)PO4 in bastnezit (Ce, La, Y)CO3F, v katerih je v celotni količini lantanoidov od 25 do 38% lantana. Vsebnost lantana v bastnezitu je na splošno večja kot v monazitu. Bastnezit je bil vse do leta 1949 zelo redek mineral, ki ni bil komercialno zanimiv za pridobivanje lantanoidov, potem pa so odkrili obsežno nahajališče Mountain Pass v Kaliforniji. Kmalu zatem so odkrili tudi druga nahajališča, predvsem v Afriki in na Kitajskem.
Proizvodnja[uredi | uredi kodo]

Večina lantana se proizvede iz monazita in bastnezita. Zmes mineralov se najprej zdrobi in zmelje. Monazit se lahko zaradi svojih magnetnih lastnosti loči od jalovine z večkratno elektromagnetno separacijo. Obogatena ruda se nato obdela z vročo koncentrirano žveplovo kislino, pri čemer nastane raztopina sulfatov redkih zemelj. Raztopina se prefiltrira in delno nevtralizira z natrijevim hidroksidom do pH 3-4. Pri teh pogojih se iz raztopine obori in odstrani torij. Raztopina se zatem obdela z amonijevim oksalatom, ki redke zemlje pretvori v njihove netopne oksalate. Oksalati se zatem s praženjem pretvorijo v okside. Oksidi se raztopijo v dušikovi kislini, pri čemer se izloči ena od glavnih komponent cerij, katerega oksid v dušikovi kislini ni topen. Lantan se iz raztopine izloči s kristalizacijo kot dvojna sol z amonijevim nitratom, ki je manj topna kot dvojne soli drugih redkih zemelj.[9]
Najbolj učinkovit način ločitve lantanove soli iz raztopine soli redkih zemelj je ionska izmenjava. V tem procesu se njegovi ioni adsorbirajo na ustreznem ionskem izmenjevalcu z zamenjavo z vodikovimi, amonijevimi ali bakrovimi ioni. Ioni redkih zemelj se nato selektivno izpirajo z ustreznimi kompleksirajočimi solmi, na primer z amonijevim citratom ali nitrilotracetatom. Lantan se lahko loči od drugih redkih zemelj tudi z ekstrakcijo s primernimi organskimi topili, na primer s tributil fosfalatom.[9] Trenutno se za ekstrakcijo največ uporablja 2-etilheksil ester 2-etilheksilfosfonske kisline, s katerim je laže ravnati kot z njegovim predhodnikom 2-etilheksil fosfatom.
Kovinski lantan se iz oksida pridobiva s segrevanjem z amonijevim kloridom ali fluoridom in fluorovodikovo kislino pri 300-400 °C, pri čemer nastane njegov klorid ali fluorid:
- La2O3 + 6NH4Cl → 2LaCl3 + 6NH3 + 3H2O
Sledi redukcija z alkalijskimi ali zemljoalkalijskimi kovinami v vakuumu ali zaščitni atmosferi argona:
- LaCl3 + 3Li → La + 3LiCl
Čisti lantan se lahko proizvede tudi z elektrolizo taline brezvodnega LaCl3 in NaCl ali KCl pri povišani temperaturi.[9]
Uporaba[uredi | uredi kodo]

Lantan se je prvič komercialno uporabil v mrežicah za plinske svetilke. Carl Auer von Welsbach je v ta namen uporabil zmes 60 % magnezijevega oksida, 20 lantanovega oksida in 20 % itrijevega oksida. Zmes je leta 1885 patentiral pod imenom Actinophor. Mrežice so dajale zelenkasto svetlobo in niso bile preveč uporabne. Njegovo podjetje, ki je leta 1887 ustanovilo tovarno v Atzgersdorfu, je že leta 1889 propadlo.[11]
V sodobnem času imajo lantan in njegove spojine precej široko področje uporabe:
- La(Ni3,6Mn0,4Al0,3Co0,7) je eno od gradiv za anode v nikej-kovinsko hidridnih baterijah. Zaradi visokih stroškov ekstrahiranja drugih lantanoidov se namesto čistega lantana uporablja mischmetal - zlitina z več kot 50 % lantana. Zlitina je medkovinska spojina vrste AB5.[12][13] Nikelj-kovinsko hidridne baterije se vgrajujejo v večino sodobnih hibridnih avtomobilov, zato je poraba lantana zelo velika. V Toyoto Prius je vgrajenih 10–15 kg lantana, tehnologija, ki bi povečala zmogljivost baterij, pa zahteva kar dvakrat večjo količino lantana.[14][15]
- Gobaste zlitine za skladiščenje vodika lahko vsebujejo tudi lantan. V takšne zlitine se lahko v reverzibilnem adsorbcijskem procesu vskladišči do 400 krat večji volumen vodika kot ga imajo same. Ker se med vsakim procesom sprošča toplota, bi lahko takšne zlitine služile tudi v sistemih za sladiščenje energije.[5][16]

- Mischmetal je piroforna zlitina, ki se uporablja za izdelavo kresilnih kamenčkov za vžigalnike, in vsebuje 25-45 % lantana.[5]
- Lantanov oksid (La2O3) in borid (LaB6) se uporabljata v elektronkah za vroče katode, ki močno emitirajo elektrone. Kristali LaB6 se uporabljajo tudi kot viri elektronov v elektronskih mikroskopih in Hallovih motorjih.[17]
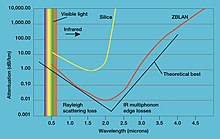
- Lantanov fluorid (LaF3) je bistvena komponenta fluoridnega stekla z imenom ZBLAN. Steklo je izredno prepustno za infrardečo svetlobo in se zato uporablja v optičnih komunikacijskih sistemih.[18]
- S cerijem prevlečen lantanov(III) bromid in lantanov(III) klorid sta sodobna anorganska scintilatorja, ki imata velik svetlobni izkoristek, najboljšo energijsko resolucijo in hiter odziv. Sevanje svetlobe je zelo stabilno in precej visoko na širokih temperaturnih območjih, zato sta še posebno uporabna pri visokih temperaturah. Takšni scintilatorji se že uporabljajo komercialno v detektorjih nevtronov ali gama žarkov.[19]
- Okrog 25 % spojin redkih zemelj se porabi za ogljene obločne luči, ki se uporabljajo za razsvetljavo predvsem v filmskih studijih in projektorjih.[5]
- Lantanov(III) oksid (La2O3) izboljša odpornost stekla proti alkalijam in se uporablja za proizvodnjo specialnih optičnih stekel, na primer stekel za absorbcijo infrardeče svetlobe in leč za kamere in teleskope. Stekla imajo namreč visoke lomne količnike in majhno sipanje svetlobe.[5]
- Lantanov(III) oksid se uporablja tudi kot aditiv, ki v tekoči fazi pospeši rast zrn med sintranjem silicijevega nitrida in cirkonijevega diborida.[20]
- Majhne količine lantana se dodajajo jeklom za poboljšanje njihove kovnosti, odpornosti na udarce in vlečnosti. Dodatek lantana k molibdenu zmanjša njegovo trdoto in občutljivost na temperaturne spremembe.[5]
- Majhne količine lantana so v mnogih proizvodih za vzdrževanje plavalnih bazenov, ker odstranjujejo fosfate, s katerimi se hranijo alge.[21]
- Lantanov oksid se kot substitut za radioaktivni torij dodaja volframu, ki se uporablja za elektrode za obločno varjenje.[22][23]
- Lantanove spojine, pa tudi spojine drugih elemetno redkih zemelj (oksidi, kloridi, itd.), so sestavni del raznih katalizatorjev, na primer katalizatorjev za krekiranje nafte.[24]
- Lantan-barijevo radiološko datiranje se uporablja za ocenjevanje starosti kamnin in rud, vendar tehnika ni preveč razširjena.[25]
- Lantanov karbonat (Forsenol, Shire Pharmaceuticals) se uporablja kot zdravilo, ki absorbira viške fosfatov pri hiperfosfatemiji oziroma v zadnjih stadijih bolezni ledvic.[26][27]
- Lantanov fluorid se uporablja v premazih za fosforjeve svetilke. V zmesi z evropijevim fluoridom se uporablja tudi v kristalnih membranah za selektivne elektrode fluorovih ionov.[9]
- Lantan se podobno kot hrenova peroksidaza uporablja v molekularni biologiji kot indikator elektronske gostote.[28]
- LaCl se uporablja v morski akvaristiki za zniževanje fosfatov Po4
Biološka vloga[uredi | uredi kodo]
Lantan nima nobene znane biološke vloge. Pri zaužitju se ne absorbira, pri injiciranju pa se izloča zelo počasi. Že omenjeni lantanov karbonat s komercialnim imenom Fosrenol® se uporablja kot zdravilo za eliminiranje presežka fosfatov pri boleznih ledvic.[27]
Lantan ima farmakološke učinke na nekatere receptorje in ionske kanale. Posebno učinkovit je za receptorje GAMK (gama-aminomaslena kislina), ki so glavni inhibitorni živčni prenašalci (nevrotransmiterji) v osrednjem živčevju vretenčarjev.[29]
Strupenost[uredi | uredi kodo]
Lantan je malo do srednje strupen in zahteva skrbno ravnanje. Najnevarnejši je v delovnem okolju zaradi možnosti inhalacije plina, kar lahko povzroči pljučni edem, še posebej ob daljšem izpostavljanju. Povečuje tudi možnost nastanka pljučnega raka, verjetno pa predstavlja nevarnost za jetra zaradi kopičenja. Pri živalih lahko negativno vpliva na razmnoževanje in razvoj ter živčevje.[30][31][32]
Sklici[uredi | uredi kodo]
- ↑ Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Yttrium and all lanthanides except Ce and Pm have been observed in the oxidation state 0 in bis(1,3,5-tri-t-butylbenzene) complexes, see Cloke, F. Geoffrey N. (1993). »Zero Oxidation State Compounds of Scandium, Yttrium, and the Lanthanides«. Chem. Soc. Rev. 22: 17–24. doi:10.1039/CS9932200017. and Arnold, Polly L.; Petrukhina, Marina A.; Bochenkov, Vladimir E.; Shabatina, Tatyana I.; Zagorskii, Vyacheslav V.; Cloke (15. december 2003). »Arene complexation of Sm, Eu, Tm and Yb atoms: a variable temperature spectroscopic investigation«. Journal of Organometallic Chemistry. 688 (1–2): 49–55. doi:10.1016/j.jorganchem.2003.08.028.
- ↑ Lide, D. R., ur. (2005). »Magnetic susceptibility of the elements and inorganic compounds«. CRC Handbook of Chemistry and Physics (PDF) (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 0-8493-0464-4.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Hammond, C.R. (2000). The Elements, in Handbook of Chemistry and Physics, 81. izdaja. CRC press. ISBN 0-8493-0481-4.
- ↑ »Rare-Earth Metal Long Term Air Exposure Test«. Pridobljeno 8. avgusta 2009.
- ↑ Tsuchiya, T.; in sod. (2008). »Nanorods of endohedral metallofullerene derivative«. Journal of the American Chemical Society. 130 (2): 450–1. doi:10.1021/ja710396n.
- ↑ Guan, L.; in sod. (2008). »Metallic Wires of Lanthanum Atoms Inside Carbon Nanotubes«. Journal of the American Chemical Society. 130: 2162. doi:10.1021/ja7103069.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 9,7 9,8 Patnaik, P. (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill, str. 444–6. ISBN 0-07-049439-8 Pridobljeno 06.06.2009.
- ↑ »Chemical reactions of Lanthanum«. Webelements. Pridobljeno 6. junija 2009.
- ↑ »Lighting«. 11th edition of Encyclopedia Britannica (1911). Pridobljeno 6. junija 2009.
- ↑ »Inside the Nickel Metal Hydride Battery« (PDF). Pridobljeno 6. junija 2009.
- ↑ Tliha, M.; in sod. (2007). »AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries«. Journal of Alloys and Compounds. 436: 221. doi:10.1016/j.jallcom.2006.07.012.
- ↑ »As hybrid cars gobble rare metals, shortage looms«. Reuters. 31. avgust 2009.
- ↑ Bauerlein, P.; in sod. (2008). »Progress in high-power nickel–metal hydride batteries«. Journal of Power Sources. 176: 547. doi:10.1016/j.jpowsour.2007.08.052.
- ↑ Uchida, H. (1999). »Hydrogen solubility in rare earth based hydrogen storage alloys«. International Journal of Hydrogen Energy. 24: 871. doi:10.1016/S0360-3199(98)00161-X.
- ↑ Sommerville, J.D.; Lyon, B. King. »Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage« (PDF). 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8–11 July 2007, Cincinnati, OH. Arhivirano iz prvotnega spletišča (PDF) dne 20. julija 2011. Pridobljeno 6. junija 2009.
- ↑ Harrington, J.A. »Infrared Fiber Optics« (PDF). Rutgers University. Arhivirano iz prvotnega spletišča (PDF) dne 9. maja 2008. Pridobljeno 29. maja 2010.
- ↑ »BrilLanCe-NxGen« (PDF). Arhivirano iz prvotnega spletišča (PDF) dne 29. aprila 2011. Pridobljeno 6. junija 2009.
- ↑ Kim, K. (2003). »The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering«. Materials Characterization. 50: 31. doi:10.1016/S1044-5803(03)00055-X.
- ↑ »Phosphate in swimming pools - the real cause of algae«. Arhivirano iz prvotnega spletišča dne 11. septembra 2009. Pridobljeno 6. junija 2009.
- ↑ Howard B. Cary (1995). Arc welding automation. CRC Press. str. 139. ISBN 0824796454.
- ↑ Jeffus, L. (2003). »Types of Tungsten«. Welding : principles and applications. Clifton Park, N.Y.: Thomson/Delmar Learning. str. 350. ISBN 9781401810467.
- ↑ Gupta, C.K.; Krishnamurthy, N. (2004). Extractive metallurgy of rare earths. CRC Press. str. 441. ISBN 0415333407.
- ↑ Nakai S.; Masuda A.; Lehmann B. (1988). »La-Ba dating of bastnaesite« (PDF). American Mineralogist. 7: 1111.
- ↑ Gomella, L.G. & Haist, S.A. (2007). "Chapter 22. - Commonly Used Medications". V: Clinician's Pocket Reference: The Scut Monkey, 11 izdaja; urednika Gomella L.G. in Haist S.A. The McGraw-Hill Companies, Inc.
- ↑ 27,0 27,1 »FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients«. 28. oktober 2004. Arhivirano iz prvotnega spletišča dne 26. aprila 2009. Pridobljeno 6. junija 2009.
- ↑ Chau, Y.P.; Lu, K.S. (1995). »Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers«. Acta Anatomica (Basel). 153 (2): 135–144.
- ↑ Boldyreva, A. A. (2005). »Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field«. Bulletin of Experimental Biology and Medicine. 140 (4): 403. doi:10.1007/s10517-005-0503-z. PMID 16671565.
- ↑ Lanthanum Lenntech. Pridobljeno 25.08.2010.
- ↑ Lacour B., Lucas A.; Auchere D.; in sod. (2005). »Chronic renal failure is associated with increased tissue deposition of lanthanum after 28-day oral administration«. Kidney Int. 67: 1062–9.
- ↑ Barry, M.J; Meehan, B.J. (2000). »The acute and chronic toxicity of lanthanum to Daphnia carinata«. Chemosphere. 41 (10): 1669–74. doi:10.1016/S0045-6535(00)00091-6.
Zunanje povezave[uredi | uredi kodo]


