Kisik
 Vretje tekočega kisika | |||||||||||||||||||||
| Kisik | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [kiˈsiːk] | ||||||||||||||||||||
| Alotropi | O2, O3 (ozon) in več | ||||||||||||||||||||
| Videz | plin: brezbarven kapljevina in trdnina: svetlo modra | ||||||||||||||||||||
| Standardna atomska teža Ar, std(O) | [15,99903; 15,99977] običajno: 15,999 | ||||||||||||||||||||
| Kisik v periodnem sistemu | |||||||||||||||||||||
| |||||||||||||||||||||
| Vrstno število (Z) | 8 | ||||||||||||||||||||
| Skupina | skupina 16 (halkogeni) | ||||||||||||||||||||
| Perioda | perioda 2 | ||||||||||||||||||||
| Blok | blok p | ||||||||||||||||||||
| Razporeditev elektronov | [He] 2s2 2p4 | ||||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 6 | ||||||||||||||||||||
| Fizikalne lastnosti | |||||||||||||||||||||
| Faza snovi pri STP | plin | ||||||||||||||||||||
| Tališče | (O2) −218,79 °C | ||||||||||||||||||||
| Vrelišče | (O2) −182,962 °C | ||||||||||||||||||||
| Gostota (pri STP) | 1,429 g/L | ||||||||||||||||||||
| v tekočem stanju (pri TV) | 1,141 g/cm3 | ||||||||||||||||||||
| Trojna točka | −218,789 °C, 0,1463 kPa | ||||||||||||||||||||
| Kritična točka | −118,569 °C, 5,043 MPa | ||||||||||||||||||||
| Talilna toplota | (O2) 0,444 kJ/mol | ||||||||||||||||||||
| Izparilna toplota | (O2) 6,82 kJ/mol | ||||||||||||||||||||
| Toplotna kapaciteta | (O2) 29,378 J/(mol·K) | ||||||||||||||||||||
Parni tlak
| |||||||||||||||||||||
| Lastnosti atoma | |||||||||||||||||||||
| Oksidacijska stanja | −2, −1, 0, +1, +2 | ||||||||||||||||||||
| Elektronegativnost | Paulingova lestvica: 3,44 | ||||||||||||||||||||
| Ionizacijske energije |
| ||||||||||||||||||||
| Kovalentni polmer | 66±2 pm | ||||||||||||||||||||
| Van der Waalsov polmer | 152 pm | ||||||||||||||||||||
| Druge lastnosti | |||||||||||||||||||||
| Pojavljanje v naravi | prvobitno | ||||||||||||||||||||
| Kristalna struktura | kubična | ||||||||||||||||||||
| Hitrost zvoka | 330 m/s (plin, pri 27 °C) | ||||||||||||||||||||
| Toplotna prevodnost | 26,58×10−3 W/(m⋅K) | ||||||||||||||||||||
| Magnetna ureditev | paramagnetik | ||||||||||||||||||||
| Magnetna susceptibilnost | +3449,0·10−6 cm3/mol (293 K)[1] | ||||||||||||||||||||
| Številka CAS | 7782-44-7 | ||||||||||||||||||||
| Zgodovina | |||||||||||||||||||||
| Odkritje | Carl Wilhelm Scheele (1771) | ||||||||||||||||||||
| Poimenoval po | Antoine Lavoisier (1777) | ||||||||||||||||||||
| Najpomembnejši izotopi kisika | |||||||||||||||||||||
| |||||||||||||||||||||
Kisík je kemijski element s simbolom O in atomskim številom 8. V periodnem sistemu elementov spada med halkogene elemente. Je zelo reaktivna nekovina in oksidant, ki se zlahka spaja z večino elementov in z njimi tvori okside.[2] V Vesolju je za vodikom in helijem po masi tretji najpogostejši element.[3] Pri standardni temperaturi in tlaku (STP) sta dva atoma kisika vezana v dikisik O2, ki je brezbarven plin brez vonja in okusa.
Veliko glavnih razredov organskih spojin v živih organizmih, na primer proteini, nukleinske kisline, ogljikovi hidrati in maščobe, vsebujejo tudi kisik. Prisoten je tudi v anorganskih delih organizmov, na primer v lupinah školjk in polžev ter v kosteh in zobeh. Večino mase živih organizmov sestavlja voda, v kateri sta vezana kisik in vodik (voda tvori približno dve tretjini človekove telesne mase). Kisik iz ozračja in vode je potreben za dihanje in ohranitev skoraj vsega življenja na Zemlji. Porabljeni kisik se stalno obnavlja s fotosintezo v živih organizmih, v kateri nastaja kisik iz vode s pomočjo sončne svetlobe. Elementarni kisik proizvajajo cianobakterije, alge in zelene rastline, vsa živa bitja pa ga porabljajo za celično dihanje. Za anaerobne organizme, ki so prevladovali na Zemlji preden se je v ozračju začel kopičiti kisik, je strupen. Kopičenje kisika se je začelo med tako imenovano kisikovo katastrofo pred približno 2,3 milijarde let.[4][5] Dvoatomni kisik tvori 20,8 % volumna zraka.[6] V raznih oksidih je najbolj pogost element v Zemljini skorji, saj samo silicijev dioksid tvori skoraj polovico njene mase.[7]
Druga alotropna oblika kisika je ozon O3, ki v višjih slojih ozračja tvori tako imenovani ozonski plašč, ki močno absorbira ultravijolično valovanje in s tem ščiti življenje na Zemlji. Ob Zemljini površini je onesnaževalec in stranski proizvod smoga. V nizkozemeljski orbiti med 160 in 2.000 km od Zemljine površine so znatne količine elementarnega kisika, ki povzroča korozijo vesoljskih plovil.[8]
Kisik se industrijsko proizvaja s frakcionirno destilacijo utekočinjenega zraka, elektrolizo vode in drugimi postopki. V elementarni obliki se uporablja v proizvodnji jekla in plastike, za varjenje in rezanje jekla in drugih kovin, pogon vesoljskih plovil, v kisikovi terapiji in sistemih za vzdrževanje življenja v letalih, podmornicah, vesoljskih plovilih ter pri potapljanju.
Kisik sta neodvisno eden od drugega odkrila Carl Wilhelm Scheele v Uppsali leta 1773 ali že prej in Joseph Priestley v Wiltshiru leta 1774. Odkritje se pogosteje pripisuje Priestleyu, ker ga je prvi objavil. Ime kisik je leta 1777 skoval Antoine Lavoisier,[9] čigar poskusi s kisikom so pripomogli ovreči takrat veljavno flogistonsko teorijo gorenja in korozije. Ime je sestavljeno iz grških besed ὀξύς, oksis, 'kisel, oster', ki se nanaša na kisel okus kislin, in starogrško -γενής [genés] – tvorec, dobesedno roditelj. V času njegovega poimenovanja so napačno predpostavljali, da morajo vse kisline vsebovati kisik.
Značilnosti[uredi | uredi kodo]
Zgradba[uredi | uredi kodo]


Pri standardni temperaturi in tlaku je brezbarven plin z molekulsko formulo O2, v katerem sta dva atoma kisika kemijsko vezana s spinsko tripletno elektronsko konfiguracijo. Vez spada med vezi drugega reda, njen opis pa se pogosto poenostavi in se govori o dvojni vezi[10] oziroma kombinaciji ene dvoelektronske in dveh troelektronskih vezi.[11]
Tripletni kisik, ki se ne sme zamenjavati z ozonom O3, je osnovno stanje molekule O2.[12] Elektronska konfiguracija molekule ima dva neparna elektrona, ki zasedata dve degenerirani molekularni orbitali. Orbitali sta klasificirani kot antivezni (oslabita red vezi s tri na dva), zato je vez šibkejša od trojne vezi v dvoatomnem dušiku, v kateri so zapolnjene vse tri vezne molekularne orbitale, nekaj antiveznih pa ne.[12]
Molekula O2 je v normalni tripletni obliki paramagnetna. To pomeni, da zaradi spinskih magnetnih momentov neparnih elektronov v molekuli in negativne izmenjalne energije med sosednjima molekulama O2 v magnetnem polju tvori magnet.[13] Magnet je dovolj močan, da mostiček tekočega kisika med poloma močnega magneta vzdrži lastno težo.[14]

Singletni kisik je naziv več visokoenergijskih oblik molekularnega O2, v katerih so vsi elektronski spini parni. Te oblike so mnogo bolj reaktivne do organskih molekul kot običajne. Singletni kisik nastaja iz vode med fotosintezo s pomočjo energije iz sončne svetlobe.[15] Nastaja tudi v troposferi s fotolizo ozona s kratkovalovno svetlobo[16] in imunskem sistemu kot vir aktivnega kisika.[17] Karotenoidi v fotosintetizirajočih organizmih, morda tudi v živalskih, igrajo pomembno vlogo pri absorbiranju energije iz singletnega kisika in njegovem pretvarjanju v nevzbujeno osnovno stanje, preden bi lahko poškodovala tkiva.[18]
Alotropi[uredi | uredi kodo]
Običajna alotropna oblika kisika na Zemlji je dikisik O2. Vez med atomoma je dolga 121 pm, standardna tvorbena entalpija vezi pa znaša 498 kJ•mol−1.[19] To obliko kisika potrebujejo aerobni organizmi za celično dihanje. Dikisik tvori približno petino Zemljinega ozračja.
Trikisik O3, bolj znan kot ozon, je zelo reaktiven alotrop kisika, ki lahko poškoduje tkivo pljuč.[20] Nastaja v gornjih plasteh ozračja v reakciji med O2 in atomarnim kisikom, ki nastaja s cepitvijo O2 z ultravijoličnim sevanjem.[9] Ozon močno absorbira svetlobo v UV delu spektra, zato ozonski plašč deluje kot Zemljin ščit pred nevarnim sevanjem.[9] Ob Zemljini površini je ozon onesnaževalec, ki nastaja kot stranski proizvod v avtomobilskih motorjih.[20]
Leta 2001 so odkrili metastabilni alotrop tetrakisik O4,[21][22] za katerega se domneva, da obstaja v eni od šestih faz trdnega kisika. Leta 2006 so dokazali, da je ta faza, ki nastane s komprimiranjem O2 na 20 GPa, v resnici klaster rombeodričnega O8.[23] Klaster bi lahko bil še močnejši oksidant, kot sta kisik in ozon, in bi se zato lahko uporabil za raketno gorivo.[21][22]
Leta 1990 so odkrili tudi kovinski kisik, ki nastane pri tlakih nad 96 GPa.[24] Leta 1998 so dokazali, da postane ta faza pri zelo nizkih temperaturah superprevodna.[25]
Fizikalne lastnosti[uredi | uredi kodo]
Kisik je bolj topen v vodi od dušika. V ravnotežnem stanju med vodo in zrakom je razmerje molekul kisika in dušika v vodi približno 1:2, medtem ko je v zraku približno 1:4. Topnost je odvisna od temperature in je pri 0 °C skoraj dvakrat večja kot pri 20 °C (14,6 mg•L−1 v primerjavi s 7,6 mg•L−1).[26][27] Pri 25 °C in 1 standardni atmosferi (101,3 kPa) vsebuje sladka voda približno 6,04 mL kisika na liter. Slana voda vsebuje pri istih pogojih 4,95 mL kisika na liter.[28] Z ohlajanjem na 5 °C topnost v sladki vodi naraste na 9,0 mL na liter (za več kot 50 %), v slani vodi pa na 7,2 mL/L (več kot 45 %).
Kisik se utekočini pri 90,20 K (−182.95 °C) in zmrzne pri 54,36 K (−218.79 °C).[29] Tekoči in trdni O2 sta prozorni snovi sinje barve, ki nastane zaradi absorpcije svetlobe v rdečem delu vidnega dela spektra. Pojav se razlikuje od modre barve neba, ki je posledica Rayleighovega sipanja svetlobe. Zelo čist tekoči kisik se običajno pridobiva s frakcionirno destilacijo utekočinjenega zraka [30] ali s kondenziranjem iz zraka s tekočim dušikom kot hladilnim sredstvom. Tekoč kisik je zelo reaktiven in se mora skladiščiti ločeno od vnetljivih snovi.[31]
Izotopi in zvezdno poreklo[uredi | uredi kodo]

V naravi je kisik sestavljen iz treh stabilnih izotopov: 16O, 17O in 18O. Najpogostejši je 16O (99,762 %).[32]
Večina kisika 16O nastaja v masivnih zvezdah na koncu procesov zlivanja helija, nekaj pa v procesih zgorevanja neona.[33] Izotop 17O nastaja predvsem z zgorevanjem vodika v helij v ciklu ogljik-dušik-kisik (CNO) in je zato v zvezdah pogost v coni zgorevanja vodika.[33] Večina 18O nastaja v procesu spajanja 14N v ciklu CNO z jedri 4He2+
. Izotop 18O je zato pogost v s helijem bogatih conah razvijajočih se masivnih zvezd.[33]
Kisik ima poleg stabilnih še 14 radioaktivnih izotopov. Najbolj stabilna sta 15O z razpolovnim časom 122,24 s in 14O z razpolovnim časom 70,606 s.[32] Vsi ostali radioaktivni izotopi imajo razpolovne čase krajše od 27 s, večina pa krajše od 83 ms. [32] Najbolj pogost način razpada izotopov, lažjih od 16O, je β+ razpad,[34][35][36] v katerem nastaja dušik. Najbolj pogost način razpada izotopov, težjih od 18O, je β razpad, v katerem nastaja fluor.[32]
Nahajališča[uredi | uredi kodo]
| Z | Element | Masni delež v ppm | ||
|---|---|---|---|---|
| 1 | Vodik | 739.000 | 71 × masa kisika | |
| 2 | Helij | 240.000 | 23 × masa kisika | |
| 8 | Kisik | 10.400 | ||
| 6 | Ogljik | 4.600 | ||
| 10 | Neon | 1.340 | ||
| 26 | Železo | 1.090 | ||
| 7 | Dušik | 960 | ||
| 14 | Silicij | 650 | ||
| 12 | Magnezij | 580 | ||
| 16 | Žveplo | 440 | ||
Kisik je najpogostejši kemijski element v Zemljini biosferi, atmosferi, hidrosferi in litosferi in za vodikom ter helijem tretji najpogostejši element v Vesolju.[3] Predstavlja tudi približno 0,9 % mase Sonca.[6] V Zemljini skorji ga je 49,2 utežnih %,[7] v oceanih pa 88,8 utežnih %.[6] V Zemljinem ozračju je z 20,8 volumskimi % oziroma 23,1 utežnimi % drugi najpogostejši element. Njegova skupna masa znaša 1015 ton.[6][38]

Zemlja se po tem značilno razlikuje od drugih planetov v Osončju, saj je v Marsovi atmosferi komaj 0,1 % kisika, v Venerini pa še mnogo manj. Kisik na teh planetih nastaja izključno pod vplivom ultravijolične svetlobe na molekule, ki vsebujejo kisik, na primer ogljikov dioksid (CO2).
Nenavadno visoka vsebnost kisika v Zemljini atmosferi je rezultat kisikovega kroga. Ta biogeokemijski krog opisuje gibanje kisika med tremi največjimi rezervoarji kisika na Zemlji: atmosfero, biosfero in litosfero. Glavna gonilna sila kisikovega kroga je fotosinteza. Med fotosintezo se v vodo in ozračje sprošča kisik, ki se z dihanjem in razpadanjem porablja. V trenutnem ravnotežju se obrne približno 1/2000 celotnega atmosferskega kisika letno.
Prost kisik je tudi v vodi. Dejstvo, da njegova topnost s padajočo temperaturo raste, pomembno vpliva na življenje v oceanih: v polarnih oceanih je zaradi višje vsebnosti kisika tudi veliko več življenja.[39] Gnojila za rastline, na primer nitrati in fosfati, ki onesnažijo vodo, lahko povzročijo prekomerno rast alg, tako imenovano cvetenje morja. Po njihovem odmrtju se zaradi razpadanja prekomerno zniža vsebnosti kisika v vodi. Kakovost vode se v tem pogledu spremlja z merjenjem biokemijske potrebe po kisiku, se pravi količine kisika, ki je potrebna za vzpostavitev njegove normalne koncentracije.[40]
Analize[uredi | uredi kodo]
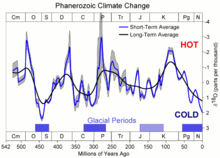
Paleoklimatologi merijo razmerje med 18O in 16O v školjkah in okostjih morskih organizmov, s katerim ugotavljajo, kakšni so bili klimatski pogoji v preteklosti. Molekule vode, ki vsebujejo lažji izotop 16O, izparevajo rahlo hitreje od molekul z 12 % težjim izotopom 18O. S padanjem temperature se razlika veča.[41] V obdobjih z nižjo globalno temperaturo je bilo zato v dežju in snegu več 16O, v morju pa je ostalo več 18O. Morski organizmi so zato v hladnih obdobjih v svoja okostja in lupine vgrajevali več 18O kot v toplih obdobjih.[41] Paleoklimatologi merijo razmerje med izotopoma tudi v do več sto tisoč let starih skladih ledu.
Planetarni geologi so izmerili vsebnost kisikovih izotopov v vzorcih z Zemlje, Lune, Marsa in meteoritov. Ker dolgo časa niso mogli dobiti referenčnih vrednosti za razmerje izotopov na Soncu, so predpostavili, da je razmerje enako kot v prvobitni solarni meglici. Analize silicijevih rezin, ki so bile v vesolju izpostavljene sončnemu vetru in jih je na Zemljo pripeljalo poškodovano vesoljsko vozilo Genesis, so pokazale, da je razmerje med izotopoma na Soncu večje kot na Zemlji. Meritve kažejo, da se je 16O iz Sončevega protoplanetarnega diska porabil v nekem neznanem procesu pred združitvijo prašnih delcev, iz katerih je nastala Zemlja.[42]
Kisikov absorpcijski spekter ima vrhova pri valovnih dolžinah 687 in 760 nm. Nekaj znanstvenikov je zato predlagalo, da bi se z merjenjem intenzivnosti sevanja gozdnih površin pri teh valovnih dolžinah na satelitih lahko ugotavljalo njihovo zdravstveno stanje.[43] Ideja temelji na dejstvu, da je pri teh valovnih dolžinah mogoče razlikovati odboj od mnogo šibkejše fluorescence. Meritve so tehnično težavne zaradi majhnega razmerja med signalom in šumom ter fizične strukture vegetacije. S predlagano metodo bi se s satelitov morda lahko opazovalo tudi globalno kroženje ogljika.
Biološka vloga kisika[uredi | uredi kodo]
Fotosinteza in dihanje[uredi | uredi kodo]

2, CO
2 iz zraka pa se pretvarja v sladkor, ki je v resnici stranski produkt sinteze adenozin trifosfata (ATP) in nikotinamid adenin dinukleotid fosfata (NADPH)
V naravi nastaja kisik z razgradnjo vode s fotosintezo. Po nekaterih ocenah proizvedejo alge in cianobakterije približno 70 % kisika, drug del pa zelene rastline na kopnem.[44] Po drugih ocenah je delež morskih organizmov še večji, po tretjih pa manjši in znaša samo približno 45 %.[45]
Poenostavljena splošna kemijska enačba za fotosintezo je[46]
- 6 CO2 + 6 H2O + fotoni → C6H12O6 + 6 O2
ali enostavneje:
- ogljikov dioksid + voda + sončna svetloba → glukoza + kisik
Fotolitsko nastajanje kisika poteka v tilakoidnih membranah fotosinteznih organizmov in porabi energijo štirih fotonov. Reakcija poteka v več korakih.[47] Nastali kisik se sprošča v ozračje.
Molekularni O2 je bistven za celično dihanje vseh aerobnih organizmov. Kisik se porablja v mitohondriju za sintezo adenozin trifosfata (ATP) z oksidativno fosforilacijo. Aerobno dihanje je nekakšna povratna reakcija fotosinteze in se v poenostavljeni obliki zapiše z enačbo:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2880 kJ•mol−1
V vretenčarjih prodira kisik v organizem skozi pljučne membrane v rdeče krvničke. V njih se veže na hemoglobin in spremeni njegovo barvo iz modrikasto rdeče v svetlo rdečo.[20] Istočasno se iz drugega dela hemoglobina odceplja ogljikov dioksid. Druge živali namesto hemoglobina uporabljajo hemocianin (mehkužci in nekateri členonožci) ali hemeritrin (pajki in raki).[38] V litru krvi se lahko veže 200 ml O2.[38]
Reaktivne kisikove spojine, na primer peroksidni ion (O2-) in vodikov peroksid (H2O2) so nevarni stranski produkti rabe kisika v organizmih.[38] Deli imunskega sistema višjih organizmov po drugi strani sami tvorijo perokside, perkisikove ione in singletni kisik za uničevanje invazivnih mikrobov. Reaktivne kisikove spojine igrajo pomembno vlogo tudi v hipersenzitivnem odzivu rastlin na napade patogenov.[47]
Odrasel človek vdihne 1,8 – 2,4 g kisika oziroma 6-8 L zraka na minuto.[48] Človeštvo porabi za dihanje več kot šest milijard ton kisika letno.
Vsebnost kisika v telesu[uredi | uredi kodo]
| Enota | Alveolarni tlak | Arterialni kisik | Venski kisik |
|---|---|---|---|
| kPa | 14,2 | 11[49]-13[49] | 4,0[49]-5,3[49] |
| mmHg | 107 | 75[50]-100[50] | 30[51]-40[51] |
Parcialni tlak prostega kisika v telesih živih organizmov je najvišji v dihalih in po arterijah pada. Najnižji je v perifernih tkivih in venah.[52]
Vsebnost kisika v atmosferi[uredi | uredi kodo]

1) atmosfera je brez kisika
2) atmosfera je še brez kisika; ves nastajajoči kisik se kopičiti v oceanih in kamninah na morskem dnu
3) kisik začne izparevati iz oceanov in se začne kopičiti na kopnem; nastajanje ozonskega plašča
4-5) ponori kisika so zapolnjeni in kisik se začne kopičiti v atmosferi
V Zemljini atmosferi ni bilo prostega kisika, dokler se niso, verjetno pred približno 3,5 milijarde let, razvile arheje in bakterije. Znatne količine prostega kisika so prvič nastale v paleoproterozoiku pred 3,0 do 2,3 milijarde let.[53] Naslednjo milijardo let se je ves nastajajoč kisik vezal z železom, raztopljenim v oceanih, in tvoril slojevite železove okside. Ko se je ta ponor kisika nasitil, je pred 3,0 do 2,7 milijarde let začel kisik izparevati iz oceanov in pred približno 1,7 milijarde let dosegel 10 % svoje sedanje količine.[53][54]

Prisotnost velikih količin raztopljenega in prostega kisika v oceanih in atmosferi je med tako imenovano kisikovo katastrofo pred približno 2,4 milijarde let verjetno povzročila izumrtje večine anaerobnih organizmov. Celično dihanje, ki uporablja kisik, je omogočilo aerobnim organizmom, da proizvedejo mnogo več ATP kot anaerobni organizmi, kar je pripomoglo k njihovi kasnejši prevladi v Zemljini biosferi.[55] Celično dihanje kisika poteka v vseh evkariontih, vključno z vsemi kompleksnimi mnogoceličnimi organizmi kot so rastline in živali.
Od začetka kambrija pred 542 milijoni let je vsebnost kisika v atmosferi nihala od 15 do 30 volumskih %.[56] Proti koncu karbona pred približno 300 milijoni let je vsebnost kisika v ozračju dosegla svoj višek 35 vol %,[56] kar je morda pripomoglo k razvoju ogromnih žuželk in dvoživk.[57] Človeške dejavnosti, med katere spada tudi sežig 7 milijard ton fosilnih goriv letno, ima po mnenju nekaterih zelo majhen vpliv na vsebnost prostega kisika v ozračju.[13] Pri sedanji hitrosti fotosinteze se celotna količina kisika v ozračju obnovi v približno 2.000 letih.[58]
Zgodovina[uredi | uredi kodo]
Prvi poskusi[uredi | uredi kodo]
Enega od prvih preskusov v zvezi z gorenjem in zrakom je v 2. stoletju pr. n. št. izvedel grški pisec in mehanik Filon iz Bizanca. V svojem delu Pneumatica je opisal poskus, v katerem je gorečo svečo pokril z navzdol obrnjeno steklenico in jo postavil v posodo z vodo. Med gorenjem sveče se je nekaj vode dvignilo v vrat steklenice.[59] Filon je napačno domneval, da se je del zraka pretvoril v klasični element ogenj in ušel skozi pore v steklu. Več stoletij kasneje je Leonardo da Vinci na podlagi Filonovega poskusa zaključil, da se med gorenjem in dihanjem porablja zrak.[60]
V poznem 17. stoletju je Robert Boyle dokazal, da je za gorenje potreben zrak. Angleški kemik John Mayow (1641-1679) je njegovo ugotovitev dodelal z dokazom, da je za gorenje potreben samo del zraka, ki ga je imenoval spiritus nitroaereus ali krajše nitroaereus.[61] V enem od poskusov je v posodo, poveznjeno v vodo, zaprl miš, v drugem pa prižgal svečo. Ugotovil je, da se voda v obeh poskusih dvigne in zasede 1/14 zračnega volumna zraka pred poskusom,[62] in zaključil, da se nitroaereus porablja tako pri dihanju kot pri gorenju.
Mayow je opazil tudi to, da se masa antimona med segrevanjem poveča in pravilno zaključil, da se pri tem spaja z nitroaereusom.[61] Domneval je tudi, da pljuča izločijo nitroaereus iz zraka in ga prenesejo v kri in da sta telesna toplota in gibanje mišic rezultat kemijske reakcije določenih snovi v telesu z nitroaereusom.[61] Rezultate poskusov in svoje zaključke in ideje je objavil leta 1668 v svojem delu Tractatus duo (Drugi traktat) v poglavju De respiratione (Dihanje).[62]
Flogistonska teorija[uredi | uredi kodo]

Robert Hooke, Ole Borch, Mihail Lomonosov in Pierre Bayen so v 17. in 18. stoletju med svojimi poskusi proizvedli kisik, vendar ga ni nobeden prepoznal kot kemijski element.[20] To je bilo verjetno posledica prevladujoče filozofije gorenja in korozije, imenovane flogistonska teorija, s katero so poskušali pojasniti oba procesa.
Flogistonsko teorijo je leta 1667 postavil nemški alkimst Johann Joachim Becher. Teorijo je do leta 1731 dodelal nemški kemik, zdravnik in filozof Georg Ernst Stahl.[63] Flogistonska teorija je trdila, da so vse gorljive snovi zgrajene iz dveh delov: prvi del, imenovan flogiston, se med gorenjem odcepi, drugi del, imenovan deflogistonirana snov, pa je prava oblika snovi ali calx (apno).[60] Zelo gorljive snovi, ki pustijo po gorenju malo ostanka, na primer les in oglje, naj bi bile sestavljene pretežno iz flogistona. Snovi, ki korodirajo, na primer železo, naj bi imele zelo malo flogistona. Zrak v flogistonski teoriji ni igral nobene vloge. Poskusov ni nihče niti poskusil kvantificirati in so temeljili samo na opažanju, da večina snovi med gorenjem postaja lažja in da se med procesom del snovi izgubi.[60] Dejstvo, da snovi, na primer les, pravzaprav povečajo svojo maso, je prikrila hlapnost plinskih produktov gorenja. Eden od prvih dokazov, da flogistonska teorija ne drži, so bile kovine, ki med rjavenjem postajajo težje, čeprav bi po flogistonski teoriji morale postati lažje.
Odkritje[uredi | uredi kodo]



Kisik je prvi odkril švedski farmacevt Carl Wilhelm Scheele okoli leta 1772 s segrevanjem živosrebrovega(II) oksida (HgO) in različnih nitratov.[6][60] Plin je poimenoval ognjeni plin, ker je bil edini plin, ki je pospeševal gorenje. Svoje odkritje je opisal v Razpravi o zraku in ognju, katero je leta 1775 v rokopisu poslal svojemu založniku. Rokopis je pri njem čakal na objavo vse do leta 1777.[64]
Medtem je britanski teolog in kemik Joseph Priestley 1. avgusta 1774 izvedel poskus, v katerem je usmeril sončno svetlobo na živosrebrov(II) oksid v stekleni cevki. Med poskusom se je sprostil plin, ki ga je poimenoval deflogistonirani zrak.[6] Opazil je, da v njem sveča gori bolj živahno in da je miš v njem bolj živahna in živi dlje. Ko je plin vdihnil, je zapisal: »Občutek v mojih pljučih ni bil občutno drugačen kot pri dihanju zraka, dihanje pa je bilo zatem nekaj časa občutno lažje in bolj mirno«.[20] Prestley je svoje odkritje objavil v članku z naslovom Poročilo o novih odkritjih v zraku, katerega je kasneje vključil v drugi zvezek svoje knjige Poskusi in opazovanja različnih vrst zraka.[60][65] Svoje odkritje je objavil pred Scheelejem, zato se pogosto njemu pripisuje odkritje kisika.
Slavni francoski kemik Antoine Laurent Lavoisier je kasneje trdil, da je tudi on neodvisno od njiju odkril kisik. Njegova trditev je sporna, ker je Priestley oktobra 1774 obiskal Lavoisiera in mu opisal svoj poskus, 30. septembra 1774 pa mu je svoje odkritje neznane snovi v pismu opisal tudi Scheele. Lavoisier ni nikoli priznal, da je pismo prejel, kopijo pisma pa so po Scheelejevi smrti našli v njegovi zapuščini.[64]
Lavoisierov prispevek[uredi | uredi kodo]
Lavoisierov nesporen prispevek k razvoju kemije, ki je bil v njegovem času sporen, je bila uvedba tehtanja v poskuse z gorenjem in prva prava razlaga, kako gorenje poteka.[6] Te in podobne poskuse je začel opravljati leta 1774, da bi ovrgel flogistonsko teorijo in dokazal, da je snov, ki sta jo odkrila Scheele in Priestley, kemijski element.
S poskusom je dokazal, da se med segrevanjem kositra in zraka v zaprti posodi njuna skupna masa ne spremeni. Opazil je tudi, da je potem, ko je posodo odprl, vanjo vdrl zrak, iz česar je sklepal, da se je del zaprtega zraka porabil. S tehtanjem je ugotovil, da se je masa kositra med poskusom povečala in da je bila razlika v masi enaka masi vdrtega zraka. Svoje poskuse z gorenjem je opisal v knjigi Sur la combustion en général (O gorenju na splošno), ki jo je objavil leta 1777.[6] S svojim delom je dokazal, da je zrak zmes dveh plinov: vitalnega zraka, ki je pomemben za gorenje in dihanje, in azota (iz grškega starogrško ἄζωτον [azoton] – brez življenja, ki ni pomemben niti za gorenje niti za dihanje. Azot so kasneje preimenovali v dušik, v nekaterih jezikih pa se je njegovo izvirno ime ohranilo.[6]
Lavoisier je leta 1777 vitalni zrak preimenoval v oxygène (iz grškega starogrško ὀξύς [oxys] – kisel, dobesedno oster zaradi takšnega okusa kislin, in starogrško -γενής (-genēs) – tvorec, dobesedno roditelj, ker je zmotno domneval, da je kisik prisoten v vseh kislinah.[9] Kemiki, predvsem Humphry Davy leta 1812, so kasneje ugotovili, da je bila Lavoisierova domneva napačna in da je osnovni element v vseh kislinah vodik. Za spremembo imena je bilo takrat že prepozno in ime se je obdržalo.
Kasnejša zgodovina[uredi | uredi kodo]
Daltonova izvirna atomska hipoteza je predpostavljala, da so vsi elementi enoatomni in da imajo atomi v molekulah najenostavnejša možna razmerja. Dalton je na primer predpostavil, da ima voda formulo HO, kar je pomenilo, da je atomska masa kisika 8 krat večja od vodikove (v resnici je približno 16 krat večja).[66] Leta 1805 sta Joseph Louis Gay-Lussac in Alexander von Humboldt dokazala, da je voda sestavljena iz dveh volumskih delov vodika in enega volumskega dela kisika. Pravilno sestavo vode je leta 1811 ugotovil Amedeo Avogadro. Njegova ugotovitev je temeljila na predpostavki, da imata elementa dvoatomne molekule, in zakonu, ki se po njem imenuje Avogadrov zakon.[67]

Do poznega 19. stoletja so znanstveniki ugotovili, da se s stiskanjem in ohlajanjem zrak lahko utekočini in loči na svoje komponente. Švicarski kemik in fizik Raoul Pierre Pictet je s kaskadno metodo izparil tekoči žveplov dioksid, da bi z njim utekočinil ogljikov dioksid in z njegovim izparevanjem dovolj ohladil plinast kisik, da bi se utekočinil. Pictetu je poskus uspel in 22. decembra 1877 je s telegramom obvestil Francosko akademijo znanosti o svojem odkritju tekočega kisika.[68] Samo dva dni kasneje je francoski fizik Louis Paul Cailletet objavil svojo metodo za utekočinjanje kisika.[68] Oba odkritelja sta pridobila samo nekaj kapljic tekočega plina, na katerih se ni dalo opraviti nobene pomembne analize. Utekočinjen kisik v stabilnem stanju sta 29. marca 1883 prva pridobila poljska znanstvenika Zygmunt Wróblewski in Karol Olszewski z Jagelonske univerze v Krakovu.[69]
Leta 1881 je škotski kemik James Dewar uspel pridobiti dovolj tekočega kisika, da so ga lahko začeli preučevati.[13] Prvi gospodarsko pomemben postopek za utekočinjanje kisika sta leta 1895 neodvisno eden od drugega odkrila nemški inženir Carl von Linde in britanski inženir William Hampson. Oba odkritelja sta zniževanjem temperature utekočinila zrak, katerega sta zatem s frakcionirno destilacijo in ponovnim utekočinjenjem ločila na njegove komponenete.[70]
Leta 1901 so prvič prikazali avtogeno varjenje z zmesjo acetilena in komprimiranega kisika. Avtogeno varjenje in rezanje je kmalu zatem prišlo v široko rabo.[70]
Leta 1923 je ameriški znanstvenik Robert Hutchings Goddard prvi razvil raketni motor na tekoče gorivo, ki sta ga poganjala bencin in tekoč kisik. Majhna raketa z njegovim motorjem je prvič poletela 16. marca 1926 v Auburnu, Massachusetts, ZDA. Dosegla je hitrost 97 km/h in poletela 56 m visoko.[70][71]
Industrijska proizvodnja[uredi | uredi kodo]
Največ kisika, približno 100 milijonov ton letno,[64] se proizvede iz zraka. Najpogostejši postopek je frakcionirna destilacija utekočinjenega zraka, v kateri dušik izpari, kisik pa ostane v tekočem stanju.[64]

Drug pomemben postopek za proizvodnjo plinastega kisika je adsorpcija dušika iz suhega zraka na zeolitskem molekularnem situ, ki prepušča plin z 90-93 vol % kisika.[64] V proces sta vključeni dve vzporedni siti: medtem ko prvo sito obratuje, se drugo (nasičeno) regenerira, tako da se v njem zniža delovni tlak, nazadnje pa se še protitočno prepiha s kisikom. Po regeneraciji se vlogi sit zamenjata. Takšen način delovanja zagotavlja stalno in dokaj enakomerno proizvodnjo kisika. Po tem nekriogenem postopku in sorodni vakuumski adsorpciji se proizvaja vedno večje količine kisika.[72]
Plinast kisik se lahko proizvaja tudi z elektrolizo nakisane vode, katere stranski proizvod je vodik. Anodni in katodni prostor morata biti ločena, ker se sicer plina pomešata v zelo eksploziven vodikov pokalni plin. Razmerje volumnov plinov 2:1 v nasprotju s splošnim prepričanjem ne dokazuje, da je kemijska formula vode H2O, dokler se ne upošteva molekulskih formul obeh plinov. Kisik se lahko na podoben način proizvaja tudi z elektrokatalizo oksidov in oksi kislin. V kemičnih generatorjih kisika in kisikovih svečah, ki se uporabljajo v podmornicah in v komercialnih letalih med dekompresijo potniškega prostora, se uporabljajo tudi kemični katalizatorji. Ena od tehnologij za pridobivanja kisika je prisilno raztapljanje dušika s prepihavanjem zraka skozi keramične membrane iz cirkonijevega oksida pod visokim tlakom ali z električnim tokom, ki daje skoraj čist kisik.[40]
Skladiščenje[uredi | uredi kodo]
Iz litra tekočega kisika se pri 20 °C in atmosferskem tlaku razvije 840 litrov plinastega kisika, zato je bolj gospodarno njegovo skladiščenje in transportiranje v tekočem stanju v ustreznih toplotno izoliranih cisternah.[6] Tekoč kisik se pred uporabo uplini v toplotnih izmenjevalcih. V komprimiranem stanju se skladišči tudi v manjših jeklenkah, ki so bolj primerne za transport in se uporabljajo na primer za avtogeno varjenje in rezanje.[73]
Uporaba[uredi | uredi kodo]
Medicina[uredi | uredi kodo]

V medicini se uporablja s kisikom obogaten zrak za dihanje, ki poveča raven kisika v bolnikovi krvi, pri mnogih boleznih pljuč pa poleg tega zmanjša upor pretoka krvi in s tem obremenitev srca. Kisikova terapija se uporablja za zdravljenje kronične obstruktivne pljučne bolezni, pljučnice, nekaterih motenj delovanja srca, nekaterih motenj, ki dvignejo tlak v pljučni arteriji in vseh bolezni, ki zmanjšajo sposobnost organizma, da sprejema in uporablja kisik iz zraka.[73]
Zdravljenje je dovolj enostavno, da lahko poteka ne samo v bolnišnicah, ampak tudi na bolnikovem domu in v prevoznih sredstvih. Nekoč so se pogosto uporabljali kisikovi šotori, sedaj pa se uporabljajo večinoma kisikove maske ali nosne kanile.[74]
Hiperbarične (visokotlačne) komore s povečanim parcialnim tlakom kisika so dovolj velike za celega bolnika, včasih tudi za zdravstveno osebje.[75] V njih se lahko zdravijo zastrupitve z ogljikovim monoksidom, plinska gangrena in dekompresijska bolezen.[76] Povišana koncentracija kisika v pljučih olajša odstranjevanje ogljikovega monoksida iz hemoglobina.[77][78] Za anaerobne bakterije, ki povzročajo plinsko gangreno, je kisik strupen, zato povečan parcialni tlak kisika pripomore k njihovemu uničevanju.[79][80] Dekompresijsko bolezen povzroči prehitra dekompresija pri potapljanju, zaradi katere začnejo v krvi nastajati mehurčki inertnih plinov, predvsem dušika in helija. Del zdravljenja poteka s povečanjem parcialnega tlaka kisika, po možnosti takoj po končanem potopu.[73][81][82]
Kisik se v medicini uporablja tudi za bolnike, ki potrebujejo mehansko ventilacijo. Koncentracija kisika v teh primerih pogosto presega običajnih 21 vol %, kakršna je v okolju.
Ohrajanje življenja in rekreacija[uredi | uredi kodo]

Skoraj čist kisik s približno tretjino normalnega tlaka se uporablja kot dihalni plin v vesoljskih skafandrih.[83][84] Nižji tlak je potreben za ohranitev elastičnosti skafandra, ustrezno višja koncentracija kisika pa za vzdrževanje normalnega parcialnega tlaka kisika v krvnem obtoku.
Potapljači in podmorničarji so odvisni od umetno dovedenega kisika. Najpogosteje uporabljajo zrak in/ali s kisikom obogaten zrak. Uporaba čistega ali skoraj čistega kisika med potapljanjem je omejena samo na izolacijske dihalne aparate, dekompresijo in prvo pomoč pri relativno majhnih globinah do največ šest metrov.[85][86] Za potapljanje v večje globine se mora kisik znatno razredčiti z inertnimi plini, na primer z dušikom ali helijem, da se prepreči zastrupitev s kisikom. [85]
Alpinisti in letalci v letalih z nekontroliranim tlakom v pilotskem prostoru, se včasih dodatno oskrbujejo s kisikom. V komercialnih letalih s kontroliranim tlakom v potniškem prostoru se pri padcu tlaka avtomatsko vklopijo kemični generatorji kisika nad vsakim sedežem, ki istočasno izvržejo maske za dihanje. Poteg maske potisne železove opilke v posodo z natrijevim kloratom in sproži razvijanje kisika. Kasnejši enakomerni dotok kisika proizvaja eksotermna reakcija.[40]
Kisik, za katerega so domnevali, da povzroča rahlo evforijo, so nekoč uporabljali za zabavo v kisikovih barih in v športu. Kisikove bare, v katerih je bil parcialni tlak kisika malo višji od normalnega, so si omislili na Japonskem, v Kaliforniji in Las Vegasu v poznih 1990. letih in za obisk zaračunavali vstopnino.[87] Profesionalni športniki, predvsem igralci ameriškega nogometa, so med čakanjem na klopi pogosto nosili kisikove maske za »krepitev učinkovitosti«. Farmakološki učinek dodatnega kisika je dvomljiv in gre verjetneje za učinek placeba.[87] Razpoložljive študije kažejo, da je vpliv kisika pozitiven samo med aerobnimi aktivnostmi.[88]
Industrija[uredi | uredi kodo]

55 % industrijsko proizvedenega kisika se porabi za predelavo železa v jeklo.[40] V tem procesu se v talino železa pod velikim tlakom vpihava kisik, ki pretvori žveplo in prebitek ogljika v žveplov (SO2) in ogljikov dioksid (CO2). Reakcija je eksotermna, zato temperatura naraste na 1.700 °C.[40]
25 % kisika se porabi v kemični industriji.[40] Uporablja se na primer za adicijo na eten, pri čemer nastane etilenoksid, ki se zatem s hidrolizo pretvori v etilenglikol. Etilenglikol je osnovna surovina za proizvodnjo na primer antifriza in poliestrov, iz katerih se proizvaja plastika in poliestrna vlakna.[40]
Okoli 20 % kisika se porabi v zdravstvu, za avtogeno varjenje in rezanje kovin in kot oksidant v raketnih motorjih in obdelavi pitne vode.[40] Plamen zmesi acetilena in kisika ima izredno visoko temperaturo in se z njim lahko reže do 60 cm debelo pločevino. Rezanje poteka tako, da se pločevino najprej segreje z acetilenskim plamenom, potem pa se začne vanjo vpihavati čist kisik.[89] Reakcija med kovino in kisikom je eksotermna in sprošča dovolj toplote za taljenje kovine.
Spojine[uredi | uredi kodo]

Najpogostejše oksidacijsko stanje kisika v večini znanih spojin je -2. V nekaterih spojinah, na primer peroksidih, je njegovo oksidacijsko stanje -1,[90] druga oksidacijska stanja pa so zelo redka: v superoksidih (O−
2) -1/2, v ozonidih (O−
3) −1/3, v elementarnem kisiku (O2) in hipofluorovi kislini (HOF) 0, v dioksigenilu (O+
3) +1/2, v dikisikovem difluoridu (O2F2) +1 in v kisikovem difluoridu (OF2) +2.
Oksidi in druge anorganske spojine[uredi | uredi kodo]
Najpogostejši in najbolj znan je vodikov oksid - voda. Vez med kisikom in vodikom je kovalentna, molekule vode pa so med seboj dodatno povezane z vodikovo vezjo med vodikom iz prve in kisikom iz druge molekule. Energija vodikove vezi je približno 23,3 kJ•mol−1 vodika.[91] Razdalje med molekulami vode so zato približno 15 % krajše od pričakovanih v tekočini s samo Van der Waalsovimi silami.[92]

Kisik se zaradi svoje elektronegativnosti pri povišani temperaturi veže s skoraj vsemi elementi in tvori pripadajoče okside. Nekateri elementi, na primer železo, se spajajo s kisikom že pri normalnih pogojih. Nekateri drugi elementi, na primer aluminij in titan, tvorijo na zraku na površini tanek pasivni sloj oksidov, ki upočasni nadaljnjo korozijo. Oksidi nekaterih prehodnih elementov, ki jih najdemo v naravi, so nestehiometrične spojine z nekaj manj kovine kot kaže kemijska formula. Takšen je na primer železov(II) oksid vustit s formulo Fe1−xO, pri čemer je x običajo okrog 0,05.[93]
V atmosferi je kisik v majhnih količinah kemično vezan v ogljikovem dioksidu (CO2). V kamninah v Zemljini skorji je veliko kisika vezanega v silicijevih oksidih, na primer v kremenu (SiO2), ki se pojavlja kot tak in v granitih, aluminijevem oksidu (Al2O3) v boksitu in korundu, železovem(III) oksidu (Fe2O3) v hematitu in rji ter kalcijevem (CaCO3) in magnezijevem karbonatu (MgCO3) v apnencih in dolomitih. Kisikove spojine sestavljajo tudi preostali del Zemljive skorje, predvsem kot različni kompleksni silikati v silikatnim mineralih. Zemljin plašč je sestavljen večinoma iz magnezijevih in železovih silikatov.
Vodotopni silikati Na4SiO4, Na2SiO3 in Na2Si2O5 se uporabljajo kot detergenti in lepila.[94]
V kompleksnih spojinah nastopa kisik kot ligand za prehodne kovine in tvori vezi kovina-O2. Na ta način se v Vaskovem kompleksu IrCl(CO)[P(C6H5)3]2 veže z iridijem,[95] v PtF6 s platino[96] in v hemu v hemoglobinu z železom.
Organske spojine in biomolekule[uredi | uredi kodo]


Najpomembnejši razredi organskih spojin s kisikom so (R- je organska skupina) so alkoholi (R-OH), etri (R-O-R), ketoni (R-CO-R), aldehidi (R-CO-H), karboksilne kisline (R-COOH), estri (R-COO-R), anhidridi kislin (R-CO-O-CO-R) in amidi (R-C(O)-N-R2). Kisik vsebujejo tudi mnoga pomembna organska topila, na primer aceton, metanol, etanol, izpropanol, furan, tetrahidrofuran (THF), dietileter (eter), dioksan, etil acetat, dimetilformamid (DMF), dimetilsulfoksid (DMSO) ter ocetna in mravljinčna kislina. Aceton ((CH3)2CO) in fenol (C6H5OH) sta surovini za sintezo mnogo drugih pomembnih spojin. Pomembne kisikove spojine so tudi glicerol, formaldehid, glutaraldehid, citronska kislina, acetanhidrid in acetamid. Epoksidi so etri, v katerih je kisik vključen v obroč s tremi atomi.
Kisik že pri sobni temperaturi ali celo pod njo spontano reagira s številnimi organskimi spojinami. Proces se imenuje avtooksidacija.[97] Večina kisikovih organskih spojin kljub temu ne nastane z neposredno kemično reakcijo kisika z organsko spojino. Med izjeme spadata na primer etilenoksid in peroksiocetna kislina.[94]
Kisik je v skoraj vseh biomolekulah, ki so pomembne za življenje ali nastajajo v živih organizmih. Brez kisika so samo nekatere redke kompleksne biomolekule, kot so skvalen in karoteni. Med biološko pomembne spojine s kisikom spadajo ogljikovi hidrati, ki imajo največjo vsebnost kisika, maščobe, maščobne kisline, amino kisline in beljakovine, ki imajo kisik vezan v karbonilnih skupinah (-COOH) in njihovih estrskih ostankih (-COO-R). Kisik vsebujejo tudi fosfatne skupine (-PO3 in -PO4) v biološko pomembnih molekulah adenozin trifosfata (ATP) in adenozin difosfata (ADP), ki sta nosilca energije, purini (razen adenina) in pirimidini v nukleinskih kislinah. V kosteh je vezan kot kalcijev karbonat, kalcijev fosfat in hidroksilapatit.
Varnost in varnostni ukrepi[uredi | uredi kodo]
Standard NFPA 704 uvršča komprimiran plinast kisik med zdravju nenevarne, nevnetljive in nereaktivne kemikalije, vendar med oksidante. Ohlajen tekoč kisik ima zaradi povečanega tveganja hiperoksije zaradi zgoščenih par in nevarnosti ozeblin oceno nevarnosti za zdravje 3, za ostale nevarnosti pa ima enake ocene kot komprimiran kisik.
Toksičnost[uredi | uredi kodo]

• Osrednji živčni sistem: božjastni napad
• Oči: zmanjšanje vidnega polja, skoraj popolna slepota, nastanek očesne mrene, krvavenje, fibroza
• Mišice: trzanje in zbadanje
• Dihala: sunkovito dihanje, razdraženost, kašljanje, bolečina, dispneja, vnetje sapnika in bronhijev, akutni respiratorni distresni sindrom
Kisik pri povečanem parcialnem tlaku lahko sproži mišične krče in druge zdravstvene težave.[85][99] Strupen postane pri koncentraciji približno 50 vol % oziroma parcialnem tlaku 50 kPa, ki je približno 2,5 krat višji od parcialnega tlaka kisika na morski gladini (21 kPa).
V preteklosti so prezgodaj rojene otroke namestili v inkubatorje s povečano koncentracijo kisika. Takšno prakso so opustili, ker je nekaj otrok zaradi previsoke koncentracije kisika oslepelo.[20]
Dihanje čistega kisika v vesolju, na primer v sodobnih vesoljskih skafandrih in prvih vesoljskih plovilih, na primer Apollo, zaradi nizkega parcialnega tlaka ni povzročilo nobenih zdravstvenih težav.[83][100] V skafandrih je parcialni tlak kisika za dihanje običajno okoli 30 kPa (1,4 krat višji od normalnega), tako da je njegov parcialni tlak v astronavtovi arterialni krvi samo neznatno višji od parcialnega tlaka na morski gladini.
Toksičen vpliv kisika na pljuča in osrednji živčni sistem se lahko pojavi tudi pri globokem potapljanju z dihalnim aparatom ali dovajajnem zraka z morske gladine.[20][85] Dolgotrajno dihanje plina s parcialnim tlakom kisika večjim od 60 kPa lahko v skrajnosti povzroči trajno pljučno fibrozo.[101] Izpostavljenost kisiku s parcialnim tlakom višjim od 160 kPa (približno 1,6 atm) lahko povzroči krče, ki so za potapljača običajno usodni. Akutne zastrupitve s kisikom so najpogostejše pri dihanju zračne mešanice z 21 vol % kisika pri globinah enakih ali večjih od 66 m. Enak učinek ima dihanje čistega kisika v globini 6 m.[101][102][103][104]
Požar in druge nevarnosti[uredi | uredi kodo]

Kisik kot tak ne gori, je pa močan oksidant in pospešuje gorenje.[105] Neposreden stik koncentriranega kisika in goriva lahko povzroči vžig ali eksplozijo, vendar je za to potrebna toplota ali iskra.[105] Močni oksidanti so tudi kisikove spojine z visokim oksidacijskim potencialom, na primer peroksidi, klorati, nitrati, perklorati in dikromati, ki med gorenjem sproščajo kisik.
Jeklene cevi in rezervoarji v stiku s plinastim ali tekočim kisikom postanejo potencialno gorivo, zato načrtovanje in izdelava sistemov za rokovanje s kisikom zahtevata posebno usposabljanje.[105] Požar, ki je bil 27. januarja 1967 usoden za posadko Apolla 1, se je tako hitro razširil zato, ker je bila kapsula napolnjena s čistim kisikom pod tlakom, rahlo višjim od atmosferskega tlaka, in ne z 1/3 normalnega tlaka, kakršen naj bi se uporabljal med letom.[106]
Razliti kisik, ki se vpije v organske snovi, na primer les, plastiko in asfalt, lahko zaradi kasnejšega udarca povzroči neprevidljivo eksplozijo.[105] Tekoči kisik je kriogena tekočina in pri stiku s kožo in očmi povzroči ozebline.
Sklici[uredi | uredi kodo]
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 0-8493-0464-4.
- ↑ WebElements: the periodic table on the web – Oxygen: electronegativities. WebElements.com. Pridobljeno 7. novembra 2011.
- ↑ 3,0 3,1 Emsley 2001, str. 297.
- ↑ NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago Arhivirano 2008-03-13 na Wayback Machine.. NASA. 27. september 2007. Pridobljeno 13. marca 2008.
- ↑ C. Zimmer (3. oktober 2013). Earth's Oxygen: A Mystery Easy to Take for Granted. New York Times. Pridobljeno 3. oktobra 2013.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 Cook & Lauer 1968, str. 500.
- ↑ 7,0 7,1 Oxygen. Los Alamos National Laboratory. Pridobljeno 16. decembra 2007.
- ↑ Atomic oxygen erosion. Pridobljeno 8. avgusta 2009.
- ↑ 9,0 9,1 9,2 9,3 G. D. Parks, J. W. Mellor (1939). Mellor's Modern Inorganic Chemistry (6. izdaja). London: Longmans, Green and Co.
- ↑ Molecular Orbital Theory. Purdue University. Pridobljeno 28. januarja 2008.
- ↑ L. Pauling (1960). The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry.3. izdaja. Ithaca, N.Y.: Cornell University Press. ISBN 0-8014-0333-2.
- ↑ 12,0 12,1 H. Jakubowski. Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen. Biochemistry Online. Saint John's University. Pridobljeno 28. januarja 2008.
- ↑ 13,0 13,1 13,2 Emsley 2001, str. 303.
- ↑ Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet. University of Wisconsin-Madison Chemistry Department Demonstration lab. Pridobljeno 15. decembra 2007.
- ↑ A. Krieger-Liszkay (13. oktober 2004). Singlet oxygen production in photosynthesis. Journal of Experimental Botanics (Oxford Journals) 56 (411): 337–46. doi: 10.1093/jxb/erh237. PMID 15310815.
- ↑ R.M. Harrison (1990). Pollution: Causes, Effects & Control. 2. izdaja. Cambridge: Royal Society of Chemistry. ISBN 0-85186-283-7.
- ↑ P. Wentworth, J.E. McDunn, A.D. Wentworth, C. Takeuchi, J. Nieva, T. Jones, C. Bautista, J.M. Ruedi in drugi (13. december 2002). Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation. Science 298 (5601): 2195–219. Bibcode: 2002Sci...298.2195W. doi: 10.1126/science.1077642. PMID 12434011.
- ↑ O. Hirayama, K. Nakamura, S. Hamada, Y. Kobayasi (1994). Singlet oxygen quenching ability of naturally occurring carotenoids. Lipids (Springer) 29 (2): 149–50. doi: 10.1007/BF02537155. PMID 8152349.
- ↑ C. Chieh. Bond Lengths and Energies. University of Waterloo. Pridobljeno 16. decembra 2007.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 20,6 A. Stwertka (1998). Guide to the Elements (dopolnjena izdaja). Oxford University Press. str. 48–49. ISBN 0-19-508083-1.
- ↑ 21,0 21,1 F. Cacace, G. de Petris, A. Troiani (2001). Experimental Detection of Tetraoxygen. Angewandte Chemie International Edition 40 (21): 4062–65. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ↑ 22,0 22,1 Ball, Philip (16. september 2001). »New form of oxygen found«. Nature News. doi:10.1038/news011122-3. Pridobljeno 9. januarja 2008.
- ↑ L.F. Lundegaard, G. Weck, M.I. McMahon, S. Desgreniers, P. Loubeyre (2006). Observation of an O8 molecular lattice in the phase of solid oxygen. Nature 443 (7108): 201–04. Bibcode: 2006Natur.443..201L. doi: 10.1038/nature05174. PMID 16971946.
- ↑ S. Desgreniers, Y.K. Vohra, A.L. Ruoff (1990). Optical response of very high density solid oxygen to 132 GPa. J. Phys. Chem. 94 (3): 1117–22. doi: 10.1021/j100366a020.
- ↑ K. Shimizu, K. Suhara, M. Ikumo, M.I. Eremets, K. Amaya (1998). Superconductivity in oxygen. Nature 393 (6687): 767–69. Bibcode: 1998Natur.393..767S. doi: 10.1038/31656.
- ↑ Emsley 2001, str. 299.
- ↑ Air solubility in water. The Engineering Toolbox. Pridobljeno 21. decembra 2007.
- ↑ D.H. Evans, J.B. Claiborne (2006). The Physiology of Fishes. CRC Press. str. 88. ISBN 0-8493-2022-4.
- ↑ D.R. Lide (2003). Section 4: Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements. CRC Handbook of Chemistry and Physics (84. izdaja). Boca Raton, Florida: CRC Press. ISBN 0-8493-0595-0.
- ↑ Overview of Cryogenic Air Separation and Liquefier Systems. Universal Industrial Gases, Inc. Pridobljeno 15. decembra 2007.
- ↑ Liquid Oxygen Material Safety Data Sheet (PDF). Matheson Tri Gas. Pridobljeno 15. decembra 2007.
- ↑ 32,0 32,1 32,2 32,3 Oxygen Nuclides/Isotopes Arhivirano 2020-08-18 na Wayback Machine.. EnvironmentalChemistry.com. Pridobljeno 17. Decembra 2007.
- ↑ 33,0 33,1 33,2 B.S. Meyer (19.-21. september 2005). Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen (PDF). Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Workgroup on Oxygen in the Earliest Solar System. Gatlinburg, Tennessee. 9022. Pridobljeno 22. januarja 2007.
- ↑ NUDAT 13O Arhivirano 2018-10-04 na Wayback Machine.. Pridobljeno 6. julija 2009.
- ↑ NUDAT 14O Arhivirano 2022-06-07 na Wayback Machine.. Pridobljeno 6. julija 2009.
- ↑ NUDAT 15O Arhivirano 2022-06-07 na Wayback Machine.. Pridobljeno 6. julija 2009.
- ↑ K. Croswell (februar 1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5.
- ↑ 38,0 38,1 38,2 38,3 Emsley 2001, str. 298.
- ↑ H.W. Harvey (1955). The Chemistry and Fertility of Sea Waters.
- ↑ 40,0 40,1 40,2 40,3 40,4 40,5 40,6 40,7 Emsley 2001, str. 301.
- ↑ 41,0 41,1 Emsley 2001, str. 304.
- ↑ E. Hand (13. marec 2008). The Solar System's first breath. Nature 452 (7185): 259. Bibcode: 2008Natur.452..259H. doi: 10.1038/452259a .PMID 18354437. Pridobljeno 18. marca 2009.
- ↑ J.R. Miller, M. Berger, L. Alonso, Z. Cerovic, Y. Goulas, S. Jacquemoud, J. Louis, G. Mohammed, I. Moya, R. Pedros, J.F. Moreno, W. Verhoef, P.J. Zarco-Tejada. Progress on the development of an integrated canopy fluorescence model. Geoscience and Remote Sensing Symposium, 2003. IGARSS '03. Proceedings. 2003 IEEE International. Pridobljeno 22. januarja 2008.
- ↑ W. Fenical (september 1983). Marine Plants: A Unique and Unexplored Resource. Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DIANE Publishing. str. 147. ISBN 1-4289-2397-7.
- ↑ J.C.G. Walker (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag.
- ↑ T.L. Brown, B. LeMay (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. str. 958. ISBN 0-13-048450-4.
- ↑ 47,0 47,1 Raven 2005, str. 115–127.
- ↑ For humans, the normal volume is 6–8 liters per minute Arhivirano 2014-09-07 na Wayback Machine..
- ↑ 49,0 49,1 49,2 49,3 Izračunano iz vrednosti 1 mmHg = 0,133322 kPa
- ↑ 50,0 50,1 Normal Reference Range Table Arhivirano 2011-12-25 na Wayback Machine.. The University of Texas Southwestern Medical Center at Dallas.
- ↑ 51,0 51,1 The Medical Education Division of the Brookside Associates. Pridobljeno 6. decembra 2009.
- ↑ C. Henrickson (2005). Chemistry. Cliffs Notes. ISBN 0-7645-7419-1.
- ↑ 53,0 53,1 S.A. Crowe, S. L. N. Døssing, N. J. Beukes, M. Bau, S.J. Kruger, R. Frei, D.E. Canfield (2013). Atmospheric oxygenation three billion years ago. Nature 501 (7468): 535–538. doi: 10.1038/nature12426. PMID 24067713.
- ↑ N.A. Campbell, J.B. Reece (2005). Biology. 7. Izdaja. San Francisco: Pearson – Benjamin Cummings. str. 522–523. ISBN 0-8053-7171-0.
- ↑ S. Freeman (2005). Biological Science, 2. izdaja. Upper Saddle River, NJ: Pearson – Prentice Hall. str. 214, 586. ISBN 0-13-140941-7.
- ↑ 56,0 56,1 R.A. Berner (1999). Atmospheric oxygen over Phanerozoic time Arhivirano 2019-10-07 na Wayback Machine.. Proceedings of the National Academy of Sciences of the USA 96 (20): 10955–57. Bibcode: 1999PNAS...9610955B. doi: 10.1073/pnas.96.20.10955. PMC 34224. PMID 10500106.
- ↑ N.J. Butterfield (2009). Oxygen, animals and oceanic ventilation: An alternative view. Geobiology 7 (1): 1–7. doi: 10.1111/j.1472-4669.2009.00188.x. PMID 19200141.
- ↑ M. Dole (1965). The Natural History of Oxygen (PDF). The Journal of General Physiology 49 (1): 5–27. doi: 10.1085/jgp.49.1.5. PMC 2195461. PMID 5859927. Pridobljeno 16. decembra 2007.
- ↑ J. Jastrow (1936). Story of Human Error. Ayer Publishing. Str. 171 ISBN 0-8369-0568-7.
- ↑ 60,0 60,1 60,2 60,3 60,4 Cook & Lauer 1968, str. 499.
- ↑ 61,0 61,1 61,2 Britannica contributors (1911). John Mayow. Encyclopaedia Britannica. 11. Izdaja. Pridobljeno 16. decembra 2007.
- ↑ 62,0 62,1 World of Chemistry contributors (2005). John Mayow. World of Chemistry. Thomson Gale. ISBN 0-669-32727-1. Pridobljeno 16. decembra 2007.
- ↑ R. Morris (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN 0-309-08905-0.
- ↑ 64,0 64,1 64,2 64,3 64,4 Emsey, str. 300
- ↑ J. Priestley (1775). An Account of Further Discoveries in Air. Philosophical Transactions 65: 384–94. doi: 10.1098/rstl.1775.0039.
- ↑ D. DeTurck, L. Gladney, A. Pietrovito (1997). Do We Take Atoms for Granted?. The Interactive Textbook of PFP96. University of Pennsylvania. Pridobljeno 28. januarja 2008.
- ↑ H.E. Roscoe, C. Schorlemmer (1883). A Treatise on Chemistry. D. Appleton and Co., str. 38.
- ↑ 68,0 68,1 J. Daintith (1994). Biographical Encyclopedia of Scientists. CRC Press. str. 707. ISBN 0-7503-0287-9.
- ↑ Poland – Culture, Science and Media. Condensation of oxygen and nitrogen. Pridobljeno 4. oktobra 2008.
- ↑ 70,0 70,1 70,2 How Products are Made contributors (2002). Oxygen. How Products are Made. The Gale Group, Inc. Pridobljeno 16. decembrar 2007.
- ↑ Goddard-1926. NASA. Pridobljeno 18. novembra 2007.
- ↑ Non-Cryogenic Air Separation Processes. UIG Inc. 2003. Pridobljeno 16. decembra 2007.
- ↑ 73,0 73,1 73,2 Cook & Lauer 1968, str. 510.
- ↑ M.A. Sim, P. Dean, J. Kinsella, R. Black, R. Carter, M. Hughes (2008). Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated. Anaesthesia 63 (9): 938–40. doi: 10.1111/j.1365-2044.2008.05536.x. PMID 18540928.
- ↑ R.N. Stephenson I. Mackenzie, S.J. Watt, J.A. Ross (1996). Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy Arhivirano 2011-08-11 na Wayback Machine.. Undersea Hyperb Med 23 (3): 185–8. PMID 8931286. Pridobljeno 22. septembra 2008.
- ↑ Indications for hyperbaric oxygen therapy. Undersea and Hyperbaric Medical Society. Pridobljeno 22. septembra 2008.
- ↑ Undersea and Hyperbaric Medical Society. Carbon Monoxide. Pridobljeno 22. septembra 2008.
- ↑ C.A. Piantadosi (2004). Carbon monoxide poisoning Arhivirano 2011-02-03 na Wayback Machine.. Undersea Hyperb Med 31 (1): 167–77. PMID 15233173. Pridobljeno 22. septembra 2008.
- ↑ G.B. Hart, M.B. Strauss (1990). Gas Gangrene – Clostridial Myonecrosis: A Review Arhivirano 2011-02-03 na Wayback Machine.. J. Hyperbaric Med 5 (2): 125–144. Pridobljeno 22. septembra 2008.
- ↑ W.A. Zamboni, J.A. Riseman, J.O. Kucan (1990). Management of Fournier's Gangrene and the role of Hyperbaric Oxygen Arhivirano 2011-02-03 na Wayback Machine.. J. Hyperbaric Med 5 (3): 177–186. Pridobljeno 22. septembra 2008.
- ↑ Decompression Sickness or Illness and Arterial Gas Embolism. Undersea and Hyperbaric Medical Society. Pridobljeno 22. septembra 2008.
- ↑ C. Acott (1999). A brief history of diving and decompression illness. South Pacific Underwater Medicine Society Journal 29 (2). ISSN 0813-1988. OCLC 16986801. Pridobljeno 22. septembra 2008.
- ↑ 83,0 83,1 G.W. Morgenthaler, D.A. Fester, C.G. Cooley (1994). As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations. Acta Astronautica 32 (1): 39–49. Bibcode: 1994AcAau..32...39M. doi: 10.1016/0094-5765(94)90146-5. PMID 11541018.
- ↑ J.T. Webb, R.M. Olson, R.W. Krutz, G. Dixon, P.T. Barnicott (1989). Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures. Aviat Space Environ Med 60 (5): 415–421. doi: 10.4271/881071. PMID 2730484.
- ↑ 85,0 85,1 85,2 85,3 C. Acott (1999). Oxygen toxicity: A brief history of oxygen in diving Arhivirano 2010-12-25 na Wayback Machine.. South Pacific Underwater Medicine Society Journal 29 (3). ISSN 0813-1988. OCLC 16986801. Pridobljeno 21. septembra 2008.
- ↑ J.M. Longphre in drugi, P.J. Denoble, R.E. Moon, R.D. Vann. J.J. Freiberger (2007). First aid normobaric oxygen for the treatment of recreational diving injuries Arhivirano 2013-12-06 na Wayback Machine.. Undersea Hyperb Med. 34 (1): 43–49. ISSN 1066-2936. OCLC 26915585. PMID 17393938. Pridobljeno 21. Septembra 2008.
- ↑ 87,0 87,1 L. Bren (2002). Oxygen Bars: Is a Breath of Fresh Air Worth It?. FDA Consumer magazine. U.S. Food and Drug Administration. Pridobljeno 23. decembra 2007.
- ↑ Ergogenic Aids. Peak Performance Online. Pridobljeno 4. januarja 2008.
- ↑ Cook & Lauer 1968, str. 508.
- ↑ N.N. Greenwood, A. Earnshaw (1997). Chemistry of the Elements. 2. izdaja. Butterworth-Heinemann. str. 28. ISBN 0080379419.
- ↑ P. Maksyutenko, T.R. Rizzo, O.V. Boyarkin (2006). A direct measurement of the dissociation energy of water. J. Chem. Phys. 125 (18): 181101. Bibcode: 2006JChPh.125r1101M. doi: 10.1063/1.2387163. PMID 17115729.
- ↑ M. Chaplin (4. januar 2008). Water Hydrogen Bonding. Pridobljeno 6. januarja 2008.
- ↑ L.E. Smart, E.A. Moore (2005). Solid State Chemistry: An Introduction. 3. izdaja. CRC Press. str. 214. ISBN 978-0-7487-7516-3.
- ↑ 94,0 94,1 Cook & Lauer 1968, str. 507.
- ↑ R. Crabtree (2001). The Organometallic Chemistry of the Transition Metals. 3. izdaja. John Wiley & Sons. str. 152. ISBN 978-0-471-18423-2.
- ↑ Cook & Lauer 1968, str. 505.
- ↑ Cook & Lauer 1968, str. 506.
- ↑ N.P. Dharmeshkumar, G. Ashish Goel, S.B. Agarwal, G. Praveenkumar, K.L. Krishna (2003). Oxygen Toxicity. Indian Academy of Clinical Medicine 4 (3): 234.
- ↑ Cook & Lauer 1968, str. 511.
- ↑ M. Wade (2007). Space Suits. Encyclopedia Astronautica. Pridobljeno 16. decembra 2007.
- ↑ 101,0 101,1 P. Wilmshurst (1998). Diving and oxygen. BMJ 317 (7164): 996–9. doi: 10.1136/bmj.317.7164.996. PMC 1114047. PMID PMID 9765173.
- ↑ K. Donald , Kenneth (1992). Oxygen and the Diver. ISBN 1-85421-176-5.
- ↑ K. W. Donald (1947). Oxygen Poisoning in Man: Part I. Br Med J 1 (4506): 667–72. doi: 10.1136/bmj.1.4506.667. PMC 2053251. PMID 20248086.
- ↑ K. W. Donald (1947). Oxygen Poisoning in Man: Part II. Br Med J 1 (4507): 712–7. doi: 10.1136/bmj.1.4507.712. PMC 2053400. PMID 20248096.
- ↑ 105,0 105,1 105,2 105,3 B.L. Werley (urednik) (1991). Fire Hazards in Oxygen Systems. ASTM Technical Professional training. Philadelphia: ASTM International Subcommittee G-4.05.
- ↑ J.R. Chiles (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. ISBN 0-06-662082-1.
Viri[uredi | uredi kodo]
- Cook, G.A.; Lauer, C.M. (1968). »Oxygen«. V Clifford A. Hampel (ur.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. str. 499–512. LCCN 68-29938.
- Emsley, J. (2001). »Oxygen«. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, Anglija, Združeno kraljestvo: Oxford University Press. ISBN 0-19-850340-7.
- Raven, P.H.; Evert, R.F; Eichhorn, S.E. (2005). Biology of Plants (7. izd.). New York: W.H. Freeman and Company Publishers. str. 115–127. ISBN 0-7167-1007-2.
{{navedi enciklopedijo}}: Manjkajoč ali prazen|title=(pomoč)
Glej tudi[uredi | uredi kodo]
- VO2 max
- Kisik (video), University of Nottingham
Zunanje povezave[uredi | uredi kodo]
 Predstavnosti o temi kisik v Wikimedijini zbirki
Predstavnosti o temi kisik v Wikimedijini zbirki


