Kislina

Kislina (iz latinskega acidus/acēre – kisel)[1] je kemijska spojina, katere vodne raztopine so kislega okusa, pordečijo moder lakmusov papir in z bazami in nekaterimi kovinami tvorijo soli. Vodne raztopine kislin imajo pH manjši od 7. Nižji pH pomeni večjo kislost, se pravi večjo koncentracijo pozitivnih oksonijevih H3O+ ionov v raztopini. Za kemikalije in snovi, ki imajo lastnosti kislin, pravimo, da so kisle.
Za kisline obstajajo tri definicije: Arrheniusova, Brønsted-Lowryjeva in Lewisova. Arrheniusova teorija definira kisline kot snovi, ki pri raztapljanju v vodi povečajo koncentracijo vodikovih ionov (H+) ali natančneje oksonijevih ionov (H3O+). Brønsted-Lowryjeva definicija ja razširitev prve definicije in pravi, da so kisline snovi, ki lahko donirajo protone (H+). Med takšne zato spadajo tudi alkoholi in amini, ki vsebujejo O-H oziroma N-H skupine. Lewisove kisline so spojine, ki lahko sprejmejo elektronski par, da bi z njim tvorili kovalentno vez. Med Lewisove kisline spadajo tudi vsi kovinski kationi in molekule s pomanjkanjem elektronov, na primer borov trifluorid in aluminijev triklorid.
Med bolj znane anorganske kisline spadata klorovodikova kislina, ki tvori želodčno kislino in aktivira prebavne encime, in žveplova kislina, ki je elektrolit v avtomobilskih svinčevih akumulatorjih. Med znane organske kisline spadajo citronska, jabolčna, vinska in oksalna kislina, ki se nahajajo v sadju in zelenjavi, in sečna kislina. Vse omenjene kisline so lahko tudi čiste spojine v trdnemi, tekočem ali plinastem agregatnem stanju. Močne kisline in nekatere šibke kisline so korozivne. Izjema so na primer karborani in borova kislina.
Definicije[uredi | uredi kodo]
Sodobne definicije kislin se ukvarjajo s temeljnimi kemijskimi reakcijami, ki so skupne vsem kislinam.
Večina kislin, s katerimi se srečujemo v vsakdanjem življenju, so vodne raztopine ali so topne v vodi, zato so najpomembnejše Arrheniusove in Brønsted-Lowryjeve definicije.
Najpogosteje se uporablja Brønsted-Lowryjeva definicija. Če ni določeno drugače, se za kislo-bazične reakcije predpostavlja, da vključujejo prenos protona (H+) s kisline na bazo.
V vseh treh definicijah so kisline oksonijevi ioni. Zanimivo je, da so po Brønsted-Lowryjevi definiciji kisline to tudi alkoholi in amini, ki so hkrati lahko tudi Lewisove baze, ker imajo na kisikovem oziroma dušikovem atomu prost elektronski par.
Arrheniusova kislina[uredi | uredi kodo]
Švedski kemik Svante Arrhenius je leta 1884 kisle lastnosti snovi pripisal vodikovim H+ ionom oziroma protonom. Kislino je definiral kot snov, ki pri raztapljanju v vodi poveča koncentracijo H+ ionov. Vodikov ion se v kislo-bazičnih reakcijah pogosto zapiše s H+(aq), ker prosto vodikovo jedro oziroma proton kot tak ni obstojen in se veže z molekulo vode v oksonijev ion H3O+. Arrheniusovo kislino se torej lahko opiše kot snov, ki pri raztapljanju v vodi poveča koncentracijo oksonijevih ionov. Definicija izhaja iz ravnotežja disociacije vode v oksonijeve in hidroksidne ione (OH−):[2]
- H2O(l) + H2O(l) ⇌ H3O+(aq) + OH−(aq)
V čisti vodi prevladujejo molekule H2O, nekaj njih pa stalno disociira in reasociira, tako da je približno 1 od 107 molekul stalno v obliki oksonijevega in hidroksidnega iona. Ker je njihovo število enako, ni voda niti kisla niti bazična, ampak nevtralna.
Arrheniusova baza na drugi strani je definirana kot snov, ki pri raztapljanju v vodi poveča koncentracijo hidroksidnih ionov in s tem zmanjša koncentracijo oksonijevih ionov.
Stalna disociacija in reasociacija vodnih molekul tvori ravnotežje, v katerem vsako povečanje koncentracije oksonijevih ionov povzroči zmanjšanje koncentracije hidroksidnih ionov. Arrheniusovo kislino se zato lahko definira tudi kot snov, ki znižuje koncentracijo hidroksidnih ionov, in bazo kot snov, ki jo povečuje.
V kislini je koncentracija oksonijevih ionov večja od 10−7 mol/L. Ker je pH definiran kot negativni logaritem koncentracije oksonijevih ionov, imajo kisline pH manjši od 7.
Brønsted-Lowryjeva kislina[uredi | uredi kodo]

Arrheniusov koncept, ki je uporaben za opis mnogo reakcij, ima tudi mnogo omejitev. Leta 1923 sta fizikalna kemika Johannes Nicolaus Brønsted in Thomas Martin Lowry neodvisno eden od drugega ugotovila, da je v kislo-bazične reakcije vključen prenos protona. Po njuni definiciji je kislina snov, ki donira proton bazi.[2] Njuna teorija ima v primerjavi z Arrheniusovo več prednosti. Za zgled vzemimo naslednji dve reakciji ocetne kisline, ki daje kisu značilen okus:
- CH3COOH + H2O ⇌ CH3COO− + H3O+
- CH3COOH + NH3 ⇌ CH3COO− + NH+
4

Prvo reakcijo zlahka opišeta obe teoriji: CH3COOH deluje kot Arrheniusova kislina, ker pri raztapljanju v vodi deluje kot vir H3O+ ionov, in kot Brønsted-Lowryjeva kislina, ker donira proton vodi. V drugi reakciji se zgodi podobna pretvorba, samo da ocetna kislina donira proton amonijaku (NH3), katerega se ne da opisati z Arrheniusovo definicijo kisline, ker ne tvori oksonijevega iona.
Brønsted-Lowryjeva teorija je uporabna tudi za opis kovalentnih spojin, medtem ko je Arrheniusova teorija uporabna samo za ionske spojine. Vodikov klorid (HCl) in amonijak (NH3) sta kovalentni spojini, ki se spajata v različnih pogojih in vedno tvorita amonijev klorid NH4Cl, zato sta zelo primerna za prikaz omejitev Arrheniusove teorije:
- H3O+(aq) + Cl−(aq) + NH3 → Cl−(aq) + NH+
4(aq) + H2O - HCl(benzen) + NH3(benzen) → NH4Cl(s)
- HCl(g) + NH3(g) → NH4Cl(s)
V prvi reakciji, ki poteka v vodni raztopini, delujeta obe definiciji. V drugi reakciji, ki poteka v benzenu, Arrheniusova teorija zataji, ker v njej ne nastaneta niti oksonijev niti kloridni ion, vendar tudi tokrat nastane amonijev klorid. Arrheniusova teorija zataji tudi v tretji reakciji, ki poteka v plinski fazi.
Lewisova kislina[uredi | uredi kodo]
Tretji koncept, katerega je leta 1923 predlagal Gilbert Newton Lewis, vključuje reakcije s kislo-bazičnimi značilnostmi, v katerih ne pride do prenosa protona. Lewisova kislina je spojina, ki od druge spojine sprejme elektronski par, se pravi da je akceptor elektronskega para.[2] Brønsted-Lowryjeve kislo-bazične reakcije potekajo s prenosom protona, medtem ko Lewisove kislo-bazične reakcije potekajo s prenosom elektronskega para. Vse Brønsted-Lowryjeve kisline so hkrati tudi Lewisove kisline, za veliko Lewisovih kislin pa to ne velja. Lewisova kislo-bazična reakcija poteka drugače, kar je razvidno iz zapisa naslednjih dveh reakcij:
V prvi reakciji fluoridni ion F− donira elektronski par borovemu trifluoridu BF3, pri čemer nastane tetrafluoroborat BF−
4. Fluorid navidezno izgubi par valenčnih elektronov, ker si jih zdaj deli s fluorom v vezi B-F. Vezni elektroni so nekje v prostoru med obema atomskima jedroma in zato bolj oddaljeni od fluorida kot v prostem fluoridnem ionu. BF3 je Lewisova kislina, ker prejme elektronski par od fluorida. Te reakcije se ne da opisati v skladu z Brønsted-Lowryjevo teorijo, ker v njej ni prišlo do prenosa protona.
Drugo reakcijo se lahko opiše z obema teorijama. Proton se je z nedoločene Brønsted-Lowrijeve kisline prenesel na amonijak, ki je Brønsted-Lowrijeve baza. Alternativno deluje amonijak tudi kot Lewisova baza, ki prenese prosti elektronski par v vez z vodikovim ionom. Spojine, ki prejmejo elektronski par, so Lewisove kisline. Kisikov atom v H3O+ na primer prejme elektronski par, ko se ena od vezi O-H prekine, se pravi da elektroni, ki jih je delil z vodikom, pripadejo kisiku. Lewisova kislina se lahko, odvisno od konteksta, opiše tudi kot oksidant ali elektrofil.
Nomenklatura[uredi | uredi kodo]
Za kisline se običajno uporabljajo nesistematska ali polsistematska imena, ki vsebujejo besedo kislina, na primer borova kislina, ortoborova kislina, fosforjeva kislina, ocetna kislina itd. Nesistematska Imena so v sodobni nomenklaturi edinstvena in delno opišejo kemijske lastnosti spojine.[3]
Sistematska imena temeljijo izključno na sestavi in zgradbi kisline in načelih substitutivne in aditivne nomenklature. V teh primerih je izraz kislina odvečen. Poleg tega se mnogo spojin, ki bi se zaradi svojih lastnosti lahko prištevale h kislinam, nikoli ne imenuje kislina. Takšni so na primer heksaakvaaluminij(3+), hidridi in derivati amonijaka.[3]
Za kisline in njihove soli se uporablja tudi poenostavljen Stockov način poimenovanja z oksidacijskimi stanji, na primer žveplova(VI) kislina in dušikova(V) kislina oziroma sulfat(VI) in nitrat(V). Zadnja priporočila IUPAC Stockovega načina poimenovanja nič več ne omenjajo.[4]
Imena kislin se torej ne uporabljajo dosledno, številna pa so tako utečena, da bi bilo nesmiselno zamenjati jih s sistemskimi imeni.
Primeri:[5]
| Kemijska formula | Sprejemljivo nesistematsko ime |
Ime z oksidacijskim številom |
Sistemsko aditivno ime | |
|---|---|---|---|---|
| H2SO4 | [SO2(OH)2] | žveplova kislina | žveplova(VI) kislina | dihidroksidodioksidožveplo |
| H2CO3 | [CO(OH)2] | ogljikova kislina | ogljikova(IV) kislina | dihidroksidooksidoogljik |
| H3PO4 | [PO(OH)3] | fosforjeva kislina | fosforjeva(V) kislina | trihidroksidooksidofosfor |
| HNO3 | [NO2(OH)] | dušikova kislina | dušikova(V) kislina | hidroksidodioksidodušik |
| HClO3 | [ClO2(OH)] | klorova kislina | klorova(V) kislina | hidroksidodioksidoklor |
| C2H4O | [CH3CO(OH)] | ocetna kislina | etanojska kislina | |
| C7H6O2 | [C6H5CO(OH)] | benzojeva kislina | fenilmetanojska kislina |
Disociacija in ravnotežje[uredi | uredi kodo]
Reakcije kislin se pogosto zapiše s splošno enačbo
- HA ⇌ H+ + A−,
v kateri je HA kislina in A- konjugirana baza.
Kislo-bazični konjugirani pari se med seboj razlikujejo za proton in se pretvarjajo iz enih v druge s prejemanjem ali oddajanjem protona (protoniranje – deprotoniranje). Če upoštevamo, da je kislina lahko električno nabita, konjugirana baza pa električno nevtralna, se splošna enačba lahko zapiše tudi kot
- HA+ ⇌ H+ + A.
V raztopini vlada med kislino in njeno konjugirano bazo ravnotežje, ki se zapiše z naslednjo enačbo, v kateri so koncentracije udeležencev zapisane v oglatih oklepajih:
Ka je ravnotežna konstanta kisline ali konstanta disociacije kisline, ki je enaka produktu koncentracij produktov, deljenim s produktom koncentracij reaktantov.
Močne kisline imajo velike vrednosti Ka, se pravi da je ravnotežje pomaknjeno močno v desno, da je zato navzočih veliko oksonijevih ionov H3O+ in da je kislina skoraj popolnoma disociirana. Konstanta kisline Ka klorovodikove kisline (HCl) je 107.
Za šibke kisline so značilne nizke vrednosti konstante kisline, se pravi da v ravnotežju soobstajata protonirana oblika HA kot tudi deprotonirana oblika A-, da je navzoče zmerno število oksonijevih ionov in da je kislina le delno disociirana. Konstanta Ka ocetne kisline je 1,8·10-5.
Razpon vrednosti Ka obsega več redov velikosti, zato je bolj prikladno, da se namesto njih oporabljajo konstante pKa:
Močnejše kisline imajo manjše pKa kot šibke. V literaturi se pogosto navajajo njihove s poskusom določene vrednosti pri 25 °C.
Moč kisline[uredi | uredi kodo]
Moč kisline pomeni njeno sposobnost ali tendenco, da izgubi proton. Močne kisline v vodi popolnoma disociirajo, se pravi da iz enega mola močne kisline HA po raztapljanju v vodi nastane en mol ionov H+, en mol konjugirane baze A- in nič protonirane kisline HA. Njihov pKa je manjši od −1,74. Med močne kisline spadajo klorovodikova kislina (HCl), jodovodikova kislina (HI), bromovodikova kislina (HBr), perklorova kislina (HClO4), dušikova kislina (HNO3) in žveplova kislina (H2SO4). Vse naštete kisline v vodi 100 % disociirajo.
Šibke kisline disociirajo samo delno, tako da sta v ravnotežju prisotni tako kislina kot konjugirana baza. Mednje spadajo na primer mravljinčna kislina (HCOOH), ocetna kislina (CH3COOH), cianovodikova kislina (HCN) in žveplovodikova kislina (H2S).
Močne kisline imajo večje Ka in bolj negativne pKa kot šibke kisline.
Na to, kako lahko kislina izgubi svoj proton H+, vplivata predvsem dva ključna dejavnika: polarnost vezi H-A in velikost atoma A, ki določa trdnost vezi H-A. Moč kisline se pogosto obravnava tudi v smislu stabilnosti konjugirane baze.
Sulfonske kisline so organske oksikisline, ki spadajo k močnim kislinam. Takšna je na primer p-toluensulfonska kislina (tosilna kislina CH3-C6H4-SO3H). Sulfoonske kisline so v nasprotju z žveplovo kislino lahko trdne.
Superkisline so kisline, ki so močnejše od 100 % žveplove kisline. Takšne so na primer fluoroantiomonova kislina (H2FSbF6), magična kislina (FSO3H-SbF5) in perklorova kislina (HClO4). Superkisline lahko trajno protonirajo vodo in dajo kristalinične ionske hidronijeve soli. Poleg tega lahko kvantitativno stabilizirajo karbokatione.
Medtem ko se s Ka meri jakost kislih spojin, se jakost vodnih raztopin kislin meri s pH, ki je merilo za koncentracijo oksonijevih ionov v raztopini.
Kemijske lastnosti[uredi | uredi kodo]
Enoprotonska kislina[uredi | uredi kodo]
Enoprotonska kislina je kislina, ki lahko med disociacijo (ali ionizacijo) donira samo en proton na molekulo kisline. Disociacijo se lahko zapiše z naslednjo splošno enačbo:
- HA(aq) + H2O(l) ⇌ H3O+(aq) + A−(aq)
Enoprotonske kisline imajo samo eno Ka, ki je enaka
Najbolj znani enoprotonski anorganski kislini kislini sta klorovodikova (HCl) in dušikova kislina (HNO3). Za organske kisline izraz enoprotonska kislina pomeni, da ima samo eno karboksilno skupino –COOH. Takšne so na primer mravljinčna (HCOOH), ocetna (CH3COOH) in benzojeva kislina (C6H5COOH).
Večprotonske kisline[uredi | uredi kodo]
Dvoprotonska kislina s splošno formulo H2A lahko v odvisnosti od pH donira enega ali dva protona in ima zato dve konstanti kisline, Ka1 in Ka2:
- H2A(aq) + H2O(l) ⇌ H3O+(aq) + HA−(aq) Ka1
- HA−(aq) + H2O(l) ⇌ H3O+(aq) + A2−(aq) Ka2
Prva konstanta kisline je praviloma večja od druge (Ka1 > Ka2). Pri žveplovi kislini (H2SO4) nastane po doniranju enega protona hidrogensulfatni anion (HSO−
4) z zelo veliko Ka1. Iz hidrogensulfatnega aniona nastane po doniranju še enega protona sulfatni anion (SO2−
4) s srednje veliko Ka2. Iz tega sledi, da je žveplova kislina močna predvsem zaradi velike Ka1. Podoben primer je ogljikova kislina H2CO3. Tudi zanjo velja, da je Ka1 > Ka2, samo da sta obe vrednosti v primerjavi z žveplovo kislino majhni.

3 in CO2−
3 v oceanski vodi s slanostjo okrog 4 g/l; iz grafa je razvidno, da pri pH okrog 8 prevladuje hidrokarbonatni ion HCO−
3
Troprotonske kisline s splošno formulo H3A disociirajo v treh stopnjah:
- H3A(aq) + H2O(l) ⇌ H3O+(aq) + H2A−(aq) Ka1
- H2A−(aq) + H2O(l) ⇌ H3O+(aq) + HA2−(aq) Ka2
- HA2−(aq) + H2O(l) ⇌ H3O+(aq) + A3−(aq) Ka3
zato imajo tri konstante disociacije, za katere velja, da je Ka1 > Ka2 > Ka3.
Troprotonska anorganska kislina fosforna kislina H3PO4, ki tvori dihidrogenfosfatni H
2PO−
4 , hidrogenfosfatni HPO2−
4 in nazadnje fosfatni anion PO3−
4. Troprotonska organska kislina je citronska kislina, ki zaporedoma izgubi tri protone in nazadje pretvori v citratni ion. Položaji protonov v izvirni molekuli so enakovredni, vsaka naslednja Ka pa je manjša od prejšnje zato, ker je energijsko manj ugodno izgubiti proton, če je konjugirana baza bolj negativno nabita. V raztopini so kljub temu prisotne vse tri konjugirane baze. Za vsako konjugirano bazo se lahko izračuna njena delna koncentracija α. Dvoprotonska kislina v vodni raztopini generira tri vrste delcev: H2A, HA- in A2-. Delne koncentracije se lahko izračunajo bodisi iz pH, ki se lahko pretvori v [H+], ali iz koncentracije kisline z vsemi njenimi konjugiranimi bazami:
Graf delnih koncentracij vs. pH za dani Ka1 in Ka2 je znan kot Bjerrumov graf. Sistem enačb za dvoprotonskko kislino se lahko razširi na n-protonsko kislino, ki se deprotonira v i-stopnjah:
- ,
v kateri je K0 = 1, druge Kj pa so disociacijske konstante kisline.
Nevtralizacija[uredi | uredi kodo]
Nevtralizacija je reakcija med kislino in bazo, v kateri nastaneta sol in nevtralizirana baza. V reakciji med klorovodikovo kislino in natrijevim hidroksidom nastaneta natrijev klorid in voda:
- HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq)
Nevtralizacija je osnova kislinsko-bazičnih titracij, v katerih indikator pH pokaže, kdaj je bila kislini dodana ekvivalentna količina baze in obratno. Mišljenje, da je ekvivalentna točka vedno pri pH = 7, je zmotno in velja samo za kislino in bazo s podobno močjo.
Nevtralizacija močne kisline s šibko bazo daje rahlo kisle soli, zato je ekvivalentna točka pri pH < 7. Takšen je na primer amonijev klorid (NH4Cl), ki nastane z nevtralizacijo močne klorovodikove kisline (HCl) s šibkim amonijevim hidroksidom (NH4OH). Seveda velja tudi obratno, da nastanejo z nevtralizacijo močne baze s šibko kislino rahlo bazične soli. V tem primeru je ekvivalentna točka pri pH > 7. Takšen je na primer natrijev fluorid (NaF), ki nastane z nevtralizacijo šibke fluorovodikove kisline (HF) z močnim natrijevim hidroksidom (NaOH).
Ravnotežje med šibko kislino in šibko bazo[uredi | uredi kodo]
Da bi protonirana kislina lahko izgubila proton, mora biti pH sistema višji od pKa kisline. Zmanjšala koncentracija H+ v takšni bazični raztopini pomakne ravnotežje proti konjugirani bazi (deprotonitani obliki kisline). Pri nižjem pH (bolj kisli raztopini) je koncentracija H+ dovolj velika, da ostane kislina v protonirani obliki.
Raztopine šibkih kislin in soli njihovih konjugiranih baz tvorijo pufre.
Uporaba[uredi | uredi kodo]
Kisline so zelo uporabne spojine. Močne kisline, zlasti žveplova kislina, se na široko uporabljajo za predelavo mineralov. Iz fosfatnih mineralov na primer nastaja fosforna kislina, ki je surovina za proizvodnjo fosfatnih gnojil. Žveplova kislina se uporablja tudi za raztapljanje cinkovega oksida in pridobivanje cinka z elektrolizo nastale raztopine.
V kemični industriji se uporabljajo v nevtralizacijskih reakcijah za pridobivanje soli: iz amonijaka in dušikove kisline na primer nastane umetno gnojilo amonijev nitrat. Žveplova kislina se uporablja tudi v procesih estrenja karboksilnih kislin z alkoholi.
Kisline se uporabljajo kot aditivi za napitke in hrano, ker spremenijo okus in služijo kot konzervansi. Fosforna in ogljikova kislina sta sestavini napitkov, ocetna kislina sestavina kisa, citronska kislina pa konzervans za omake, vloženo sadje in povrtnine.
Vinska kislina in druge organske kisline so pomembna sestavina sadja in zelenjave. Citronska kislina je prisotna v agrumih, oksalna kislina pa v paradižniku, špinači in zlasti v karamboli (kitajske zvezdice) in rabarbari. Rabarbarini listi in nezrele karambole so zaradi visoke vsebnosti oksalne kisline strupeni.
Askorbinska kislina (vitamin C) je esencialni vitamin za človeški organizem. Prisotna je v kosmulji, limonah in drugih citrusih in guavi.
Nekatere kisline se uporabljajo kot zdravila. Takšna je na primer acetilsalicilna kislina, bolj znana kot Aspirin, ki se uporablja kot analgetik in antipiretik.
Kisline igrajo pomembno vlogo tudi v človeškem organizmu. Klorovodikova kislina je sestavina želodčne kisline, ki razgrajuje velike in zapletene molekule v hrani, predvsem beljakovine, ogljikove hidrate in maščobe. Nastale amino kisline so gradniki proteinov, ki so potrebni za rast in obnavljanje tkiv. Podobno vlogo imajo tudi maščobne kisline. Nukleinske kisline so ključni elementi DNA in RNA, prenašalcev dednih lastnosti na potomce. Ogljikova kislina je pomembna za vzdrževanje primerne kislosti (pH) v organizmu.
Biološka vloga[uredi | uredi kodo]

Številne biološko pomembne molekule so ravno kisline. Nukleinske kisline, ki vsebujejo kisle fosfatne skupine PO3−
4, so eden od gradbenih elementov DNK in RNK, ki vsebujeta genetski zapis živih organizmov in ga prenašata s staršev na potomce. DNK, ki vsebuje kemijski načrt za sintezo proteinov, je sestavljena iz amino kislin. Celične membrane vsebujejo estre maščobnih kislin, kot so fosfolipidi.
V α-aminokislinah s splošno formulo R-CH(NH2)-COOH je amino skupina vezana na ogljikov atom ob karboksilni skupini. R je lahko različno dolg in lahko vsebuje stranske verige in druge funkcionalne skupine in tudi druge elemente, na primer kisik, dušik in žveplo. Najenostavnejša aminokislina je glicin, ki je (α) aminoetanojska (ali aminoocetna) kislina. Vse naravne aminokisline, razen glicina, so kiralne, se pravi, da imajo L in D izomer. V naravi prevladujejo L izomeri. Nekaj D-aminokislin vsebuje peptidoglikan, ki se nahaja v celičnih stenah nekaterih bakterij. Pri fiziološkem pH, ki ima praviloma vrednost okrog 7, so proste aminokisline običajno električno nabite, ker karboksilna skupina (-COOH) prenese svoj proton na amino skupino:
- R-CH[NH2]-[COOH] ⇌ R-CH[NH3]+-[COOH]–
Molekula je navzven nevtralna in amfoterna. Izjeme so aminokisline s kislimi ali bazičnimi stranskimi verigami. Asparaginska kislina (2- (ali α-) aminobutandiojska kislina) na primer ima eno protonirano amino skupino in dve deprotonirani karboksilni skupini, tako da ima pri fiziološkem pH naboj -1.
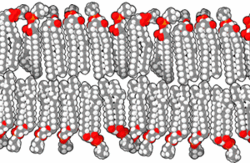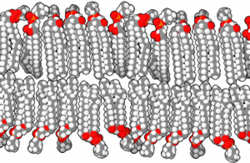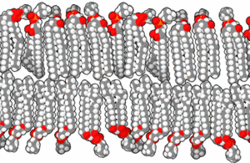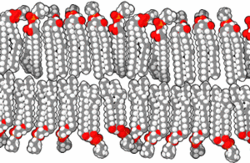
Druga pomembna skupina karboksilnih kislin so maščobne kisline in njihovi derivati. Kisline imajo dolgo verigo ogljikovodikov in karboksilno skupino. Celične membrane skoraj vseh organizmov so zgrajene predvsem iz fosfolipidnih dvojnih slojev s hidrofobnimi verigami ogljikovodikov obrnjenimi navznoter in hidrofilnimi fosfatnimi skupinami obrnjenimi navzven. Membrane vsebujejo tudi druge komponente in lahko aktivno sodelujejo v kislo-bazičnih reakcijah.
Pri ljudeh in mnogih živalih je klorovodikova kislina sestavina želodčne kisline, ki se izloča v želodcu kot sredstvo za hidrolizo proteinov in polisaharidov in pretvorbo neaktivnega proencima pepsinogena v encim pepsin. Nekateri organizmi proizvajajo kisline za obrambo. Mravlje na primer proizvajajo mravljinčno kislino.
Kislo-bazično ravnotežje igra ključno vlogo pri uravnavanju dihanja sesalcev. Kisik poganja celično dihanje, proces, s katerim organizmi sprostijo kemično potencialno energijo. Stranski proizvod procesa je ogljikov dioksid. Kisik in ogljikov dioksid se izmenjavata v pljučih, telo pa se na spreminjajoče se potrebe po energiji odziva s prilagoditvijo stopnje prezračevanja: v napornih obdobjih začne razgrajevati shranjene ogljikove hidrate in maščobe in sproščati v krvni obtok ogljikov dioksid. V vodnih raztopinah, kakršna je tudi raztopina CO2 v krvi, obstaja ravnotežje med ogljikovo kislino in bikarbonatnim ionom:
- CO2+ H2O ⇌ H2CO3 ⇌ H+ + HCO3−
Na znižanje pH zaradi povečane vsebnosti CO2 se možgani odzovejo s povečanjem hitrosti in globine dihanja, da se ogljikov dioksid čim prej sprosti in celice oskrbijo z dodatnim kisikom.
Celične membrane so zaradi lipofilnega dvojnega sloja maščobnih kislin na splošno neprepustne za velike polarne molekule. Veliko biološko pomembnih molekul, vključno številnimi farmacevtskimi učinkovinami, so šibke organske kisline, ki lahko prečkajo membrano v svoji nenabiti protonirani obliki, v svoji deprotonirani obliki konjugirane baze pa ne. Učinkovitost mnogih zdravil se zato lahko poveča ali zavre z uporabo antacidov in kislih živil. Deprotonirana oblika je pogosto bolj topna v vodi, se pravi tudi v krvi in citosolu. Kadar je okolica celice bolj kisla od nevtralnega pH v njej, bodo nekatere kisline obstajale v svoji nevtralni obliki in bodo topne v celični membrani, kar jim bo omogočilo prehod skozi dvojni sloj fosfolipidov. Kisline, ki pri znotrajceličnem pH izgubijo proton, bodo obstajale v topni obliki in bodo zmožne difundirati skozi citosol do svoje tarče. Šibke kisline so na primer ibuprofen, aspirin in penicilin.
Najpomembnejše kisline[uredi | uredi kodo]
Mineralne (anorganske) kisline[uredi | uredi kodo]
- raztopine vodikovih halogenidov: fluorovodikova kislina (HF), klorovodikova kislina (HCl), bromovodikova kislina (HBr), jodovodikova kislina (HI)
- oksokisline halogenov: hipoklorasta kislina (HClO), klorasta kislina (HClO2), klorova kislina (HClO3), perklorova kislina (HClO4)[6] in njim ustrezne kisline broma in joda
- žveplova kislina (H2SO4)
- fluorožveplova kislina (HSO3F)
- dušikova kislina (HNO3)
- fosforjeva kislina (H3PO4)
- fluoroantimonova kislina (HSbF6)
- fluoroborova kislina (HBF4)
- heksafluorofosforjeva kislina (HPF6)
- kromova kislina (H2CrO4)
- borova kislina (H3BO3)
Sulfonske kisline[uredi | uredi kodo]
- metansulfonska kislina (CH3SO3H)
- etansulfonska kislina (C2H5SO3H)
- benzensulfonska kislina (C6H5SO3H)
- p-toluensulfonska kislina (CH3C6H4SO3H)
- trifluoromatansulfonska kislina (CF3SO3H)
- polistirensulfonska kislina (sulfoniran polistiren, [CH2CH(C6H4)SO3H]n)
Karboksilne kisline[uredi | uredi kodo]
- metanojska kislina (HCOOH)
- etanojska kislina (CH3COOH)
- citronska kislina (C6H8O7)
- glukonska kislina (HOCH2-(CHOH)4-COOH)
- mlečna kislina (CH3-CHOH-COOH)
- oksalna kislina (HOOC-COOH)
- vinska kislina (HOOC-CHOH-CHOH-COOH)
Halogenirane karboksilne kisline[uredi | uredi kodo]
Halogen na drugem ogljikovem atomu poveča njeno jakost, zato so naštete kisline močnejše od ocetne kisline.
- fluoroetanojska kislina
- trifluoroetanojska kislina
- kloroetanojska kislina
- dikloroetanojska kislina
- trikloroetanojska kislina
Vinilogne karboksilne kisline[uredi | uredi kodo]
Karboksilne kisline imajo karbonilno (=O) in hidroksidno (-OH) skupino vezano na istem C atomu. V vinilognih karboksilnih kislinah omenjeni skupini ločuje dvojna vez C=C.
- askorbinska kislina (C6H8O6)
- fumarna kislina (trans: HOOC-HC=CH-COOH)
- maleinska kislina (cis: HOOC-HC=CH-COOH)
Nukleinske kisline[uredi | uredi kodo]
- deoksiribonukleinska kislina (DNK)
- ribonukleinska kislina (RNK)
Esencialne aminokisline[uredi | uredi kodo]
Sklici[uredi | uredi kodo]
- ↑ Merriam-Webster's Online Dictionary: acid.
- ↑ 2,0 2,1 2,2 D.D. Ebbing, S.D. Gammon (2005). General chemistry. 8. Izdaja. Boston, MA: Houghton Mifflin. ISBN 0-618-51177-6.
- ↑ 3,0 3,1 Inorganic Acids and Derivatives. Nomenclature of Inorganic Chemistry. IUPAC Recommandations 2005. str. 124. Pridobljeno 20. decembra 2014.
- ↑ Nomenklatura anorganskih spojin. str. 17. Pridobljeno 20. decembra 2014.
- ↑ A. Smrdu. Razlaga sprememb v imenovanju anorganskih spojin Arhivirano 2015-04-02 na Wayback Machine.. Založništvo Jutro. Ljubljana, str. 5. Pridobljeno 1. decembra 2014.
- ↑ A. Smrdu, str. 5.


![{\displaystyle K_{a}={[H^{+}]\cdot [A^{-}] \over [AH]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6166f7922a79b726afe27c3f755aca834fd2b458)

![{\displaystyle K_{a}={[H_{3}O^{+}]\cdot [A^{-}] \over [AH]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8780d900b9e1d8c87b971db4699ce41222015dc8)
![{\displaystyle \alpha _{H_{2}A}={{[H^{+}]^{2}} \over {[H^{+}]^{2}+[H^{+}]K_{1}+K_{1}K_{2}}}={{[H_{2}A]} \over {[H_{2}A]+[HA^{-}]+[A^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19da8b1f08d7404ca7ba0937cd8839009b40749e)
![{\displaystyle \alpha _{HA^{-}}={{[H^{+}]K_{1}} \over {[H^{+}]^{2}+[H^{+}]K_{1}+K_{1}K_{2}}}={{[HA^{-}]} \over {[H_{2}A]+[HA^{-}]+[A^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d1a44fee50372076c0293ee8bed9938a63a8b7f)
![{\displaystyle \alpha _{A^{2-}}={{K_{1}K_{2}} \over {[H^{+}]^{2}+[H^{+}]K_{1}+K_{1}K_{2}}}={{[A^{2-}]} \over {[H_{2}A]+[HA^{-}]+[A^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7773b926376566d47e1133d371697cc8f776b616)
![{\displaystyle \alpha _{H_{n-i}A^{i-}}={{[H^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}} \over {\displaystyle \sum _{i=0}^{n}{\Big [}[H^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}}{\Big ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04ba12927aeedcbc8146e405ddef74aa7cfa343c)