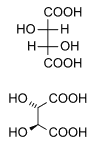
Vinska kislina

| |
| |
| Imena | |
|---|---|
| IUPAC ime
2,3-dihidroksibutandiojska kislina
| |
| Druga imena
2,3-dihidroksijantarjeva kislina
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.121.903 |
| Število E | E334 (antioksidanti, ...) |
| KEGG | |
| MeSH | tartaric+acid |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C4H6O6 | |
| Molska masa | 150,087 g/mol |
| Videz | bel prah |
| Gostota | 1,79 g/mL |
| Tališče | 171–174 °C (L ali D, čista) 206 °C (DL, racemat) 165–166 °C (mezo annhidrid) 146–148 °C (mezo hidrid)[2] |
| 133 g/100 ml (20 °C) | |
| Kislost (pKa) | L(+) 25 °C : pKa1= 2,89, pKa2= 4,40 mezo 25 °C: pKa1= 3,22, pKa2= 4,85 |
| Nevarnosti | |
EU klasifikacija (DSD) (zastarelo)
|
|
| R-stavki (zastarelo) | R36 |
| Sorodne snovi | |
| Drugi kationi | natrijev tartrat dinatrijev tartrat kalijev tartrat dikalijev tartrat |
| Sorodno karboksilne kisline | maslena kislina jantarna kislina dimerkaptojantarjeva kislina maleinska kislina fumaronska kislina |
| Sorodne snovi | 2,3-butandiol cikorinska kislina |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
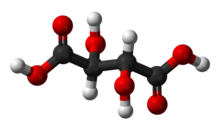
Vinska kislina je bela kristalinična dvoprotonska organska kislina, dihidroksilni derivat jantarne kisline. V naravi se nahaja v mnogih rastlinah, zlasti v grozdju, bananah in tamarindah, in seveda v vinu, v katerem je ena do glavnih kislin. V prehrambeni industriji in gospodinjstvih se, pogosto skupaj s sodo bikarbono, uporablja kot sredstvo za vzhajanje testa. Dodaja se tudi različnim živilom, da dobijo kisel okus, hkrati pa deluje kot antioksidant. Soli vinske kisline so tartrati.
Prvič jo je kot kalijev tartrat izoliral alkimist Geber (Džabir Ibn Hajjan) okoli leta 800.[4] Sodobno metodo pridobivanja je leta 1769 odkril švedski kemik Carl Wilhelm Scheele.
Vinska kislina je igrala pomembno vlogo pri odkrivanju kiralnosti, pojava, da ima molekula z asimetričnim ogljikovim atomom dva zrcalna izomera (L in D). To lastnost vinske kisline je prvi opazil odkril Jean Baptiste Biot, ki je opazoval sukanje ravnine polarizirane svetlobe. Njegove raziskave je leta 1847 nadaljeval Louis Pasteur z opazovanjem oblike kristalov amonijevega natrijevaga tatrata, za katere je odkril, da so kiralni. Z razvrščanjem levih in desnih oblik kristalov je prvi pripravil vzorec čiste L-vinske kisline.[5][6][7][8]
Stereoizomerija[uredi | uredi kodo]

Naravna vinska kislina je kiralna, se pravi da ima dve zrcalni obliki molekul in je zato uporabna za sintezo drugih kiralnih molekul. V naravi se pojavljata L-(-)-vinska kislina ali levosučna vinska kislina in njena zrcalna (enantiomerna) D-(+)-vinska kislina ali desnosučna vinska kislina. Nekiralna mezovinska kislina je umeten proizvod. Izraza levosučna in desnosučna nista povezana z njeno geometrijo,[9] ampak s smerjo zasuka polarizirane svetlobe pri prehodu skozi njeno raztopino. Za označevanje se včasih namesto velikih črk L in D uporabljajo tudi male črke. Levosučna in desnosučna vinska kislina sta enantiomera, mezovinska kislina pa je diastereomer obeh.[10][11]
Redka optično neaktivna oblika je DL-vinska kislina, ki je ekvimolarna zmes levosučne in desnosučne vinske kisline, ki se za razliko od mezovinske kisline imenuje racemna vinska kislina (iz latinskega racemus – grozd (grozdja)) ali racemat.
Vinska kislina se uporablja za preprečevanje reakcije bakrovih(II) ionov s hidroksidnimi ioni, ki so prisotni pri pripravi bakrovega(I) oksida. Bakrov(I) oksid je rdečerjava trdnina, ki se pridobiva z redukcijo bakrovih(II) soli z aldehidi v alkalni raztopini.
| levosučna (D-(−)-vinska kislina |
desnosučna (L-(+)-vinska kislina |
mezovinska kislina |
|---|---|---|

|

| |
|
DL-vinska kislina (racemat) | ||
Proizvodnja[uredi | uredi kodo]
L-(+)-vinska kislina[uredi | uredi kodo]

L-(+)-vinska kislina se proizvaja industrijsko iz naravnih surovin, vinskih droži, ki nastajajo kot stranski proizvod med vrenjem mošta. V drožih je prisoten večinoma kalijev bitartrat (KHC4H4O6), katerega se z apnenim mlekom (Ca(OH)2) obori kot kalcijevo sol:[12]
- KO2CCH(OH)CH(OH)CO2H + Ca(OH)2 → Ca(O2CCH(OH)CH(OH)CO2) + KOH + H2O
V praksi se večji izkoristek doseže z obaranjem s kalcijevim kloridom (CaCl2). Kalcijev tartrat se pretvori v vinsko kislino z raztapljanjem v žveplovi kislini. Proizvod je L-(+) izomer:
- Ca(O2CCH(OH)CH(OH)CO2) + H2SO4 → HO2CCH(OH)CH(OH)CO2H + CaSO4
Racemna vinska kislina[uredi | uredi kodo]
Racemno obliko vinske kisline se lahko pripravi z dvostopenjsko reakcijo iz maleinske (cis-butendiojske) kisline. V prvem koraku se maleinska kislina epoksidira z vodikovim peroksidom s kalijevim volframatom kot katalizatorjem:
- HO2CC2H4CO2H + H2O2 → OC2H2(CO2H) 2.
V naslednjem koraku se epoksid hidrolizira v racemno vinsko kislino:
- OC2H2(CO2H)2 + H2O → (HOCH)2(CO2H)2.
Mezovinska kislina[uredi | uredi kodo]
Mezovinska kislina nastane s termično izomerizacijo s segrevanjem vodne raztopine L-(+)-vinske kislina (165 °C, 2 dni). Pripravi se jo lahko tudi iz dibromojantarne (butandiojske) kisline s srebrovim hidroksidom:[13]
- HO2CCHBrCHBrCO2H + 2 AgOH → HO2CCH(OH)CH(OH)CO2H + 2 AgBr
Mezovinska kislina se loči od racemne oblike s kristalizacijo, ker je racemat slabše topen.
Reaktivnost[uredi | uredi kodo]
L-(+)-vinska kislina lahko sodeluje v več reakcijah. Z obdelavo z vodikovim peroksidom v prisotnosti železovih soli nastane dihidroksimaleinska kislina:
- HO2CCH(OH)CH(OH)CO2H + H2O2 → HO2CC(OH)C(OH)CO2H + 2 H2O,
ki se zatem lahko oksidira z dušikovo kislino v tartonsko (2-hidroksipropandiojsko) kislino.[14]
Derivati[uredi | uredi kodo]
Pomembni derivati vinske kisline so njene soli kalijev bitartrat, kalijev natrijev tatrtrat (Rochellska sol), bi je blago odvajalo, in antimonov kalijev tartrat, ki je močan emetik.[15][16][17] Diizopropil tartrat se uporablja kot katalizator v asimetričnih sintezah.
Vinska kislina je mišični toksin, ki inhibira nastajanje jabolčne kisline in pri visokih vsebnostih povzroči paralizo in smrt.[18] LD50 za človeka je ~7,5 g/kg, za kunca ~5,3 g/kg in miš ~4,4 g/kg. Smrtna doza za 70 kg težkega človeka je torej več kot 500 g, zato se lahko brez nevarnosti dodaja živilom, predvsem slaščicam s kislim okusom. Vinska kislina je hkrati tudi antioksidant (E334), tartrati pa služijo kot antioksidanti ali emulgatorji.
Suspenzija kalivevega tartrata v vodi je dobro čistilno sredstvo za bakrene predmete, ker raztaplja prevleko iz bakrovega(II) oksida. Nastali bakrov kompleks je dobro topen v vodi.
Vinska kislina v vinu[uredi | uredi kodo]


Vinska kislina se lahko v obliki drobnih kristalov vinskega kamna (kalijev bitartrat) izloča na zamaških ali dnu vinskih steklenic. Kristali niso nevarni, čeprav mnogi mislijo, da so zdrobljeno steklo. V mnogih primerih niso zaželeni, ker lahko spremenijo profil vina. Vinski kamen se izloča tudi v sodih, v katerih zori vino in je bil kot tak dolgo časa pomemben industrijski vir vinske kisline.
Vinska kislina igra pomembno vlogo pri alkoholnem vrenju mošta, ker znižuje njegov pH do te mere, da se mnoge škodljive bakterije ne morejo razvijati. Skupaj s citronsko in jabolčno kislino daje vinu kisel okus.
Uporaba[uredi | uredi kodo]
Vinska kislina in njeni derivati se na široko uporabljajo v farmacevtskih proizvodih, na primer v šumečih tabletah, in skupaj s citronsko kislino kot sredstvo za izboljšanje okusa peroralnih zdravil.[14] Kalijevi antimonovi derivati so emetiki, v majhnih količinah pa se dodajajo sirupom za kašelj kot sredstvo za izkašljevanje.
Vinska kislina je uporabna tudi v industriji. S kovinskimi ioni, na primer s kalcijem in magnezijem, tvori komplekse, zato se v poljedelstvu uporablja kot sredstvo za kompleksiranje mikroelementov v umetnih gnojilih in v industriji kot sredstvo za čiščenje površin aluminija, bakra in železa in zlitin teh kovin.
Sklici[uredi | uredi kodo]
- ↑ Tartaric Acid – Compound Summary. PubChem.
- ↑ D.R. Lide, urednik (2005). CRC Handbook of Chemistry and Physics. 86. izdaja.Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Dawson, R.M.C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ L. Solieri, P. Giudici (2009). Vinegars of the World. Springer. str. 29. ISBN 88-470-0865-4.
- ↑ L. Pasteur (1848). Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire. Comptes rendus de l'Académie des sciences 26. Pariz. str. 535–538.
- ↑ L. Pasteur (1848). Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire. Annales de Chimie et de Physique 3, 24 (6): 442–459.
- ↑ G.B. Kauffman, R.D. Myers (1998). Pasteur's resolution of racemic acid: A sesquicentennial retrospect and a new translation Arhivirano 2006-01-17 na Wayback Machine.. The Chemical Educator 3 (6): 1–4. doi = 10.1007/s00897980257a}}
- ↑ H. D. Flack (2009). Louis Pasteur's discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work Arhivirano 2012-09-06 at Archive-It. Acta Crystallographica A (65): 371–389. pmid=19687573. doi=10.1107/S0108767309024088.
- ↑ J. M. McBride. Yale lecture on history of stereochemistry of tartaric acid, the D/L and R/S systems Arhivirano 2014-11-29 na Wayback Machine..
- ↑ K. Carter (2007): Organic Chemistry. Global Media. str. 65. ISBN 978-81-89940-76-8. Pridobljeno 5. junija 2010.
- ↑ Use of azabicyclo hexane derivatives.
- ↑ J.M. Kassaian (2002). Tartaric acid. Ullmann's Encyclopedia of Industrial Chemistry. VCH: Weinheim, Nemčija. str. 671-678. doi: 10.1002/14356007.a26_163.
- ↑ A.P. West (1920). Experimental Organic Chemistry. World Book Company: New York. str. 232-237.
- ↑ 14,0 14,1 G.T. Blair, J.J. DeFraties (2000). Hydroxy Dicarboxylic Acids. Kirk Othmer Encyclopedia of Chemical Technology. str. 1-19. doi: 10.1002/0471238961.0825041802120109.a01.
- ↑ A. Zalkin, D.H. Templeton, T. Ueki (1973). Crystal structure of l-tris(1,10-phenathroline)iron(II) bis(antimony(III) d-tartrate) octahydrate. Inorganic Chemistry 12 (7): 1641. doi: 10.1021/ic50125a033.
- ↑ I. Haq, C. Khan (1982). Hazards of a traditional eye-cosmetic. Journal of the Pakistan Medical Association 32 (1): 7–8. PMID 6804665.
- ↑ R.I. McCallum (1977). President's address. Observations upon antimony. Proceedings of the Royal Society of Medicine 70 (11): 756–763. PMC 1543508. PMID 341167.
- ↑ A.S. Taylor, E. Hartshorne (1861). Medical jurisprudence. Blanchard and Lea. str. 61.