Benzen

| |
| Imena | |
|---|---|
| IUPAC ime
benzen
| |
| Druga imena
benzol,
fenil hidrid | |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.000.685 |
PubChem CID
|
|
| RTECS število |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C6H6 | |
| Molska masa | 78,11 g·mol−1 |
| Videz | brezbarvna tekočina |
| Gostota | 0,8786 g/cm3 [1] |
| Tališče | 5,53 °C (41,95 °F; 278,68 K) |
| Vrelišče | 80,1 °C (176,2 °F; 353,2 K) |
| 1,8 g/L (15 °C) [2] | |
| Viskoznost | 0,652 cP pri 20 °C |
| Dipolni moment | 0 D |
| Nevarnosti | |
EU klasifikacija (DSD) (zastarelo)
|
Vnetljivo (F) Karcinogeno (razred 1) Mutageno (razred 2) Strupeno (T) |
| R-stavki (zastarelo) | (R45), (R46), (R11), (R36/38), (R48/23/24/25), (R65) |
| S-stavki (zastarelo) | (S53), (S45) |
| NFPA 704 (diamant ognja) | |
| Plamenišče | −11 °C |
| Sorodne snovi | |
| Sorodne snovi | toluen borazin |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Benzen ali benzol je aromatska kemična spojina s formulo C6H6. Je brezbarvna, zelo lahko vnetljiva tekočina sladkega vonja, ki dobro raztaplja maščobe, smole, jod in naftalen. Benzen je pomembno industrijsko topilo in izhodna surovina za proizvodnjo zdravil, plastičnih mas, sintetskega gumija in barvil. Uporablja se kot dodatek k bencinu, vendar je zaradi karcinogenosti njegova uporaba omejena.
Pridobiva se iz premogovega katrana, nekaterih frakcij nafte ali sintetsko. Sodeč po njegovi strukturni formuli bi ga imenovali cikloheksa-1,3,5-trien, kar pa ni pravilno, ker nima stalnih dvojnih vezi. Benzen je namreč aromatska spojina s kontinuirnimi vezmi π, zato je za ponazoritev primernejša skeletna formula z včrtanim krogom, ki ponazarja kontinuirni elektronski oblak.
Zgodovina[uredi | uredi kodo]
Odkritje[uredi | uredi kodo]
Beseda benzen izhaja iz arabskega izraza »lubbān dšawi« (لبٌان), ki v dobesednem prevodu pomeni »kadilo z Jave«. Kadilo je aromatična smola, ki jo izločajo drevesa iz rodu boswelia, predvsem Boswelia sacra, iz jugovzhodne Azije. Smola se je uporabljala za kadilo in izdelavo parfumov. V Evropo je prišla v 15. stoletju, kjer so jo imenovali olibanum, benjamin, benjui (italijansko), benzoé (latinsko) ali benzoin. Snov, ki so jo dobili iz smole s sublimacijo, je bil »benzoinski cvet« ali benzojska kislina, ogljikovodik, ki so ga dobili iz smole z destilacijo, pa so imenovali benzin, benzol ali benzen.[3]
Z benzenom so se ukvarjali številni znanstveniki, od Michaela Faradaya do Linusa Paulinga. Benzen je leta 1825 prvi izoliral in identificiral Michael Faraday iz oljnatih ostankov pri proizvodnji svetilnega plina.[4][5] Leta 1833 je Eilhard Mitscherlich dobil benzen z destilacijo zmesi benzojeve kisline in apna in ga imenoval benzin.[6] Leta 1836 je francoski kemik Auguste Laurent isto snov poimenoval »phène« in ime je postalo osnova izpeljank fenol - za skupino C6H5-OH (hidroksibenzen) in fenil - C6H5 (radikal benzena brez enega vodikovega atoma). Istega leta je Charles Mansfield izoliral benzen iz premogovega katrana in ga štiri leta kasneje začel proizvajati na industrijski način.
Med kemiki se je postopoma razvilo spoznanje, da je benzen samo ena od njemu sorodnih snovi, ki jih je August Wilhelm Hofmann leta 1855 kot prvi poimenoval »aromati«.
Strukturna formula[uredi | uredi kodo]
Empirična formula benzena je bila znana že kmalu po njegovem odkritju, njegova zelo nenasičena zgradba s samo enim vodikovim atomom na en ogljikov atom pa je bila še dogo časa velika uganka. Archibald Scott Couper (1858) in Johann Josef Loschmidt (1861) sta predlagala nekaj možnih zgradb, ki so vsebovale veččlenske obroče in večkratne dvojne vezi, zaradi premajhnega znanja in pomanjkanja dokazov pa se kemiki niso mogli odločiti za nobeno od njih.
Leta 1865 je nemški kemik Friedrich August Kekulé predlagal zgradbo s šestimi ogljikovimi atomi z izmeničnimi enojnimi in dvojnimi vezmi. Naslednje leto je objavil obširno dizertacijo o zgradbi benzena,[7][8] v kateri je upošteval, da imajo monosubstituirani derivati benzena vedno samo en izomer, trisubstituirani derivati pa vedno natančno tri izomere. Njegova predlagana zgradba s šestimi ogljikovimi atomi je podpirala vse do takrat znane ugotovitve: simetrični obroč je dopuščal omenjeno izomerijo in razmerje med ogljikom in vodikom 1:1.
Ciklično zgradbo benzena je leta 1929 dokončno potrdila kristalografinja Kathleen Lonsdale z rentgensko analizo.[9][10]

Zgradba molekule[uredi | uredi kodo]
Zgradba benzena se lahko pojasni samo s preklapljanjem dvojnih vezi med ogljikovimi atomi:[11]

Raziskovalci so iz difrakcije rentgenskih žarkov ugotovili, da imajo vse vezi med ogljikovimi atomi dolžino 140 pikometrov (pm). Vez je nekoliko daljša od dvojne vezi C=C (135 pm) in nekoliko krajša od enojne vezi C–C (147 pm). Ta vmesna razdalja se lahko pojasni z delokalizacijo elektronov, se pravi z enakomerno porazdelitvijo elektronov med vsemi šestimi C-atomi. Vsak ogljikov atom ima dva elektrona p in enega od njih donira v delokaliziran obroč nad in pod benzenovim obročem. S stranskim prekrivanje šestih orbital pz nastane oblak π.

Takšna delokalizacija elektronov se imenuje »aromatičnost« in daje benzenu veliko stabilnost. Povečana stabilnost je osnovna lastnost vseh aromatskih molekul in po njej se razlikujejo od nearomatskih cikličnih molekul. Delokalizirane lastnosti vezi se pogosto prikažejo s krogom znotraj šestkotne razporeditve ogljikovih atomov. V organski kemiji velja pravilo, da se ogljikovi atomi v obročih ne označujejo.
Substituirani benzenovi derivati[uredi | uredi kodo]
Benzen je surovina za mnoge pomembne spojine, ki nastanejo s substitucijo enega ali več vodikovih atomov z neko drugo funkcionalno skupino. Med enostavnejše derivate spadajo fenol (C6H5–OH), toluen (C6H5–CH3) in anilin (C6H5–NH2). S spajanjem dveh obročev nastane bifenil (C6H5–C6H5). Z nadaljnjim odcepljanjem vodikovih atomov nastanejo kondenzirani aromatski ogljikovodiki, na primer naftalen in antracen. Mejni produkt zlivanja benzenovih obročev je spojina brez vodika, se pravi grafit.
V heterocikličnih spojinah je ena ali več CH-skupin v benzenovem obroču zamenjana s heteroatomom. Najpomembnejši so derivati z dušikom. Z zamenjavo ene CH-skupine z dušikom nastane piridin (C5H5N). Benzen in piridin imata zelo podobni zgradbi, vendar neposredna sinteza piridina iz benzena ni mogoča. Z zamenjavo druge CH-skupine z dušikom nastanejo pirazidin, pirimidin ali pirazin, odvisno od položaja drugega dušikovega atoma (orto, meta ali para).
Pridobivanje[uredi | uredi kodo]
Sledovi benzena lahko nastanejo pri nepopolnem gorenju vsake snovi, bogate z ogljikom. Benzen nastaja med ognjeniškimi izbruhi, v gozdnih požarih, pri kajenju tobaka in nepopolnem zgorevanju polivinilklorida (PVC).
Do druge svetovne vojne se je večina benzena proizvedla iz lahkega koksnega olja, ki je stranski produkt koksanja premoga. Po letu 1950 so začele potrebe po benzenu naraščati, predvsem zaradi rastoče industrije plastičnih mas, kar je privedlo do proizvodnje benzena iz naftnih derivatov. Trenutno se večina benzena proizvede naftnih derivatov in samo še majhen del iz premoga.
Za industrijsko proizvodnjo benzena so pomembni štirje tehnološki postopki: katalitska predelava (katalitski »reforming«), hidrodealkiliranje toluena, disproporcionacija toluena in krekiranje z vodno paro. V Zahodni Evropi se 50 % benzena proizvede s krekiranjem s paro in 25 % s katalitsko predelavo.
Katalitska predelava[uredi | uredi kodo]
V katalitskem reformingu se zmesi ogljikovodikov z vrelišči 60–200 °C primeša vodik. Tako nastalo reakcijsko zmes se v prisotnosti katalizatorja bifunkcionalnega platinovega klorida ali renijevega klorida pri tlaku 8–50 atm segreje na 500–525 °C. Pri teh pogojih začnejo alifatski ogljikovodiki odcepljati vodik in tvoriti obroče in se pretvarjati v aromatske ogljikovodike. Aromatski produkti se zatem ločijo od reakcijske zmesi z ekstrakcijo z dietilenglikolom (3-oksa-1,5-pentandiol), sulfolanom (tetrametilen sulfon) ali katerim drugim topilom. Benzen v ekstraktu se nato z destilacijo loči od drugih aromatskih spojin. Tehnološki postopek ekstrakcije je običajno krmiljen tako, da aromati vsebujejo čim manj nearomatskih komponent. Takšna procesa sta, na primer, BTX (benzen-toluen-ksilen) in Udex.
V procesu, ki je zelo podoben katalitski predelavi, se kot surovina uporablja utekočinjeni naftni plin, ki je sestavljen predsem in propana in butana.
Hidrodealkiliranje toluena[uredi | uredi kodo]
Hidrodealkiliranje toluena pretvori toluen v benzen. V tem procesu se zmes toluena in vodika s temperaturo 500–600 °C in tlakom 40–60 atm prevede preko katalizatorja kromovega, molibdenovega ali platinovega oksida. Proces poteka tudi brez katalizatorja, vendar pri višji temperaturi. Pri teh pogojih pride do naslednje kemijske reakcije:
- C6H5CH3 + H2 → C6H6 + CH4
Izkoristek procesa je običajno večji od 95 %. To ireverzibilno reakcijo spremlja ravnotežna stranska reakcija, v kateri nastaja bifenil (ali difenil):
- 2C6H6 ↔ H2 + C12H10
Če surovine vsebujejo nearomatske primesi (alkani in alkeni), primesi razpadejo v nižje ogljikovodike, kar poveča porabo vodika. Včasih se namesto toluena uporablja ksilen. Reakcija s ksilenom ima podoben izkoristek.
Disproporcionacija toluena[uredi | uredi kodo]
Disproporcionacija toluena (TDP) je proces, ki daje dva produkta: benzen in ksilen (dimetil benzen):
- 2C6H5CH3 → C6H6 + C6H4(CH3)2
Proces v grobem poteka tako, da v reakcijo vstopata dve molekuli toluena. Metilna skupina iz ene molekule se odcepi in se nato veže na drugo molekulo. V nekaterih katalitskih procesih poteka reakcija v korist ksilena.
Če potrebe po paraksilenu bistveno presegajo potrebe po drugih dveh izomerih (orto- in metaksilenu), se lahko uporabi proces selektivne disproporcionacije (STDP). V tem procesu nastane približno 90 % paraksilena.
Krekiranje z vodno paro[uredi | uredi kodo]
Krekiranje s paro je sicer proces za proizvodnjo etena in drugih alkenov iz alifatskih ogljikovodikov, s pravilno sestavo reakcijske zmesi pa lahko v procesu nastajajo tudi z benzenom bogati stranski produkti, tako imenovani pirolizni bencin. Pirolizni bencin se lahko uporablja kot dodatek k običajnemu bencinu, lahko pa se posamezne komponente, med katerimi je tudi benzen, ločijo s frakcionirano destilacijo.
Uporaba[uredi | uredi kodo]
V 19. in zgodnjem 20. stoletju se je benzen zaradi svojega prijetnega vonja uporabljal v kozmetiki, do leta 1920 pa tudi kot industrijsko topilo za razmaščevanje kovin, pripravo lepil in odstranjevanje barvnih premazov. Leta 1903 so ga začeli uporabljati za dekofeiniranje kave, vendar so postopek kmalu opustili. Ko so spoznali njegovo strupenost, so ga nadomestili z drugimi topili, predvsem s toluenom, ki ima zelo podobne lastnosti, vendar ni karcinogen.
Benzen povečuje oktansko število bencina in zmanjšuje klenkanje motorja, zato se je uporabljal kot dodatek motornemu bencinu. Okrog leta 1950 ga je nadomestil svinčev tetraetil, zaradi strupenosti svinčevih spojin pa se je namesto njega v nekaterih državah spet začel uporabljati benzen. Zaradi negativnih vplivov na zdravje in možno onesnaženje podtalnice je vsebnost benzena v bencinu v EU omejena na 1 %,[12] do leta 2011 pa naj bi se zmanjšala na 0,62 %.[13]


Trenutno se največ benzena porabi za sintezo drugih kemikalij, natančneje za organske kemikalije in plastike. V Evropi se 50 % benzena porabi za sintezo stirena, ki je surovina za polistiren, 20 % za sintezo kumena, ki je surovina za sintezo fenola, smol in lepil, in 15 % za sintezo cikloheksana, ki je surovina za sintezo najlona 6 in najlona 6-6. Manjše količine benzena se porabijo za proizvodnjo gume, lepil, barvil, detergentov, zdravil, razstreliv, napalma in pesticidov.[14][15]
V laboratorijih se kot topilo namesto benzena uporablja toluen, ki ima podobne lastnosti, ni strupen in je uporaben na večjem temperaturnem območju.
Benzen se je uporabljal kot osnovno raziskovalno orodje v različnih poskusih, med drugim za analizo dvodimenzionalnega plina.[16]
Reakcije[uredi | uredi kodo]
- Najpomembnejša reakcija, s katero se iz benzena pridobi večino njegovih derivatov, je elektrofilna aromatska substitucija.[17] Benzen je dovolj nukleofilen, da se lahko substituira z acilnimi ioni ali karbokationi. Reakcijski mehanizem je prikazan z naslednjo reakcijsko shemo:

- Poseben primer elektrofilne aromatske substitucije je Friedel-Craftsovo aciliranje. Aciliranje benzena, pa tudi mnogih drugih aromatskih spojin, poteka z acil kloridom in aluminijevim ali železovim kloridom kot katalizatorjem:

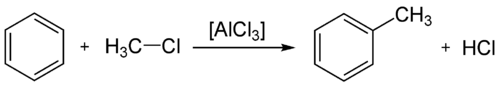
- Podobna reakcija je Friedel-Craftsovo alkiliranje, ki poteka z alkil halogenidi v prisotnosti AlCl3 kot katalizatorja:
- Sulfonacija. Aromatska sulfonacija benzena je reakcija, v kateri se vodikov atom zamenja s sulfonsko funkcionalno skupino –SO3H, tako da nastane benzensulfonska kislina. Za sulfonacijo se uporablja kadeča žveplova kislina (oleum):

- Nitracija. Benzen pri 50-55 °C reagira z nitronijevimi ioni (NO2+), tako da nastane nitrobenzen:

- Hidrogeniranje (redukcija). Benzen se s hidrogeniranjem pri 450 °C in tlaku 10 atm v prisotnosti niklja kot katalizatorja pretvori v cikloheksan.
Benzen je odličen ligand v organokovinski kemiji nizkovalentnih kovin. Pomembna kompleksa sta [RuCl2(C6H6)]2 in Cr(C6H6)2, ki imata strukturo sendviča oziroma polsendviča.
Strupenost[uredi | uredi kodo]

Benzen je strupen in povzroča resne okvare zdravja. Manjše količine benzena v zraku nastajajo pri zgorevanju tobaka in lesa, izparevanju bencina na bencinskih črpalkah, v izpušnih plinih motornih vozil in izpustih industrijskih plinov.[18][15] Benzen vsebujejo tudi pare lepil, barvnih premazov, voskov za loščenje pohištva in detergenti. Povečane koncentracije benzena so predvsem na bencinskih črpalkah in neurejenih odlagališčih nevarnih odpadkov.[19][20]
Izpostavljenost benzenu je svetovni zdravstveni problem. Dolgotrajno izpostavljanje benzenu povzroča okvare jeter, ledvic, pljuč, srca, možganov, DNK in kromosomov. Prva poročila, da povzroča raka, so iz leta 1920. Kemična industrija je kljub mnogim poročilom v medicinski literaturi šele leta 1979 priznala, da povzroča raka pri človeku. Dotlej je poskušala ovreči vse študije, ki so opravile na živalih, in trdila, da benzen na človeka nima nobenega vpliva. Raziskave so dokazale, da benzen povzroča raka pri različnih vrstah preskusnih živali, ne glede na to, kako so mu bile izpostavljene.[21][22]
V ZDA je Agencija za zaščito okolja (EPA) predpisala maksimalno dopustno koncentracijo benzena v vodi 0,005 mg/L. Pristojnim oblastem se mora prijaviti vsak naključni izpust v okolje, ki presega 4,5 kg.[23] Ameriška agencija za zdravje in varnost pri delu (OSHA) je omejila maksimalno dopustno osemurno koncentracijo benzena v zraku za 40-urni tedenski delavnik na 1,0 ppm. Kratkotrajne obremenitve ne smejo presegati 5 ppm ter lahko trajajo največ 15 minut.[24]
Vstop v telo, toksokinetika in mehanizem delovanja[uredi | uredi kodo]
Benzen lahko vstopi v telo preko vdihovanja in kožnega (dermalnega) stika, redkeje z zaužitjem. V pljučih vstopi preko alveolarne membrane v kri. Preko pljuč se sicer po drugi strani izloča nemetaboliziran benzen. Glede na to, da je benzen lipidotopen, ga privzemajo tkiva z veliko vsebnostjo maščob, kot sta maščobno in živčno tkivo, v manjši meri pa tudi kostni mozeg, jetra, vranica in ledvica.[14]
Končni produkti metabolizma benzena so fenol, katehol in kinol, pa tudi hidroksihidrokinol in mukonska kislina. Omenjeni produkti se konjugirajo z anorganskim fosfatom in glukuronsko kislino ter se izločijo z urinom.[14]
Pri akutni zastrupitvi je pomemben učinek draženja sluznic in kože, ki se kaže kot iritacija, oteklina (edem) in dermatitis. Pri večjih količinah se zaradi nalaganja v živčnem tkivu pokažejo tudi nevrološki simptomi. Pri kroničnem delovanju se znatno zmanjša kostni mozeg, poleg tega povzroča kromosomske nepravilnosti.[14] Glutation naj bi igral pomembno vlogo pri zaščiti pred prelomi DNK, induciranih z benzenom.[25]
Klinični simptomi in znaki[uredi | uredi kodo]
V primeru hude akutne zastrupitve (tj. več kot 3.000 ppm) se pokažejo simptomi in znaki zastrupitve z organskimi topili, kot so vzburjenje (ekscitacija), evforija, glavobol in vrtoglavica,[14][26] pri zaužitju pa še zaspanost, vzdraženost želodca in bruhanje ter s tem povezana nevarnost vdiha (aspiracije) strupene vsebine v pljuča.[15] V hujših primerih nastopi depresija osrednjega živčevja, zmedenost, aritmija ali povečan srčni utrip (tahikardija), krči, koma in na koncu smrt zaradi dihalne odpovedi.[14]
Pri kronični zastrupitvi se pojavijo anemija (slabokrvnost), levkopenija in trombocitopenija. V skladu s tem je oslabljen imunski sistem, kar poveča verjetnost okužb. V skrajnem primeru pride do aplazije kostnega mozga, posledično pa aplastična anemija ter pancitopenija.[14][26]
Drugi kronični učinki[uredi | uredi kodo]
Pri nekaterih ženskah, ki so vdihavale velike koncentracije benzena, so se pojavile nepravilnosti v menstrualnem ciklu in zmanjšanje velikosti jajčnih celic.[15] Izpostavljenost benzenu je povezana z določenimi razvojnimi nepravilnostmi, kot sta spina bifida in anencefalija.[27] Pri moških, ki imajo v sebi visoke doze benzena, obstaja verjetnost, da imajo v spermijih nenormalno število kromosomov, kar vpliva na plodnost ter razvoj zarodka.[28] Študije na živalih, natančneje pri podganah, miših, zajcih in dvoživkah so pokazale številne kromosomske nepravilnosti,[14] ki so se kazale kot manjša porodna masa mladičev, zakasnitev razvoja kosti in poškodbe kostnega mozga.[15]
Benzen je zdaj klasificiran kot karcinogen (razred 1), ker dolgotrajna izpostavjenost visokim koncentracijam benzena v zraku pri občutljivih posameznikih povzroča levkemijo,[26] akutno mielocitno levkemijo (AML) in akutno nelimfocitno levkemijo (ANLL) pa nesporno povzroča ravno benzen.[29]
Diagnostika in zdravljenje[uredi | uredi kodo]
Ugotavljanje prisotnosti benzena v organizmu je na voljo več testov: izmeriti ga je možno v izdihanem zraku, krvi ali seču (urinu). Testiranje je sicer možno samo kmalu po kontaminaciji ali pri zelo visokih sprejetih količinah, ker se zelo hitro odstrani preko izdihovanja ali biotransformacije. Ugotavljanje izpostavljenosti z analizo urina je težavno, ker enaki presnovki nastajajo tudi iz drugih virov,[30][31][32] kljub temu pa nekateri viri omenjajo, da je primerno nadzorovati količino fenola v seču v primeru poklicne izpostavljenosti.[26]
Pri zastrupitvi je potrebno odstraniti kontaminirana oblačila iz zastrupljenca, prizadete dele kože pa umiti z vodo in milom. V primeru zaužitja je potrebno dati aktivno oglje, da se prepreči absorpcija v prebavnem traktu. Potrebno je tudi simptomatsko zdravljenje.[14]
Sklici[uredi | uredi kodo]
- ↑ Lide, D.R. s sod. (2005). »Physical Constants of Organic Compounds«. CRC Handbook of Chemistry and Physics.
- ↑ Coker, A.K.; Ludwig, E.E. (2007). Ludwig's applied process design for chemical and petrochemical plants, Volume 1. Elsevier. str. 114. ISBN 075067766X.
- ↑ A. J. Rocke (1985). »Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory«. Annals of Science. 42: 355–81. doi:10.1080/00033798500200411.
- ↑ M. Faraday (1825). »On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat«. Philosophical Transactions of the Royal Society of London. 115: 440–466. doi:10.1098/rstl.1825.0022.
- ↑ R. Kaiser (1968). »Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968«. Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ↑ E. Mitscherlich (1834). »Ueber das Benzol und die Säuren der Oel- und Talgarten«. Annalen der Pharmacie. 9 (1): 39–48. doi:10.1002/jlac.18340090103.
- ↑ F. A. Kekulé (1865). »Sur la constitution des substances aromatiques«. Bulletin de la Societe Chimique de Paris. 3: 98–110.
- ↑ F. A. Kekulé (1866). »Untersuchungen uber aromatische Verbindungen«. Liebigs Annalen der Chemie. 137: 129–36. doi:10.1002/jlac.18661370202.
- ↑ K. Lonsdale (1929). »The Structure of the Benzene Ring in Hexamethylbenzene«. Proceedings of the Royal Society. 123A: 494.
- ↑ K. Lonsdale (1931). »An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method«. Proceedings of the Royal Society. 133A: 536–553.
- ↑ Bonding in benzene - the Kekulé structure
- ↑ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ↑ »Control of Hazardous Air Pollutants From Mobile Sources«. U.S. Environmental Protection Agency. 29. marec 2006. str. 15853. Pridobljeno 27. junija 2008.
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 14,6 14,7 14,8 Robles, H. (1998). "Benzene". V: Encyclopedia of Toxicology, vol. 1 (str. 133-4); urednik Weller P. idr. San Diego itd.: Academic Press. ISBN 0-12-227221-8
- ↑ 15,0 15,1 15,2 15,3 15,4 "Facts About Benzene". CDC. Pridobljeno 2011-01-04.
- ↑ Stranick S.J., Kamna M.M. in Weiss P.S. (1994). Atomic Scale Dynamics of a Two-Dimensional Gas-Solid Interface. Pennsylvania State University, Park Dept. of Chemistry.
- ↑ Stranks, D.R. s sod. (1970). Chemistry: A structural view. Carlton, Victoria: Melbourne University Press, str. 347. ISBN 0-522-83988-6
- ↑ ToxFAQs for Benzene Arhivirano 1999-05-08 na Wayback Machine., Agency for Toxic Substances and Disease Registry, Department of Health and Human Services
- ↑ OSHA Hazard Communication Standard 1910.1200(d)(5)(ii), glej točko 1910.1200(d)(4)
- ↑ 10/16/2003 - OSHA-recognized chemicals as carcinogens or potential carcinogens for Hazard Communication purposes. Osha.gov (2003-10-16). Pridobljeno dne 2010-10-09.
- ↑ Huff, J. (2007). »Benzene-induced cancers: abridged history and occupational health impact«. Int. J. Occup. Environ. Health. 13 (2): 213–21. PMID 17718179.
- ↑ Rana, S.V.; Verma, Y. (2005). »Biochemical toxicity of benzene«. J. Environ. Biol. 26 (2): 157–168. PMID 16161967.
- ↑ Drinking Water Contaminants | Drinking Water Contaminants | US EPA. Water.epa.gov. Pridobljeno dne 2010-10-09.
- ↑ »Chemical Sampling Information Benzene«. Arhivirano iz prvotnega spletišča dne 22. marca 2011. Pridobljeno 3. januarja 2011.
- ↑ Fracasso, M.E.; in sod. (2009). »Low air levels of benzene: Correlation between biomarkers of exposure and genotoxic effects«. Toxicol. Lett. 192 (1): 22–8. doi:10.1016/j.toxlet.2009.04.028. PMID 19427373.
- ↑ 26,0 26,1 26,2 26,3 Sinkovič, A. (2009). »Zastrupitve s plini«. Med. razgl. 48 (1–2): 74.
- ↑ »Breathe carefully: air emissions of benzene may cause birth defects«. Pridobljeno dne 2011-01-03.
- ↑ »Benzene exposure linked to sperm abnormalities that cause birth defects«. Pridobljeno dne 2011-01-03.
- ↑ WHO. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs, Volumes 1 to 42, Supplement 7.
- ↑ Ashley, D.L.; in sod. (1994). »Blood concentrations of volatile organic compounds in a nonoccupationally exposed US population and in groups with suspected exposure« (PDF). Clinical chemistry. 40 (7 Pt 2): 1401–4. PMID 8013127.
- ↑ Fustinoni, S. (2005). »Urinary t,t-muconic acid, S-phenylmercapturic acid and benzene as biomarkers of low benzene exposure«. Chemico-biological interactions. 153–154: 253–6. doi:10.1016/j.cbi.2005.03.031. PMID 15935823.
- ↑ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man, 8. izdaja. Foster City, CA: Biomedical Publications, str. 144-148.
Zunanje povezave[uredi | uredi kodo]

