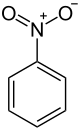
Nitrobenzen
| |||

| |||
| Imena | |||
|---|---|---|---|
| Druga imena
nitrobenzol
mirbanovo olje | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.469 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C6H5NO2 | |||
| Molska masa | 123,06 g/mol | ||
| Videz | rumenkasta tekočina | ||
| Gostota | 1,199 g/cm3 | ||
| Tališče | 5,7 °C | ||
| Vrelišče | 210,9 °C | ||
| 0,19 g/100 ml pri 20 °C | |||
| Nevarnosti | |||
EU klasifikacija (DSD) (zastarelo)
|
Karcinogen (kategorija 3) Mutagen (kategorija 3) | ||
| R-stavki (zastarelo) | R10, R23/24/25, R40, Predloga:Rlink, R51/53, Predloga:R62 | ||
| S-stavki (zastarelo) | (S1/2), S28, S36/37, (S45), (S61) | ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 88 °C | ||
| Sorodne snovi | |||
| Sorodne snovi | anilin, benzendiazonijev klorid, nitrozobenzen | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Nitrobenzen je organska spojina s kemično formulo C6H5NO2. To je bledo rumeno olje, ki ni topno v vodi in ima vonj po mandljih. Ko zmrzne tvori rumenkasto zelene kristale. Izdelava je v veliki meri podobna kot pri predhodniku anilinu. Občasno se uporablja kot dodatek za arome in parfume, v velikih količinah pa je zelo strupen. V laboratorijih se uporablja kot topilo za elektrofilni reagent.
Proizvodnja[uredi | uredi kodo]
Nitrobenzen se pripravlja z nitracijo benzena, z mešanico koncentrirane žveplove kisline, vode in dušikove kisline. Mešanico občasno imenujemo mešana kislina. Proizvodnja nitrobenzena je eden bolj nevarnih procesov v kemični industriji zaradi eksotermne reakcije (ΔHr = −117 kJ/mol).[1]
Svetovna proizvodnja v letu 1985 je bila okoli 1,7×106 ton. [1]
Postopek nitriranja[uredi | uredi kodo]
Reakcijska pot vključuje oblikovanje med aduktom, Lewisovo kislino, nitroniumovim jonom (NO2+) in benzenom. Nitroniumov jon nastaja z reakcijo dušikove kisline in kislinskem odstranjevalcu vode. Običajno je to žveplova kislina.
- HNO3 + H+ ⇌ NO2+ + H2O
Uporaba[uredi | uredi kodo]
Približno 95% nitrobenzena se porabi za proizvodnjo anilina,[1] ki je predhodna kemikalija za proizvajanje gume, pesticidov, eksploziva, barv in farmacevtskih izdelkov.
Specializirana uporaba[uredi | uredi kodo]
Nitrobenzen se prav tako uporablja za loščila čevljev, tal, usnjenih oblačil, barvnih topil in drugega materiala, ter za prikrivanje neprijetnega vonja. Destilirani nitrobenzen kot mirbane olje se uporablja kot poceni parfum za mila. Zelo pomemben je za proizvodnjo analgetičnega paracetamola, znan tudi kot paracetamol (Mannsville 1991).[2] Nitrobenzen se uporablja tudi za Kerr celice, saj ima nenavadno veliko Kerr konstanto.
Organske reakcije[uredi | uredi kodo]
Poleg pretvorbe v anilin, se lahko pretvori v sorodne derivate azobenzen,[3] nitrozobenzen,[4] in fenilhidroksilamin.[5] Ko se nitro skupina deaktivira, se kot nadomestek pojavi v meta položaju.
Varnost[uredi | uredi kodo]
Nitrobenzen je zelo strupen (mejna vrednost je 5 mg/m3) in se zelo hitro absorbira skozi kožo.
Dolgotrajna izpostavljenost lahko povzroči poškodbe centralnega živčevja, poslabša vid, poškoduje jetra, ledvice, povzroči anemijo in draženje pljuč. Vdihavanje lahko povzroči slabost, omotico, glavobol, utrujenost, slabost v rokah in nogah, v redkih primerih je lahko tudi usodno. Zaužitje lahko prav tako povzroči glavobol, omotico, slabost, bruhanje, draženje prebavil, izgubo okončin in notranje krvavitve.
Nitrobenzen spada med škodljive snovi za ljudi in je rakotvorna. S strani Ameriške agencije za varstvo okolja (United States Environmental Protection Agency)[6]je po mednarodni agenciji za raziskavo rakavih obolenj (IARC) uvrščena v 2B skupino za rakotvorne snovi, ki so morebitni povzročitelji rakavih obolenj.[7] Izkazalo se je, da je povzročitelj adenomov in karcinomov na jetrih, ledvicah in ščitnici na podganah.[8]
Glej tudi[uredi | uredi kodo]
- International Chemical Safety Card 0065
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Nitrobenzene"
- US EPA factsheet
Zunanje povezave[uredi | uredi kodo]
- Proizvodnja nitrobenzena
- 3D model nitrobenzena
- Proizvodna anilina iz nitrobenzena
- Mednarodni kemični varnostni list 0065
Viri[uredi | uredi kodo]
- ↑ 1,0 1,1 1,2 Gerald Booth (2007). "Nitro Compounds, Aromatic". In: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York. DOI: 10.1002/14356007.a17_411
- ↑ Bhattacharya A.; Purohit V. C.; Suarez, V.; Tichkule, R; Parmer, G.; Rinaldi, F. (2006). »One-step reductive amidation of nitro arenes: application in the synthesis of Acetaminophen«. Tetrahedron Letters. 47 (11): 1861–1864. doi:10.1016/j.tetlet.2005.09.196.
- ↑ Bigelow, H. E.; Robinson, D. B. (1955). »Azobenzene«. Org. Synth.; Coll. Vol., zv. 3, str. 103
- ↑ G. H. Coleman; C. M. McCloskey; F. A. Stuart. »Nitrosobenzene«. Org. Synth.; Coll. Vol., zv. 3, str. 668
- ↑ O. Kamm. »β-Phenylhydroxylamine«. Org. Synth.; Coll. Vol., zv. 1, str. 445
- ↑ http://cfpub.epa.gov/ncea/iris/index.cfm?fuseaction=iris.showQuickView&substance_nmbr=0079
- ↑ Agents Classified by the IARC Monographs Arhivirano 2011-10-25 na Wayback Machine., International Agency for Research on Cancer
- ↑ National Institutes of Health · U.S. Department of Health and Human Services, Nomination: Nitrobenzene Review committee, 02/02/2010