Oganeson
| Oganeson | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [oganeson] | ||||||||||||
| Videz | kovinski (predvideno) | ||||||||||||
| Masno število | [294] | ||||||||||||
| Oganeson v periodnem sistemu | |||||||||||||
| |||||||||||||
| Vrstno število (Z) | 118 | ||||||||||||
| Skupina | skupina 18 (žlahtni plini) | ||||||||||||
| Perioda | perioda 7 | ||||||||||||
| Blok | blok p | ||||||||||||
| Razporeditev elektronov | [Rn] 5f14 6d10 7s2 7p6 (napovedano)[1][2] | ||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 18, 32, 32, 18, 8 (napovedano) | ||||||||||||
| Fizikalne lastnosti | |||||||||||||
| Faza snovi pri STP | trdnina (predvideno)[3] | ||||||||||||
| Tališče | 52 ± 15 °C (predvideno)[3] | ||||||||||||
| Vrelišče | 177 ± 10 °C (predvideno)[3] | ||||||||||||
| Gostota (blizu s.t.) | 6,6–7,4 g/cm3 (predvideno)[3] | ||||||||||||
| Kritična točka | 166 °C, 6,8 MPa (ekstrapolirano)[4] | ||||||||||||
| Talilna toplota | 23,5 kJ/mol (ekstrapolirano)[4] | ||||||||||||
| Izparilna toplota | 19,4 kJ/mol (ekstrapolirano)[4] | ||||||||||||
| Lastnosti atoma | |||||||||||||
| Oksidacijska stanja | (−1),[2] (0), (+1),[5] (+2),[6] (+4),[6] (+6)[2] (napovedano) | ||||||||||||
| Ionizacijske energije | |||||||||||||
| Kovalentni polmer | 157 pm (predvideno)[9] | ||||||||||||
| Druge lastnosti | |||||||||||||
| Pojavljanje v naravi | umetno | ||||||||||||
| Kristalna struktura | ploskovno centrirana kocka (pck) (ekstrapolirano)[10] | ||||||||||||
| Številka CAS | 54144-19-3 | ||||||||||||
| Zgodovina | |||||||||||||
| Poimenovanje | po Yuri Oganessianu | ||||||||||||
| Prediction | Hans Peter Jørgen Julius Thomsen (1895) | ||||||||||||
| Odkritje | Joint Institute for Nuclear Research in Lawrence Livermore National Laboratory (2002) | ||||||||||||
| Najpomembnejši izotopi oganesona | |||||||||||||
| |||||||||||||
Oganeson je sintetični kemični element s simbolom Og in atomskim številom 118. Prvič ga je leta 2002 na Skupnem inštitutu za jedrske raziskave v Dubni blizu Moskve v Rusiji sintetizirala skupina ruskih in ameriških znanstvenikov. Decembra 2015 ga je Skupna delovna skupina mednarodnih znanstvenih teles IUPAC in IUPAP priznala kot enega od štirih novih elementov. Formalno je bil imenovan 28. novembra 2016.[13][14] Ime je v skladu s tradicijo imenovanja elementov po znanstvenikih, v tem primeru po jedrskem fiziku Juriju Oganesjanu, ki je imel pomembno vlogo pri odkrivanju najtežjih elementov v periodnem sistemu. Je eden od le dveh elementov, poimenovanih po osebi, ki je bila v času poimenovanja živa (drugi je siborgij), in edini element, katerega soimenjak je danes še živ.[15]
Oganeson ima najvišje atomsko število in največjo atomsko maso od vseh znanih elementov. Radioaktivni atom oganesona je zelo nestabilen in od leta 2005 je bilo zaznanih le pet (mogoče šest) atomov izotopa oganesona-294.[16] Čeprav je to omogočilo zelo malo eksperimentalnih karakterizacij njegovih lastnosti in možnih spojin, so teoretični izračuni privedli do številnih napovedi, vključno z nekaterimi presenetljivimi. Na primer, čeprav je oganeson član 18. skupine (žlahtni plini) in prvi tovrstni sintetični element, je v nasprotju z vsemi drugimi elementi te skupine občutno reaktiven. V preteklosti je veljalo, da gre za plin pri običajnih pogojih, zdaj pa naj bi bil zaradi relativističnih učinkov trden. Na periodnem sistemu elementov je element p-bloka in zadnji v sedmi periodi.
Uvod
[uredi | uredi kodo]
Najtežja[a] jedra nastanejo v jedrskih reakcijah, ki združijo dve drugi jedri neenake velikosti[b] v eno; v grobem velja, da bolj, kot sta jedri glede na maso neenaki, večja je možnost, da bosta reagirali.[22] Iz materiala iz težjih jeder se naredi tarča, ki jo nato bombardira snop lažjih jeder. Dve jedri se lahko združita v eno samo, če se dovolj približata; normalno se jedra (vsa pozitivno nabita) med seboj odbijajo zaradi elektrostatičnega odbijanja. Močna interakcija lahko to odbojnost premaga, vendar le na zelo kratki razdalji od jedra; jedra žarka se tako močno pospeši, da postane taka odbojnost nepomembna v primerjavi s hitrostjo jedra v snopu.[23] Samo približevanje ni dovolj, da se dve jedri zlijeta: ko se dve jedri približata, običajno ostaneta skupaj približno 10−20 sekunde in se nato ločita (ne nujno v isti sestavi kot pred reakcijo), namesto da tvorita eno jedro.[23][24] Če pride do fuzije, je začasna združitev, imenovana sestavljeno jedro, vzbujeno stanje. Da bi izgubilo energijo vzbujenja in doseglo stabilnejše stanje, se sestavljeno jedro razcepi ali izvrže enega ali več nevtronov,[c] ki odnesejo odvečno energijo.[25][d]
Žarek prehaja skozi tarčo in doseže naslednjo komoro – separator; če novo jedro nastane, potuje skupaj s tem žarkom.[28] V separatorju se novo nastalo jedro loči od drugih nuklidov (prvotnega žarka in vseh drugih reakcijskih produktov)[e] in prenese v pregradno-površinski detektor, ki jedro ustavi. Tam je zaznana natančna lokacija prihajajočega udarca na detektor; prav tako tudi njegova energija in čas prihoda.[28] Prenos traja približno 10−6 sekunde; da jo lahko zazna, jedro med tem ne sme razpasti.[31] Jedro se ponovno zabeleži, ko se zabeleži njegovo razpadanje in izmeri lokacija, energija in čas razpada.[28]
Stabilnost jedra zagotavlja močna interakcija, vendar je njegov obseg zelo kratek; ko jedra povečamo, vpliv močne interakcije na najbolj oddaljene nukleone (protone in nevtrone) oslabi. Prav tako jedro raztrga elektrostatično odbijanje med protoni, saj ima neomejen domet.[32] Za jedra najtežjih elementov je tako teoretično napovedan[33] in doslej opazovan[34] predvsem propad z razpadnimi načini, ki jih povzroča takšna odbijanje: alfa razpad in spontana cepitev;[f] ti načini prevladujejo za jedra supertežkih elementov. Alfa razpadi so zaznani z oddajanjem alfa delcev, produkte razpada pa je enostavno določiti pred dejanskim razpadom; če takšno razpadanje ali niz zaporednih razpadov ustvari znano jedro, lahko prvotni produkt reakcije aritmetično določimo.[g] Spontana cepitev proizvaja različna jedra kot produkte, zato prvotnega nuklida ni mogoče določiti od njegovih produktov.[h]
Informacije, ki so na voljo fizikom, katerih namen je sintetizirati enega najtežjih elementov, so torej informacije, zbrane na detektorjih: lokacija, energija in čas prihoda delca na detektor ter podatki o njegovem razpadu. Fiziki analizirajo te podatke in skušajo ugotoviti ali jih je dejansko povzročil nov element in ali jih ni mogel povzročiti drugačen nuklid od tistega, katerega so iskali. Pridobljeni podatki pogosto ne zadoščajo za sklep, da je bil nov element vsekakor ustvarjen in če za opažene učinke ni druge razlage, so bile narejene napake pri interpretaciji podatkov.
Zgodovina
[uredi | uredi kodo]Prva predvidevanja
[uredi | uredi kodo]Možnost sedmega žlahtnega plina po heliju, neonu, argonu, kriptonu, ksenonu in radonu je bila obravnavana skoraj takoj, ko je bila odkrita skupina žlahtnih plinov. Danski kemik Hans Peter Jørgen Julius Thomsen je aprila 1895, leto po odkritju argona, napovedal, da obstaja cela vrsta kemično inertnih plinov, podobnih argonu, ki bodo med skupinami halogenov in alkalijskih kovin: pričakoval je, da bo sedma skupina končala periodo z 32 elementi, ki je vsebovala torij in uran, ter da ima atomsko težo 292, blizu 294, ki je sedaj znana po prvem in edinem potrjenem izotopu oganesona.[41] Niels Bohr je leta 1922 ugotovil, da bi moral ta sedmi žlahtni plin imeti atomsko število 118, in napovedal njegovo elektronsko strukturo kot 2, 8, 18, 32, 32, 18, 8, kar ustreza sodobnim napovedim.[42] Po tem je Aristid von Grosse leta 1965 napisal članek, v katerem je napovedal verjetne lastnosti elementa 118. Po Thomsenovi napovedi je minilo 107 let, preden je bil oganeson uspešno sintetiziran, vendar njegove kemijske lastnosti še vedno niso raziskane, da bi ugotovili, ali se obnaša kot težji kongener radona. V članku iz leta 1975 je Kenneth Pitzer predlagal, da mora biti 118. element plin ali hlapna tekočina zaradi relativističnih učinkov.[43]
Konec leta 1998 je poljski fizik Robert Smolańczuk objavil izračune o fuziji atomskih jeder za sintezo supertežkih atomov, vključno z oganesonom.[44] Njegovi izračuni nakazujejo, da bi bilo mogoče oganeson izdelati tako, da bi v skrbno nadzorovanih pogojih lahko jedri svinca in kriptona združili in da bi bila verjetnost fuzije (prerez) te reakcije blizu reakciji svinec-krom, ki je ustvarila element 106, siborgij . To je nasprotovalo napovedim, da se bodo preseki reakcij s svincem ali bizmutovimi tarčami eksponentno zniževali, ko se bo atomsko število nastalih elementov povečalo.
Leta 1999 so raziskovalci iz Narodnega laboratorija Lawrence v Berkeleyu uporabili te napovedi in v prispevku, objavljenem v Physical Review Letters, in kmalu po poročanju rezultatov v Science objavili odkritje livermorija in oganesona.[45] Raziskovalci so poročali, da so izvedli reakcijo
Leta 2001 so objavili retrakcijo, potem ko raziskovalci v drugih laboratorijih in laboratorij v Berkeleyu niso mogli ponoviti rezultatov.[46] Junija 2002 je direktor laboratorija sporočil, da je prvotna trditev o odkritju teh dveh elementov temeljila na podatkih, ki jih je pridobil glavni avtor Victor Ninov.[47][48] Novejši eksperimentalni rezultati in teoretične napovedi so potrdile eksponentno zmanjšanje presekov s tarčami svinca in bizmuta, ko se atomsko število nastalega nuklida poveča.[49]
Poročila o odkritju
[uredi | uredi kodo]Prvi potrjen razpad atomov oganesona je leta 2002 na Združenem inštitutu za jedrske raziskave (JINR) v Dubni v Rusiji opazila skupna skupina ruskih in ameriških znanstvenikov. V skupini, ki jo je vodil Jurij Oganesjan, ruski jedrski fizik armenske narodnosti, so bili tudi ameriški znanstveniki iz Narodnega laboratorija Lawrence Livermore v Kaliforniji.[50] Odkritje ni bilo objavljeno takoj, saj se je energija razpada 294Og ujemala z energijo 212mPo, običajne nečistoče, ki nastane v fuzijskih reakcijah, namenjenih proizvodnji supertežkih elementov, zato je bila napoved odložena do potrditvenega eksperimenta leta 2005, ki je bil namenjen proizvodnji več atomov oganesona.[51] V poskusu iz leta 2005 je bila uporabljena drugačna energija snopa (251 MeV namesto 245 MeV) in debelina tarče (0,34 mg/cm2 namesto 0,23 mg/cm2 ). 9. oktobra 2006 so raziskovalci objavili, da so posredno odkrili skupno tri (morda štiri) jedra oganesona-294 (eno ali dve v letu 2002[52] in dve še v letu 2005), ki so nastali zaradi trkov atomov kalifornija-249 in ionov kalcija-48.[53][54][55][56][57]
Leta 2011 je IUPAC ocenil rezultate sodelovanja Dubna-Livermore iz leta 2006 in zaključil: "Trije dogodki, ki so poročali za izotop Z = 118 imajo zelo dobro notranjo redundanco, vendar brez povezave z znanimi jedri ne izpolnjujejo meril za odkritje."[58]
Zaradi zelo majhne verjetnosti fuzijske reakcije (fuzijski prerez je ~0,3–0,6 pb ali (3–6)×10−41 m2) je poskus trajal štiri mesece in je vključeval 25×1019 kalcijevih ionov, ki jih je bilo potrebno ustreliti v tarčo kalifornija, da se je ustvaril prvi zabeleženi dogodek, za katerega se domneva, da je sinteza oganesona.[59] Kljub temu so bili raziskovalci zelo prepričani, da rezultati niso lažno pozitivni, saj je verjetnost, da so bili zaznani naključni dogodki, ocenjena na manj kot enega na 100000.[60]
V poskusih so opazili alfa-razpad treh atomov oganesona. Predlagan je bil tudi četrti razpad z neposredno spontano cepitvijo. Izračunana razpolovna doba je bila 0,89 ms. 294
Og razpade na 290
Lv z alfa razpadom. Ker so bila narejena samo tri jedra, ima razpolovna doba, ki izhaja iz opazovanih življenjskih življenj, veliko negotovost (089+107
−031.)
- 294Og → 290Lv + 4He
Identifikacija 294
Og jedra je bila preverjena z ločenim ustvarjanjem domnevnega pridukta 290
Lv neposredno z bombardiranjem 245
Cm s 48
Ca ioni,
- 245Cm + 48Ca → 290Lv + 3 1Nt,
in preverjanjem, da se 290
Lv razpad ujema z verigo razpada 294
Og jedra. Hčerinsko jedro 290
Lv je zelo nestabilno z življenjsko dobo 14 milisekund in nato razpade na 286
Fl, ki lahko razpade s spontano cepitevijo ali z razpadom alfa v 282
Cn, ki bo razpadel s spontano cepitvijo.
Potrditev
[uredi | uredi kodo]En atom težjega izotopa 295Og je bil mogoče proizveden v poskusu leta 2011 v Centru za raziskave težkih ionov GSI Helmholtz v Darmstadtu v Nemčiji, katerega cilj je bila sinteza elementa 120 v reakciji 248Cm + 54Cr, vendar negotovost podatkov pomeni, da opazovane verige ni mogoče natančno dodeliti 299Ubn ali 295Og. Podatki kažejo, da ima 295Og razpolovni čas 181 milisekund, daljšega kot 294Og, ki je 0,7 milisekund.
Decembra 2015 sta Mednarodna zveza za čisto in uporabno kemijo (IUPAC) in Mednarodna zveza za osnovno in uporabno fiziko (IUPAP) prepoznala odkritje elementa in prednost odkritja dodelila sodelovanju med Dubno in Livermorom.[61] To je bila posledica potrditve dveh lastnosti produkta 294Og, 286Fl v letih 2009 in 2010 v Nacionalnem laboratoriju Lawrence v Berkeleyu, pa tudi opazovanja druge konstantne verige razpada 294Og skupine Dubna leta 2012. Cilj tega poskusa je bila sinteza 294Ts z reakcijo 249Bk(48Ca, 3n), vendar je kratka razpolovna doba 249Bk povzročila, da je velika količina berkelija razpadla na 249Cf, kar je povzročilo sintezo oganesona namesto tenesa.[62]
Skupina Dubna je od 1. oktobra 2015 do 6. aprila 2016 izvedla podoben eksperiment s snopom 48Ca, ustreljenim proti kalifornijevi tarči z mešanico izotopov 249Cf, 250Cf in 251Cf z namenom ustvariti težje izotope oganesona 295Og in 296Og. Uporabili so dve energiji 48Ca (252 MeV in 258 MeV). Pri nižji energiji atomov je bil opažen le en atom, katerega razpadna veriga je ustrezala že prej znanemu 294Og (ki se je končala s spontano cepitvijo 286Fl), pri višji energiji snopa pa nobenega. Poskus se je nato ustavil, saj je lepilo iz okvirjev sektorja prekrilo tarčo in preprečilo uhajanje ostankov izhlapevanja do detektorjev.[63] S to reakcijo je možna tudi proizvodnja 293Og in njegovega produkta, 289Lv ter še težji izotop 297Og. Izotopi 295Og in 296Og lahko nastanejo tudi v fuziji 248Cm s 50Ti projektili.[64][65] Iskanje 295Og, ki se je začelo poleti 2016 pri RIKEN v 3n kanalu te reakcije, ni bilo uspešno, čeprav naj bi študijo nadaljevali; podrobna analiza in meja preseka nista bili objavljeni. Ti težji in verjetno bolj stabilni izotopi so lahko koristni pri raziskovanju kemije oganesona.[66][67]
Poimenovanje
[uredi | uredi kodo]
Z uporabo Mendelejevega poimenovanja za neimenovane in neodkrite elemente je oganeson včasih znan kot eka-radon (do šestdesetih let 20. stoletja kot eka-emanacija, saj je emanacija staro ime za radon). Leta 1979 je IUPAC neodkritemu elementu dodelil sistematično nadomestno ime ununoktij s simbolom Uuo[68] in priporočil, da se uporablja do potrjenega odkritja elementa.[69] Čeprav so bila priporočila pogosto uporabljena v kemijski skupnosti na vseh ravneh, od učilnic kemije do poglobljenih učbenikov, so bila med znanstveniki s tega področja večinoma prezrta, ki so ga imenovali "element 118" s simbolom E118 (118) ali celo preprosto 118.
Pred retrakcijo leta 2001 so raziskovalci iz Berkeleyja nameravali element poimenovati giorsij (Gh), po Albertu Ghiorsu (vodilnem članu raziskovalne skupine).[70]
Ruski odkritelji so o svoji sintezi poročali leta 2006. V skladu s priporočili IUPAC imajo odkritelji novega elementa pravico predlagati ime.[71] Leta 2007 je vodja ruskega inštituta izjavil, da ekipa razmišlja o dveh imenih novega elementa: flerovij, v čast Georgija Fljorova, ustanovitelja raziskovalnega laboratorija v Dubni; in moskovij, v znak priznanja Moskovski oblasti, kjer se nahaja Dubna.[72] Izjavil je tudi, da čeprav je bil element odkrit kot ameriška kolaboracija, ki je zagotovila kalifornijsko tarčo, bi ga morali upravičeno poimenovati v čast Rusije, saj je bil Laboratorij za jedrske reakcije Fljorov pri JINR edini na svetu, ki bi lahko dosegel ta rezultat.[73] Ta imena so bila pozneje predlagana za element 114 (flerovij) in element 116 (moskovij).[74] Flerovij je postalo ime elementa 114; končno ime, predlagano za element 116, je bilo livermorij,[75] kasneje pa je bil moskovij predlagan in sprejet za element 115.[15]
Do sedaj se imena vseh žlahtnih plinov končajo na "-on", z izjemo helija, za katerega ob odkritju ni bilo znano, da je žlahtni plin. Smernice IUPAC, veljavne v trenutku odobritve odkritja, pa so zahtevale, da se vsi novi elementi poimenujejo s končnico "-ij" (v angleščini "-ium"), tudi če se izkaže, da so halogeni (ki se v angleščini končajo z "-ine") ali žlahtni plini.[76] Začasno ime ununoktij je tej konvenciji sledilo, novo priporočilo IUPAC, objavljeno leta 2016, pa priporoča uporabo končnice "-on" za nove elemente skupine 18, ne glede na to, ali imajo kemijske lastnosti žlahtnega plina.[77]
Znanstveniki, ki so sodelovali pri odkritju elementov 118, 117 in 115, so 23. marca 2016 organizirali konferenčni klic. Za element 118 se je ime določilo zadnje; potem ko so oganessiana pozvali, naj zapusti klic, so se preostali znanstveniki soglasno odločili, da ga bodo po njem poimenovali »oganeson«. Oganessian je bil že šestdeset let pionir v raziskavah supertežkih elementov, ki so segali nazaj do temeljev področja: njegova ekipa in predlagane tehnike so neposredno privedle do sinteze elementov od 107 do 118. Mark Stoyer, jedrski kemik pri LLNL, se je kasneje spominjal: "To ime smo nameravali predlagati iz Livermora, vendar je bilo predlagano hkrati z več krajev. Ne vem, ali lahko trdimo, da smo ime dejansko predlagali, vendar smo ga nameravali."[78]
V medsebojnih razpravah je IUPAC vprašal JINR, ali želijo, da se element, ki se sedaj kliče "oganeson", bolj ujema z ruskim črkovanjem. Oganessian in JINR sta to ponudbo zavrnila in navedla sovjetsko prakso transkripcije imen v latinsko abecedo v skladu s pravili francoskega jezika (takšna transkripcija je "Oganessian") in trdila, da bi bilo "oganeson" lažje povezati z osebo.[79][i] Junija 2016 je IUPAC objavil, da odkritelji nameravajo elementu dati ime oganeson (simbol Og). Ime je postalo uradno 28. novembra 2016.[15]
Slovesnost poimenovanja moskovija, tenesa in oganesona je bila 2. marca 2017 v Ruski akademiji znanosti v Moskvi.[80]
Značilnosti
[uredi | uredi kodo]Z izjemo jedrskih lastnosti niso bile izmerjene nobene lastnosti oganesona ali njegovih spojin; to je posledica izredno omejene in drage proizvodnje ter dejstva, da zelo hitro propada. Tako so na voljo le napovedi.
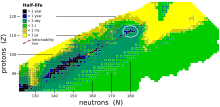
Stabilnost jeder se hitro zmanjša s povečanjem atomskega števila po kiriju, elementu 96, katerega razpolovni čas je štirikrat daljši od katerega koli naslednjega elementa. Vsi izotopi z atomskim številom nad 101 razpadejo in imajo razpolovne čase manj kot 30 ur. Noben element z atomskim številom nad 82 (po svincu) nima stabilnih izotopov.[81] To je zaradi vedno večjega Coulomovega odbijanja protonov, tako da močna jedrska sila ne more dolgo držati jedra skupaj pred spontano cepitvijo. Izračuni kažejo, da v odsotnosti drugih stabilizirajočih dejavnikov ne bi smeli obstajati elementi z več kot 104 protoni,[82] vendar so raziskovalci v šestdesetih letih predlagali, da bi zaprte jedrske lupine okoli 114 protonov in 184 nevtronov morale odpraviti to nestabilnost in ustvariti otok stabilnosti, v katerem bi lahko razpolovni čas nuklidov dosegel tisoče ali milijone let. Medtem ko znanstveniki še vedno niso prišli do otoka, že sam obstoj supertežkih elementov (vključno z oganesonom) potrjuje, da je ta stabilizacijski učinek resničen, in na splošno znani supertežki nuklidi postanejo eksponentno daljši, ko se približujejo predvideni lokaciji otoka.[83][84] oganeson je radioaktiven in njegov razpolovni čas je krajši od milisekunde. Kljub temu je to še vedno dlje od nekaterih napovedanih vrednosti,[85][86] kar daje nadaljnjo podporo ideji o otoku stabilnosti.[87]
Izračuni z uporabo modela kvantnega tuneliranja napovedujejo obstoj več težjih izotopov oganesona z razpolovnimi časi alfa razpada blizu 1 ms.[88][89]
Teoretični izračuni in razpolovna doba drugih izotopov so pokazali, da bi lahko bili nekateri nekoliko stabilnejši od sintetiziranega izotopa 294Og, najverjetneje 293Og, 295Og, 296Og, 297Og, 298Og, 300Og in 302Og (zadnji doseže N = 184 oz. polno lupino).[90] 297Og bi lahko zagotovil najboljše možnosti za pridobitev stabilnejših jeder[85] in bi tako lahko postal središče prihodnjega dela s tem elementom. Nekateri izotopi z veliko več nevtroni, na primer nekateri, ki se nahajajo okoli 313Og, bi lahko zagotovili tudi dolgotrajnejša jedra.[91]
V modelu kvantnega tuneliranja naj bi bila razpolovna doba alfa razpada 294
Og 066+023
−018[85] z eksperimentalno vrednostjo Q, objavljeno leta 2004.[92] Izračun s teoretičnimi vrednostmi Q iz makroskopsko-mikroskopskega modela Muntian-Hofman-Patyk-Sobiczewski daje nekoliko nižje, a primerljive rezultate.[93]
Izračunane atomske in fizikalne lastnosti
[uredi | uredi kodo]oganeson je član 18. skupine, elementov brez valenčnih elektronov. Člani te skupine Običajno ne reagirajo (na primer gorijo), ker je zunanja valenčna lupina popolnoma napolnjena z osmimi elektroni. To ustvari stabilno, minimalno energetsko konfiguracijo, v kateri so zunanji elektroni tesno vezani.[94] Podobno je najbrž tudi pri oganesonu, ki naj bi prav tako imel polno zunanjo valenčno lupino, v kateri so njegovi valenčni elektroni razporejeni v konfiguraciji 7s2 7p6.
Nekateri zato pričakujejo, da ima oganeson podobne fizikalne in kemijske lastnosti kot drugi člani njegove skupine, z največjo podobnostjo z žlahtnim plinom takoj nad njim v periodnem sistemu, radonu.[95] Po trendu v periodnem sistemu naj bi bil oganeson nekoliko bolj reaktiven kot radon. Teoretični izračuni pa so pokazali, da bi lahko bil bistveno bolj reaktiven. Poleg tega, da je bolj reaktiven kot radon, bi lahko bil oganeson še bolj reaktiven od flerovija in kopernicija, ki so težji homologi več kemijsko aktivnih elementov svinca in živega srebra. Razlog za morebitno povečanje kemijske aktivnosti oganesona glede na radon je energijska destabilizacija in radialno širjenje zadnje zasedene 7p podlupine. Natančneje, precejšnje interakcije med spinom in tirom med 7p elektroni in inertnimi 7s elektroni učinkovito privedejo do drugačnega zaprtja valenčne lupine pri fleroviju in občutnega zmanjšanja stabilizacije zaprte lupine oganesona. Izračunano je bilo tudi, da oganeson v nasprotju z drugimi žlahtnimi plini veže elektron s sproščanjem energije, ali z drugimi besedami, kaže pozitivno elektronsko afiniteto[96][97] zaradi relativistično stabilizirane ravni energije 8s in destabilizirane 7p3/2 ravni,[98] medtem ko napovedujejo, da kopernicij in flerovij nimata elektronske afinitete.[99][100] Kljub temu, kvantno-elektrodinamični popravki so se izkazali za zelo pomembne pri zmanjševanju afinitete z zmanjševanjem v vezave v anionu Og− za 9%, kar potrjuje pomembnost teh popravkov v supertežkih elementih.
Oganeson naj bi imel izjemno široko polarizacijo, skoraj dvakrat večjo od radona. Z uporabo simulacij Monte Carlo in metod molekularne dinamike, primerjanih z zelo natančnimi izračuni relativističnih skupkov, bi lahko pokazali, da ima oganeson tališče 325±15 K in vrelišče 450±10 K. Glavni razlog za to vedenje lahko najdemo v spin-tir relativističnih učinkih (nerelativistični oganeson bi se topil okoli 220 K). Točno določeno tališče za oganeson se zelo razlikuje od predhodno ocenjenih vrednosti 263 K[101] oz. 247 K za vrelišče.[102] Tako se zdi malo verjetno, da bi bil oganeson v običajnih pogojih plin in ker je obseg tekočega stanja drugih plinov zelo ozek, med 2 in 9 kelvini, bi moral biti ta element pod standardnimi pogoji trden. Če je oganeson plin pri standardnih pogojih, bi bil eden izmed najgostejših plinastih snovi pri standardnih pogojih, četudi je monoatomski kot drugi žlahtni plini.
Zaradi svoje izjemne polarizirabilnosti naj bi imel oganeson izjemno nizko ionizacijsko energijo (860,1 kJ / mol), podobno kot pri kadmiju in manjšo kot pri iridiju, platini in zlatu. To je bistveno manjše od vrednosti, predvidenih za darmštadtij, rentgenij in kopernicij, čeprav je večja od vrednosti, predvidene za flerovij.[103] Tudi na strukturo lupine v jedru in elektronskem oblaku oganesona močno vplivajo relativistični učinki: valenčna in jedrna elektronska podlupina v oganesonu naj bi bili "zabrisani" v homogenem Fermijevem plinu elektronov, za razliko od tistih iz "manj relativističnega" radona in ksenona (čeprav v radonu obstaja nekaj začetne delokalizacije) zaradi zelo močne spin-tir delitve 7p orbital v oganesonu. Podoben učinek se pojavi tudi pri nukleonih, zlasti nevtronih, vendar se začne šele v jedru polne nevtronske lupine 302Og in še posebej velja za hipotetično supertežko jedro zaprte lupine 472164 s 164 protoni in 308 nevtroni.[104] Poleg tega lahko učinki med spinom in tirom povzročijo, da je oganeson polprevodnik, medtem ko so vsi lažji žlahtni plini izolatorji s prepovedanim pasom 15±06 eV (za radon bi morala biti 71±05 eV).
Spojine
[uredi | uredi kodo]

4 naj bi imel tetraedrično molekularno geometrijo.
Edini potrjeni izotop oganesona, 294Og, ima veliko prekratek razpolovni čas, da bi mu lahko eksperimenalno določili kemične lastnosti, zato še niso bile sintetizirane nobene spojine oganesona.[51] Kljub temu se izračuni za teoretične spojine izvajajo od leta 1964. Predvideno je, da če bo ionizacijska energija elementa dovolj visoka, ga bo težko oksidirati, zato bi bilo najpogostejše oksidacijsko stanje 0 (kot pri žlahtnih plinih);[105] kljub temu se zdi, da temu ni tako.
Izračuni na dvoatomni molekuli Og
2 so pokazali vezno interakcijo, ki je približno enakovredna tisti, izračunani za Hg
2 in disociacijsko energijo 6 kJ/mol, približno 4-krat več kot Rn
2. Najbolj presenetljivo pa je dejstvo, da je bilo izračunano, da ima dolžino vezi krajšo kot Rn
2 za 0,16 Å, kar bi kazalo na pomembno vezno interakcijo. Po drugi strani pa spojina OgH+ kaže disociacijsko energijo (z drugimi besedami protonsko afiniteto oganesona), ki je manjša od energije RnH+.
Vezava med oganesonom in vodikom v OgH naj bi bila zelo šibka in jo je mogoče obravnavati kot čisto van der Waalsovo interakcijo in ne kot pravo kemično vez. Po drugi strani pa izgleda, da z zelo elektronegativnimi elementi tvori več stabilnih spojin za razliko od na primer kopernicija ali flerovija. V fluoridih OgF
2 in OgF
4 naj bi obstajala oksidacijska stanja +2 in +4.[106] Oksidacijsko stanje +6 bi bilo manj stabilno zaradi močne vezave podlupine 7p1/2. To je posledica istih interakcij med spinom in tirom, zaradi katerih je oganeson nenavadno reaktiven. Na primer, pokazalo se je, da reakcija oganesona s F
2, ki bi tvorila spojino OgF
2 sprosti energijo 106 kcal/mol, od tega približno 46 kcal/mol iz teh interakcij. Za primerjavo, interacija v RnF
2, najbolj podobni molekuli, je približno 10 kcal/mol od celotne energije 49 kcal/mol. Ista interakcija stabilizira tetraedrično konfiguracijo Td za OgF
4, za razliko od kvadratno planarne D4h, ki jo ima XeF4 in najbrž tudi RnF
4; to je zato, ker naj bi imel OgF4 dva inertna elektronska para (7s in 7p1/2 ). Kot tak se pričakuje, da OgF6 ne bo vezan, kar bo nadaljevalo pričakovani trend destabilizacije oksidacijskega stanja +6 (RnF6 naj bi bil tudi manj stabilen kot XeF6).[107][108] Vez Og-F bo najverjetneje ionska in ne kovalentna, zaradi česar bodo oganesonovi fluoridi nehlapni.[109] OgF2 naj bi bil delno ionski zaradi visoke elektropozitivnosti oganesona.[110] Za razliko od drugih žlahtnih plinov (razen po možnosti ksenona in radona) je[111][112] napovedano, da je oganeson dovolj elektropozitiven da tvori Og-Cl vez s klorom.
Opombe
[uredi | uredi kodo]- ↑ V jedrski fiziki se element imenuje težek, če je njegovo atomsko število visoko; svinec (element 82) je en primer takega težkega elementa. Izraz "supertežki elementi" se običajno nanaša na elemente z atomskim številom, večjim od 103 (čeprav obstajajo tudi druge opredelitve, kot na primer, večje od 100[17] or 112;[18] sometimes, the term is presented an equivalent to the term "transactinide", which puts an upper limit before the beginning of the hypothetical superactinide series).[19] Izraz "težek izotop" (danega elementa) in "težko jedro" pomenita tisto, kar bi lahko razumeli v običajnem jeziku – izotop z veliko maso (za dani element) oziroma jedro z veliko maso.
- ↑ Leta 2009 je skupina pri JINR pod vodstvom Oganessiana objavila rezultate svojega poskusa ustvariti hasij s simetrično 136Xe + 136Xe reakcijo. V takšni reakciji niso opazili niti enega atoma, pri čemer je bila zgornja meja preseka, merilo verjetnosti jedrske reakcije, 2,5 pb.[20] Za primerjavo, reakcija, ki je privedla do odkritja hasija, 208Pb + 58Fe, je imela prerez ~ 20 pb (natančneje 19 + 19
−11 pb), kot so ocenili odkritelji.[21] - ↑ Večja kot je energija vzbujenja, več nevtronov se izvrže. Če je energija vzbujanja nižja od energije, ki veže posamezen nevtron na preostanek jedra, se nevtroni ne izvržejo; namesto tega se jedro spojine de-ekscitira z oddajanjem žarkov gama.[25]
- ↑ Definicija Skupne delovne skupine IUPAC-a in IUPAP-a pravi, da je kemični element mogoče prepoznati kot odkritega le, če njegovo jedro ne razpade v 10−14 sekunde. Ta vrednost je bila izbrana kot ocena, koliko časa jedro potrebuje, da pridobi svoje zunanje elektrone in tako prikaže svoje kemijske lastnosti.[26] To število označuje tudi splošno sprejeto zgornjo mejo za razpolovno dobo sestavljenega jedra.[27]
- ↑ Ta ločitev temelji na tem, da se nastala jedra počasneje premikajo mimo tarče kot nereagirana jedra žarka. Ločilec vsebuje električna in magnetna polja, katerih učinki na premikajoče se delce se pri določeni hitrosti izničijo. [29] Takšnemu ločevanju lahko pomaga tudi meritev časa potovanja delca in meritev energije odboja; kombinacija obeh lahko omogoči oceno mase jedra.[30]
- ↑ Vseh načinov razpada ne povzroča elektrostatični naboj. Na primer, razpad beta povzroča šibka jedrska sila.[35]
- ↑ Ker se masa jedra ne meri neposredno, temveč se izračuna na podlagi mase drugega jedra, se takšna meritev imenuje posredna. Možne so tudi neposredne meritve, ki pa večinoma niso na voljo za najtežja jedra.[36] O prvem neposrednem merjenju mase težkega jedra so poročali leta 2018 pri LBNL.[37] Masa je bila določena z lokacijo jedra po prenosu (lokacija pomaga določiti njegovo smer, ki je povezana z razmerjem med maso in nabojem jedra, saj je bil prenos opravljen v prisotnosti magneta).[38]
- ↑ Spontano fisijo je odkril sovjetski fizik Georgij Flerov,[39] glavni znanstvenik pri JINR in je bil to za ustanovo "hobi".[40] Za razliko so znanstveniki pri LBL menili, da informacije o cepitvi niso zadostne za trditev o sintezi elementa. Verjeli so, da spontana cepitev ni bila dovolj raziskana, da bi jo lahko uporabili za identifikacijo novega elementa, saj je bilo težko ugotoviti, da je jedro spojine izvrglo samo nevtrone in ne tudi nabite delce, kot so protoni ali delci alfa.[27] Tako so nove izotope raje povezali z že znanimi zaporednimi alfa razpadi.[39]
- ↑ V ruščini se ime Oganessian napiše Оганесян /ˈɐgənʲɪˈsʲan/; prečrkovanje v skladu s pravili slovenskega jezika bi bilo "Oganesjan". Podobno bi bilo tudi z ruskim imenom elementa оганесон, "oganesjon". Oganessian je rusificirana različica armenskega priimka Hovhannisyan (Հովհաննիսյան /hɔvhɑnnisˈjɑn/), kar pomeni "sin Hovhannesa", torej "Janezov sin". To je najpogostejši priimek v Armeniji.
Glej tudi
[uredi | uredi kodo]- Izotopi oganesona
- Alotropi oganesona
- Oganesonove organske spojine
- Oganesonove anorganske spojine
- Radioaktivnost
- Žlahtni plin
- Radon
- Jurij Oganesjan
Sklici
[uredi | uredi kodo]- ↑ Nash, Clinton S. (2005). »Atomic and Molecular Properties of Elements 112, 114, and 118«. Journal of Physical Chemistry A. 109 (15): 3493–3500. Bibcode:2005JPCA..109.3493N. doi:10.1021/jp050736o. PMID 16833687.
- ↑ 2,0 2,1 2,2 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). »Transactinides and the future elements«. V Morss; Edelstein, Norman M.; Fuger, Jean (ur.). The Chemistry of the Actinide and Transactinide Elements (3rd izd.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- ↑ 3,0 3,1 3,2 3,3 Smits, Odile; Mewes, Jan-Michael; Jerabek, Paul; Schwerdtfeger, Peter (2020). »Oganesson: A Noble Gas Element That Is Neither Noble Nor a Gas«. Angew. Chem. Int. Ed. 59 (52): 23636-23640. doi:10.1002/anie.202011976.
- ↑ 4,0 4,1 4,2 Eichler, R.; Eichler, B., Thermochemical Properties of the Elements Rn, 112, 114, and 118 (PDF), Paul Scherrer Institut, pridobljeno 23. oktobra 2010
- ↑ Han, Young-Kyu; Bae, Cheolbeom; Son, Sang-Kil; Lee, Yoon Sup (2000). »Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118)«. Journal of Chemical Physics. 112 (6): 2684. Bibcode:2000JChPh.112.2684H. doi:10.1063/1.480842.
- ↑ 6,0 6,1 Kaldor, Uzi; Wilson, Stephen (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. str. 105. ISBN 978-1402013713. Pridobljeno 18. januarja 2008.
- ↑ Pershina, Valeria. »Theoretical Chemistry of the Heaviest Elements«. V Schädel, Matthias; Shaughnessy, Dawn (ur.). The Chemistry of Superheavy Elements (2nd izd.). Springer Science & Business Media. str. 154. ISBN 9783642374661.
- ↑ Fricke, Burkhard (1975). »Superheavy elements: a prediction of their chemical and physical properties«. Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding. Zv. 21. str. 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. Pridobljeno 4. oktobra 2013.
- ↑ Oganesson - Element information, properties and uses, Royal Chemical Society
- ↑ Grosse, A. V. (1965). »Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)«. Journal of Inorganic and Nuclear Chemistry. Elsevier Science Ltd. 27 (3): 509–19. doi:10.1016/0022-1902(65)80255-X.
- ↑ Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Sagaidak, R. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; in sod. (9. oktober 2006). »Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions«. Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Pridobljeno 18. januarja 2008.
- ↑ Oganessian, Yuri Ts.; Rykaczewski, Krzysztof P. (Avgust 2015). »A beachhead on the island of stability«. Physics Today. 68 (8): 32–38. Bibcode:2015PhT....68h..32O. doi:10.1063/PT.3.2880. OSTI 1337838.
- ↑ Staff (30. november 2016). »IUPAC Announces the Names of the Elements 113, 115, 117, and 118«. IUPAC. Pridobljeno 1. decembra 2016.
- ↑ St. Fleur, Nicholas (1. december 2016). »Four New Names Officially Added to the Periodic Table of Elements«. The New York Times. Pridobljeno 1. decembra 2016.
- ↑ 15,0 15,1 15,2 Oganessian, Yuri (16. marec 2007). »IUPAC Is Naming The Four New Elements Nihonium, Moscovium, Tennessine, And Oganesson«. Journal of Physics G: Nuclear Physics. 34 (4): R165–R242. Bibcode:2007JPhG...34R.165O. doi:10.1088/0954-3899/34/4/R01. Pridobljeno 8. junija 2016.
- ↑ »The Top 6 Physics Stories of 2006«. Discover Magazine. 7. januar 2007. Arhivirano iz prvotnega spletišča dne 12. oktobra 2007. Pridobljeno 18. januarja 2008.
- ↑ Krämer, K. (2016). »Explainer: superheavy elements«. Chemistry World. Pridobljeno 15. marca 2020.
- ↑ »Discovery of Elements 113 and 115«. Lawrence Livermore National Laboratory. Arhivirano iz prvotnega spletišča dne 11. septembra 2015. Pridobljeno 15. marca 2020.
- ↑ Eliav, E.; Kaldor, U.; Borschevsky, A. (2018). »Electronic Structure of the Transactinide Atoms«. V Scott, R. A. (ur.). Encyclopedia of Inorganic and Bioinorganic Chemistry. John Wiley & Sons. str. 1–16. doi:10.1002/9781119951438.eibc2632. ISBN 978-1-119-95143-8.
- ↑ Oganessian, Yu. Ts.; Dmitriev, S. N.; Yeremin, A. V.; in sod. (2009). »Attempt to produce the isotopes of element 108 in the fusion reaction 136Xe + 136Xe«. Physical Review C. 79 (2): 024608. doi:10.1103/PhysRevC.79.024608. ISSN 0556-2813.
- ↑ Münzenberg, G.; Armbruster, P.; Folger, H.; in sod. (1984). »The identification of element 108« (PDF). Zeitschrift für Physik A. 317 (2): 235–236. Bibcode:1984ZPhyA.317..235M. doi:10.1007/BF01421260. Arhivirano iz prvotnega spletišča (PDF) dne 7. junija 2015. Pridobljeno 20. oktobra 2012.
- ↑ Subramanian, S. (2019). »Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist«. Bloomberg Businessweek. Pridobljeno 18. januarja 2020.
- ↑ 23,0 23,1 Ivanov, D. (2019). »Сверхтяжелые шаги в неизвестное« [Superheavy steps into the unknown]. N+1 (v ruščini). Pridobljeno 2. februarja 2020.
- ↑ Hinde, D. (2014). »Something new and superheavy at the periodic table«. The Conversation. Pridobljeno 30. januarja 2020.
- ↑ 25,0 25,1 Krása, A. (2010). »Neutron Sources for ADS« (PDF). Czech Technical University in Prague. str. 4–8. Arhivirano iz prvotnega spletišča (PDF) dne 3. marca 2019. Pridobljeno 20. oktobra 2019.
- ↑ Wapstra, A. H. (1991). »Criteria that must be satisfied for the discovery of a new chemical element to be recognized« (PDF). Pure and Applied Chemistry. 63 (6): 883. doi:10.1351/pac199163060879. ISSN 1365-3075. Pridobljeno 28. avgusta 2020.
- ↑ 27,0 27,1 Hyde, E. K.; Hoffman, D. C.; Keller, O. L. (1987). »A History and Analysis of the Discovery of Elements 104 and 105«. Radiochimica Acta. 42 (2): 67–68. doi:10.1524/ract.1987.42.2.57. ISSN 2193-3405.
- ↑ 28,0 28,1 28,2 Chemistry World (2016). »How to Make Superheavy Elements and Finish the Periodic Table [Video]«. Scientific American. Pridobljeno 27. januarja 2020.
- ↑ Hoffman 2000, str. 334.
- ↑ Hoffman 2000, str. 335.
- ↑ Zagrebaev 2013, str. 3.
- ↑ Beiser 2003, str. 432.
- ↑ Staszczak, A.; Baran, A.; Nazarewicz, W. (2013). »Spontaneous fission modes and lifetimes of superheavy elements in the nuclear density functional theory«. Physical Review C. 87 (2): 024320–1. arXiv:1208.1215. Bibcode:2013PhRvC..87b4320S. doi:10.1103/physrevc.87.024320. ISSN 0556-2813.
- ↑ Audi 2017, str. ;030001-128–030001-138.
- ↑ Beiser 2003, str. 439.
- ↑ Oganessian, Yu. Ts.; Rykaczewski, K. P. (2015). »A beachhead on the island of stability«. Physics Today. 68 (8): 32–38. Bibcode:2015PhT....68h..32O. doi:10.1063/PT.3.2880. ISSN 0031-9228. OSTI 1337838.
- ↑ Grant, A. (2018). »Weighing the heaviest elements«. Physics Today. doi:10.1063/PT.6.1.20181113a.
- ↑ Howes, L. (2019). »Exploring the superheavy elements at the end of the periodic table«. Chemical & Engineering News. Pridobljeno 27. januarja 2020.
- ↑ 39,0 39,1 Robinson, A. E. (2019). »The Transfermium Wars: Scientific Brawling and Name-Calling during the Cold War«. Distillations. Pridobljeno 22. februarja 2020.
- ↑ »Популярная библиотека химических элементов. Сиборгий (экавольфрам)« [Popular library of chemical elements. Seaborgium (eka-tungsten)]. n-t.ru (v ruščini). Arhivirano iz prvotnega spletišča dne 23. avgusta 2011. Pridobljeno 7. januarja 2020. Reprinted from »Экавольфрам« [Eka-tungsten]. Популярная библиотека химических элементов. Серебро — Нильсборий и далее [Popular library of chemical elements. Silver through nielsbohrium and beyond] (v ruščini). Nauka. 1977.
- ↑ Kragh 2018, str. 6.
- ↑ Leach, Mark R. »The INTERNET Database of Periodic Tables«. Pridobljeno 8. julija 2016.
- ↑ Kenneth, Pitzer (1975). »Are elements 112, 114, and 118 relatively inert gases?«. The Journal of Chemical Physics. 2 (63): 1032–1033.
- ↑ Smolanczuk, R. (1999). »Production mechanism of superheavy nuclei in cold fusion reactions«. Physical Review C. 59 (5): 2634–2639. Bibcode:1999PhRvC..59.2634S. doi:10.1103/PhysRevC.59.2634.
- ↑ Service, R. F. (1999). »Berkeley Crew Bags Element 118«. Science. 284 (5421): 1751. doi:10.1126/science.284.5421.1751.
- ↑ Public Affairs Department (21. julij 2001). »Results of element 118 experiment retracted«. Berkeley Lab. Arhivirano iz prvotnega spletišča dne 29. januarja 2008. Pridobljeno 18. januarja 2008.
- ↑ Dalton, R. (2002). »Misconduct: The stars who fell to Earth«. Nature. 420 (6917): 728–729. Bibcode:2002Natur.420..728D. doi:10.1038/420728a. PMID 12490902.
- ↑ Element 118 disappears two years after it was discovered. Physicsworld.com. Retrieved on 2 April 2012.
- ↑ Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). »Future of superheavy element research: Which nuclei could be synthesized within the next few years?« (PDF). Journal of Physics. 420 (1): 012001. arXiv:1207.5700. Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001.
- ↑ Oganessian, Yu. T.; in sod. (2002). »Results from the first 249
Cf+48
Ca experiment« (PDF). JINR Communication. Arhivirano iz prvotnega spletišča (PDF) dne 13. decembra 2004. Pridobljeno 13. junija 2009. - ↑ 51,0 51,1 Moody, Ken (30. november 2013). »Synthesis of Superheavy Elements«. V Schädel, Matthias (ur.). The Chemistry of Superheavy Elements (2. izd.). Springer Science & Business Media. str. 24–8. ISBN 9783642374661.
- ↑ Oganessian, Yu. T.; in sod. (2002). »Element 118: results from the first 249
Cf
+ 48
Ca
experiment«. Communication of the Joint Institute for Nuclear Research. Arhivirano iz prvotnega spletišča dne 22. julija 2011. - ↑ »Livermore scientists team with Russia to discover element 118«. Livermore press release. 3. december 2006. Arhivirano iz prvotnega spletišča dne 17. oktobra 2011. Pridobljeno 18. januarja 2008.
- ↑ Oganessian, Yu. T. (2006). »Synthesis and decay properties of superheavy elements«. Pure Appl. Chem. 78 (5): 889–904. doi:10.1351/pac200678050889.
- ↑ Sanderson, K. (2006). »Heaviest element made – again«. Nature News. doi:10.1038/news061016-4.
- ↑ Schewe, P.; Stein, B. (17. oktober 2006). »Elements 116 and 118 Are Discovered«. Physics News Update. American Institute of Physics. Arhivirano iz prvotnega spletišča dne 1. januarja 2012. Pridobljeno 18. januarja 2008.
- ↑ Weiss, R. (17. oktober 2006). »Scientists Announce Creation of Atomic Element, the Heaviest Yet«. Washington Post. Pridobljeno 18. januarja 2008.
- ↑ Barber, Robert C.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). »Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)«. Pure and Applied Chemistry. 83 (7): 1. doi:10.1351/PAC-REP-10-05-01.
- ↑ »Oganesson«. WebElements Periodic Table. Pridobljeno 19. avgusta 2019.
- ↑ Jacoby, Mitch (17. oktober 2006). »Element 118 Detected, With Confidence«. Chemical & Engineering News. 84 (43): 11. doi:10.1021/cen-v084n043.p011. Pridobljeno 18. januarja 2008.
I would say we're very confident.
- ↑ Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 Arhivirano 2015-12-31 na Wayback Machine.. IUPAC (30 December 2015)
- ↑ Karol, Paul J.; Barber, Robert C.; Sherrill, Bradley M.; Vardaci, Emanuele; Yamazaki, Toshimitsu (29. december 2015). »Discovery of the element with atomic number Z = 118 completing the 7th row of the periodic table (IUPAC Technical Report)«. Pure Appl. Chem. 88 (1–2): 155–160. doi:10.1515/pac-2015-0501.
- ↑ Voinov, A. A.; Oganessian, Yu. Ts; Abdullin, F. Sh.; Brewer, N. T.; Dmitriev, S. N.; Grzywacz, R. K.; Hamilton, J. H.; Itkis, M. G.; Miernik, K. (2016). Results from the Recent Study of the 249–251Cf + 48Ca Reactions. Exotic Nuclei. str. 219–223. ISBN 9789813226555.
- ↑ Sychev, Vladimir (8. februar 2017). »Юрий Оганесян: мы хотим узнать, где кончается таблица Менделеева« [Yuri Oganessian: we want to know where the Mendeleev table ends]. RIA Novosti (v ruščini). Pridobljeno 31. marca 2017.
- ↑ Roberto, J. B. (31. marec 2015). »Actinide Targets for Super-Heavy Element Research« (PDF). cyclotron.tamu.edu. Texas A & M University. Pridobljeno 28. aprila 2017.
- ↑ Hauschild, K. (26. junij 2019). Superheavy nuclei at RIKEN, Dubna, and JYFL (PDF). Conseil Scientifique de l'IN2P3. Pridobljeno 31. julija 2019.
- ↑ Hauschild, K. (2019). Heavy nuclei at RIKEN, Dubna, and JYFL (PDF). Conseil Scientifique de l'IN2P3. Pridobljeno 1. avgusta 2019.
- ↑ Chatt, J. (1979). »Recommendations for the Naming of Elements of Atomic Numbers Greater than 100«. Pure Appl. Chem. 51 (2): 381–384. doi:10.1351/pac197951020381.
- ↑ Wieser, M.E. (2006). »Atomic weights of the elements 2005 (IUPAC Technical Report)«. Pure Appl. Chem. 78 (11): 2051–2066. doi:10.1351/pac200678112051.
- ↑ »Discovery of New Elements Makes Front Page News«. Berkeley Lab Research Review Summer 1999. 1999. Pridobljeno 18. januarja 2008.
- ↑ Koppenol, W. H. (2002). »Naming of new elements (IUPAC Recommendations 2002)« (PDF). Pure and Applied Chemistry. 74 (5): 787. doi:10.1351/pac200274050787.
- ↑ »New chemical elements discovered in Russia's Science City«. 12. februar 2007. Pridobljeno 9. februarja 2008.
- ↑ Yemel'yanova, Asya (17. december 2006). »118-й элемент назовут по-русски (118th element will be named in Russian)« (v ruščini). vesti.ru. Pridobljeno 18. januarja 2008.
- ↑ »Российские физики предложат назвать 116 химический элемент московием (Russian Physicians Will Suggest to Name Element 116 Moscovium)« (v ruščini). rian.ru. 2011. Pridobljeno 8. maja 2011.
- ↑ »News: Start of the Name Approval Process for the Elements of Atomic Number 114 and 116«. International Union of Pure and Applied Chemistry. Arhivirano iz prvotnega spletišča dne 23. avgusta 2014. Pridobljeno 2. decembra 2011.
- ↑ Koppenol, W. H. (2002). »Naming of new elements (IUPAC Recommendations 2002)« (PDF). Pure and Applied Chemistry. 74 (5): 787–791. doi:10.1351/pac200274050787.
- ↑ Koppenol, Willem H.; Corish, John; García-Martínez, Javier; Meija, Juris; Reedijk, Jan (2016). »How to name new chemical elements (IUPAC Recommendations 2016)« (PDF). Pure and Applied Chemistry. 88 (4): 401–405. doi:10.1515/pac-2015-0802.
- ↑ »What it takes to make a new element«. Chemistry World. Pridobljeno 3. decembra 2016.
- ↑ Tarasevich, Grigoriy; Lapenko, Igor (2019). »Юрий Оганесян о тайнах ядра, новых элементах и смысле жизни« [Yuri Oganessian about the secret of the nucleus, new elements and the meaning of life] (v ruščini). Št. Special. Direktsiya Festivalya Nauki. str. 22.
{{navedi revijo}}: Sklic magazine potrebuje|magazine=(pomoč) - ↑ Fedorova, Vera (3. marec 2017). »At the inauguration ceremony of the new elements of the Periodic table of D.I. Mendeleev«. jinr.ru. Joint Institute for Nuclear Research. Pridobljeno 4. februarja 2018.
- ↑ de Marcillac, P.; Coron, N.; Dambier, G.; in sod. (2003). »Experimental detection of α-particles from the radioactive decay of natural bismuth«. Nature. 422 (6934): 876–878. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201.
- ↑ Möller, P. (2016). »The limits of the nuclear chart set by fission and alpha decay« (PDF). EPJ Web of Conferences. 131: 03002:1–8. Bibcode:2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002.
- ↑ Considine, G. D.; Kulik, Peter H. (2002). Van Nostrand's scientific encyclopedia (9. izd.). Wiley-Interscience. ISBN 978-0-471-33230-5. OCLC 223349096.
- ↑ Oganessian, Yu. Ts.; Sobiczewski, A.; Ter-Akopian, G. M. (9. januar 2017). »Superheavy nuclei: from predictions to discovery«. Physica Scripta. 92 (2): 023003–1–21. Bibcode:2017PhyS...92b3003O. doi:10.1088/1402-4896/aa53c1.
- ↑ 85,0 85,1 85,2 Chowdhury, Roy P.; Samanta, C.; Basu, D. N. (2006). »α decay half-lives of new superheavy elements«. Phys. Rev. C. 73 (1): 014612. arXiv:nucl-th/0507054. Bibcode:2006PhRvC..73a4612C. doi:10.1103/PhysRevC.73.014612.
- ↑ Oganessian, Yu. T. (2007). »Heaviest nuclei from 48Ca-induced reactions«. Journal of Physics G: Nuclear and Particle Physics. 34 (4): R165–R242. Bibcode:2007JPhG...34R.165O. doi:10.1088/0954-3899/34/4/R01.
- ↑ »New Element Isolated Only Briefly«. The Daily Californian. 18. oktober 2006. Arhivirano iz prvotnega spletišča dne 23. avgusta 2014. Pridobljeno 18. januarja 2008.
- ↑ Chowdhury, Roy P.; Samanta, C.; Basu, D. N. (2008). »Search for long lived heaviest nuclei beyond the valley of stability«. Physical Review C. 77 (4): 044603. arXiv:0802.3837. Bibcode:2008PhRvC..77d4603C. doi:10.1103/PhysRevC.77.044603.
- ↑ Chowdhury, R. P.; Samanta, C.; Basu, D.N. (2008). »Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130«. Atomic Data and Nuclear Data Tables. 94 (6): 781–806. arXiv:0802.4161. Bibcode:2008ADNDT..94..781C. doi:10.1016/j.adt.2008.01.003.
- ↑ Royer, G.; Zbiri, K.; Bonilla, C. (2004). »Entrance channels and alpha decay half-lives of the heaviest elements«. Nuclear Physics A. 730 (3–4): 355–376. arXiv:nucl-th/0410048. Bibcode:2004NuPhA.730..355R. doi:10.1016/j.nuclphysa.2003.11.010.
- ↑ Duarte, S. B.; Tavares, O. A. P.; Gonçalves, M.; Rodríguez, O.; Guzmán, F.; Barbosa, T. N.; García, F.; Dimarco, A. (2004). »Half-life predictions for decay modes of superheavy nuclei« (PDF). Journal of Physics G: Nuclear and Particle Physics. 30 (10): 1487–1494. Bibcode:2004JPhG...30.1487D. CiteSeerX 10.1.1.692.3012. doi:10.1088/0954-3899/30/10/014.
- ↑ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G.; Bogomolov, S.; Gikal, B. N.; in sod. (2004). »Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233,238U, 242Pu, and 248Cm+48Ca« (PDF). Physical Review C. 70 (6): 064609. Bibcode:2004PhRvC..70f4609O. doi:10.1103/PhysRevC.70.064609.
- ↑ Samanta, C.; Chowdhury, R. P.; Basu, D.N. (2007). »Predictions of alpha decay half-lives of heavy and superheavy elements«. Nucl. Phys. A. 789 (1–4): 142–154. arXiv:nucl-th/0703086. Bibcode:2007NuPhA.789..142S. doi:10.1016/j.nuclphysa.2007.04.001.
- ↑ Bader, Richard F.W. »An Introduction to the Electronic Structure of Atoms and Molecules«. McMaster University. Pridobljeno 18. januarja 2008.
- ↑ »Ununoctium (Uuo) – Chemical properties, Health and Environmental effects«. Lenntech. Arhivirano iz prvotnega spletišča dne 16. januarja 2008. Pridobljeno 18. januarja 2008.
- ↑ Goidenko, Igor; Labzowsky, Leonti; Eliav, Ephraim; Kaldor, Uzi; Pyykkö, Pekka (2003). »QED corrections to the binding energy of the eka-radon (Z=118) negative ion«. Physical Review A. 67 (2): 020102(R). Bibcode:2003PhRvA..67b0102G. doi:10.1103/PhysRevA.67.020102.
- ↑ Eliav, Ephraim; Kaldor, Uzi; Ishikawa, Y.; Pyykkö, P. (1996). »Element 118: The First Rare Gas with an Electron Affinity«. Physical Review Letters. 77 (27): 5350–5352. Bibcode:1996PhRvL..77.5350E. doi:10.1103/PhysRevLett.77.5350. PMID 10062781.
- ↑ Landau, Arie; Eliav, Ephraim; Ishikawa, Yasuyuki; Kador, Uzi (25. maj 2001). »Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)«. Journal of Chemical Physics. 115 (6): 2389–92. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413. Pridobljeno 15. septembra 2015.
- ↑ Borschevsky, Anastasia; Pershina, Valeria; Kaldor, Uzi; Eliav, Ephraim. »Fully relativistic ab initio studies of superheavy elements« (PDF). www.kernchemie.uni-mainz.de. Johannes Gutenberg University Mainz. Arhivirano iz prvotnega spletišča (PDF) dne 15. januarja 2018. Pridobljeno 15. januarja 2018.
- ↑ Borschevsky, Anastasia; Pershina, Valeria; Eliav, Ephraim; Kaldor, Uzi (27. avgust 2009). »Electron affinity of element 114, with comparison to Sn and Pb«. Chemical Physics Letters. 480 (1): 49–51. Bibcode:2009CPL...480...49B. doi:10.1016/j.cplett.2009.08.059.
- ↑ Seaborg, Glenn Theodore (1994). Modern Alchemy. World Scientific. str. 172. ISBN 978-981-02-1440-1.
- ↑ Takahashi, N. (2002). »Boiling points of the superheavy elements 117 and 118«. Journal of Radioanalytical and Nuclear Chemistry. 251 (2): 299–301. doi:10.1023/A:1014880730282.
- ↑ Nash, Clinton S.; Bursten, Bruce E. (1999). »Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118«. Journal of Physical Chemistry A. 1999 (3): 402–410. Bibcode:1999JPCA..103..402N. doi:10.1021/jp982735k. PMID 27676357.
- ↑ Jerabek, Paul; Schuetrumpf, Bastian; Schwerdtfeger, Peter; Nazarewicz, Witold (2018). »Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit«. Phys. Rev. Lett. 120 (5): 053001. arXiv:1707.08710. Bibcode:2018PhRvL.120e3001J. doi:10.1103/PhysRevLett.120.053001. PMID 29481184.
- ↑ »Oganesson: Compounds Information«. WebElements Periodic Table. Pridobljeno 19. avgusta 2019.
- ↑ Han, Young-Kyu; Lee, Yoon Sup (1999). »Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4«. Journal of Physical Chemistry A. 103 (8): 1104–1108. Bibcode:1999JPCA..103.1104H. doi:10.1021/jp983665k.
- ↑ Liebman, Joel F. (1975). »Conceptual Problems in Noble Gas and Fluorine Chemistry, II: The Nonexistence of Radon Tetrafluoride«. Inorg. Nucl. Chem. Lett. 11 (10): 683–685. doi:10.1016/0020-1650(75)80185-1.
- ↑ Seppelt, Konrad (2015). »Molecular Hexafluorides«. Chemical Reviews. 115 (2): 1296–1306. doi:10.1021/cr5001783. PMID 25418862.
- ↑ Pitzer, Kenneth S. (1975). »Fluorides of radon and element 118« (PDF). Journal of the Chemical Society, Chemical Communications (18): 760–761. doi:10.1039/C3975000760b.
- ↑ »transuranium element (chemical element)«. Encyclopædia Britannica. 12. april 2007. Pridobljeno 16. marca 2010.
- ↑ 张青莲 (november 1991). (v kitajščini). Beijing: Science Press. str. P72. ISBN 978-7-03-002238-7.
{{navedi knjigo}}: Manjkajoč ali prazen|title=(pomoč)Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Proserpio, Davide M.; Hoffmann, Roald; Janda, Kenneth C. (1991). »The xenon-chlorine conundrum: van der Waals complex or linear molecule?«. Journal of the American Chemical Society. 113 (19): 7184. doi:10.1021/ja00019a014.
Viri
[uredi | uredi kodo]- Audi, G.; Kondev, F. G.; Wang, M.; in sod. (2017). »The NUBASE2016 evaluation of nuclear properties«. Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- Beiser, A. (2003). Concepts of modern physics (6. izd.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418.
{{navedi knjigo}}: Vzdrževanje CS1: ref podvaja privzeto (povezava) - Hoffman, D. C.; Ghiorso, A.; Seaborg, G. T. (2000). The Transuranium People: The Inside Story. World Scientific. ISBN 978-1-78-326244-1.
- Kragh, H. (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer. ISBN 978-3-319-75813-8.
{{navedi knjigo}}: Vzdrževanje CS1: ref podvaja privzeto (povezava) - Zagrebaev, V.; Karpov, A.; Greiner, W. (2013). »Future of superheavy element research: Which nuclei could be synthesized within the next few years?«. Journal of Physics: Conference Series. 420 (1): 012001. arXiv:1207.5700. Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001. ISSN 1742-6588.
Nadaljnje branje
[uredi | uredi kodo]- Scerri, Eric (2007). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
Zunanje povezave
[uredi | uredi kodo]- WebElements.com – Og (angleško)
- Apsidium – Oganeson (angleško)
- Video o oganesonu na kanalu Periodic Videos (angleško s podnapisi v brazilski portugalščini)

