Periodni sistem elementov
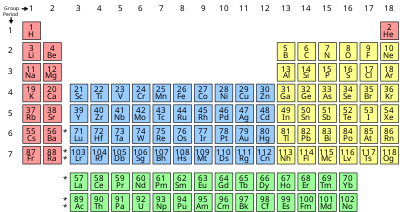
Periodni sistem, znan tudi kot periodni sistem elementov, je tabelarni prikaz kemijskih elementov, ki so razporejeni po atomskem številu, konfiguraciji elektronov in ponavljajočih se kemijskih lastnostih. V sedmih vrsticah tabele, imenovanih periode, so v splošnem na levi strani kovine, na desni pa nekovine. Stolpci, imenovani skupine, vsebujejo elemente s podobnim kemijskim vedenjem. Šest skupin ima dogovorjena imena in dodeljene številke: npr. elementi skupine 17 so halogeni in skupine 18 so žlahtni plini. Prikazana so tudi štiri pravokotna področja ali bloki, ki združujejo kemijske elemente, katerih elektroni najvišjega energetskega nivoja pripadajo enaki atomski orbitali.
Vsi elementi od atomskega števila 1 (vodik) do 118 (oganeson) so bili odkriti ali sintetizirani in izpolnjujejo sedem polnih vrstic periodnega sistema.[1][2] Prvih 94 elementov, od vodika do plutonija, se pojavljajo v naravi, čeprav nekatere najdemo le v sledovih, nekaj pa jih je bilo v naravi odkritih šele po sintetizaciji.[n 1] Elementi od 95 do 118 so bili sintetizirani samo v laboratorijih, jedrskih reaktorjih ali v jedrskih eksplozijah.[3] Trenutno se nadaljuje sintetiziranje elementov z višjimi atomskimi števili: ti elementi se bodo začeli v osmi vrstici. S teoretičnim delom so predlagali možne kandidate za to razširitev. V laboratorijih so izdelali tudi številne sintetične radioizotope naravnih elementov.
Organizacijo periodnega sistema lahko uporabimo za ugotavljanje odnosov med različnimi lastnostmi elementov in tudi za predvidevanje kemijskih lastnosti in vedenja neodkritih ali novo sintetiziranih elementov. Ruski kemik Dmitrij Mendelejev je leta 1869 objavil prvo tabelo periodnega sistema. Napovedal je tudi nekatere lastnosti neznanih elementov, ki naj bi zapolnili vrzeli v tabeli. Večina njegovih napovedi se je kmalu izkazala za pravilne, vrhunec pa je bil odkritje galija in germanija leta 1875 oziroma 1886, kar je potrdilo njegove napovedi.[4] Mendelejeva ideja se je počasi širila in izpopolnjevala z odkrivanjem ali sintezo novih elementov in razvojem novih teoretičnih modelov za razlago kemijskega vedenja. Danes še vedno potekajo razprave o umestitvi in kategorizaciji določenih elementov, o nadaljnji razširitvi in omejitvah tabele ter o tem, ali obstaja optimalna oblika tabele.
Pregled
[uredi | uredi kodo]Tabela tukaj prikazuje široko uporabljeno obliko. Druge oblike (obravnavane spodaj) podrobno prikazujejo različne strukture.
| Skupina | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Vodik & alkalijske kovine |
Zemljoalkalijske kovine | Pniktogeni | Halkogeni | Halogeni | Žlahtni plini | ||||||||||||||
| Perioda |
|||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
- Ca: 40,078 — Formalna kratka vrednost, zaokroženo [6]
- Po: [209] — masno število najstabilnejšega izotopa
Vsak kemični element ima edinstveno atomsko število (Z), ki predstavlja število protonov v njegovem jedru.[n 2] Večina elementov ima različno število nevtronov med različnimi atomi, pri čemer se te različice imenujejo izotopi. Na primer, ogljik ima tri izotope, ki se pojavljajo v naravi: vsi njegovi atomi imajo šest protonov, večina jih ima tudi šest nevtronov, ampak približno en odstotek ima sedem nevtronov, zelo majhen delež pa jih ima osem. Izotopi se v periodnem sistemu nikoli ne prikazujejo; vedno so združeni v enem samem elementu. Elementi brez stabilnih izotopov imajo atomsko maso svojega najstabilnejšega izotopa - takšne mase so v tabeli prikazane v oklepajih.[8]
V standardni periodni tabeli so elementi navedeni po naraščajočem atomskem številu Z. Nova vrstica (perioda) se začne, ko ima nova elektronska lupina svoj prvi elektron. Stolpci (skupine) so določeni z elektronsko konfiguracijo atoma; elementi z enakim številom elektronov v določeni podlupini spadajo v iste stolpce (npr. kisik in selen sta v istem stolpcu, ker imata oba štiri elektrone v najbolj oddaljeni p-podlupini). Elementi s podobnimi kemičnimi lastnostmi na splošno spadajo v isto skupino v periodnem sistemu, čeprav imajo elementi v bloku f in do neke mere v bloku d podobne lastnosti. Tako je razmeroma enostavno napovedati kemijske lastnosti elementa, če poznamo lastnosti elementov okoli njega.[9]
Od leta 2016 ima periodni sistem 118 potrjenih elementov, od elementa 1 (vodik) do 118 (oganeson). Elemente 113, 115, 117 in 118, ki so najnovejša odkritja, je decembra 2015 uradno potrdila Mednarodna zveza za čisto in uporabno kemijo (IUPAC). Njihova predlagana imena, nihonij (Nh), moskovij (Mc), tenes (Ts) in oganeson (Og), je IUPAC uradno objavil novembra 2016.[10][11][12][13] Prvih 94 elementov se pojavlja v naravi; preostalih 24, od americija do oganesona (95–118), se pojavljajo le, kadar jih sintetizirajo v laboratorijih. Od 94 naravnih elementov jih je 83 prvobitnih, 11 pa se jeh pojavlja le v razpadajočih verigah prvobitnih elementov.[14] V makroskopskih količinah v čisti obliki še ni bil opažen noben element, težji od ajnštajnija (element 99), prav tako ne astat (element 85); francij (element 87) je bil fotografiran le v obliki svetlobe, ki jo oddajajo mikroskopske količine (300.000 (300.000 atomov).[15]
Nabori elementov
[uredi | uredi kodo]V kronološkem zaporedju to poglavje obravnava kovine in nekovine (ter polkovine); kategorije elementov; skupine in periode; in bloke periodnega sistema. Čeprav razpoznavanje kovin kot trdne, topne in v splošnem kovne snovi izvira že iz antike, [16][17] je bil morda Antoine Lavoisier prvi, ki je leta 1789 uradno ločil kovine in nekovine ('non-métalliques') v njegovem 'revolucionarnem' delu[18] Traité Élémentaire de Chimie.[19] Leta 1811 je Berzelius nekovinske elemente označil za polkovine[20][21] zaradi njihove sposobnost tvorjenja oksianionov.[22][23] Leta 1825 je v popravljeni nemški izdaji svojega Učbenika kemije[24][25] razdelil polkovine v tri razrede. To so bili: stalno plinasti 'gazolyta' (vodik, dušik, kisik); prave polkovine (žveplo, fosfor, ogljik, bor, silicij); in 'halogenia', ki tvorijo sol (fluor, klor, brom, jod).[26] Šele pred kratkim, od sredine 20. stoletja, se izraz polkovina pogosto uporablja za označevanje elementov z vmesnimi ali mejnimi lastnostmi med kovinami in nekovinami. Mendelejev je objavil svoj periodni sistem leta 1869, skupaj s sklici na skupine družin elementov, vrsticami ali periodami. Hinrichs je zapisal, da je mogoče na periodnem sistemu narisati črte, ki razmejijo lastnosti, ki nas zanimajo, na primer elementi s kovinskim sijajem (v nasprotju s tistimi, ki nimajo takšnega sijaja).[27] Charles Janet naj bi bil leta 1928 prvi, ki se je skliceval na bloke periodnega sistema.[28]
Kovine, polkovine in nekovine
[uredi | uredi kodo]
Glede na skupne fizikalne in kemijske lastnosti lahko elemente razvrstimo v glavne kategorije kovine, metaloidi oz. polkovine in nekovine. Kovine so na splošno sijoče, visoko prevodne trdne snovi, ki med seboj tvorijo zlitine in solem podobne ionske spojine z nekovinami (razen z žlahtnimi plini). Večina nekovin so obarvani ali brezbarvni plini; nekovine, ki tvorijo spojine z drugimi nekovinami, imajo kovalentno vez. Med kovinami in nekovinami so polkovine, ki imajo vmesne ali mešane lastnosti. [29]
Kovine in nekovine lahko nadalje razvrstimo v podkategorije, ki kažejo stopnjo kovinskih in nekovinskih lastnosti, ko se premikamo v vrsticah od leve proti desni strani. Kovine lahko razdelimo na visoko reaktivne alkalne kovine, preko manj reaktivnih zemeljskoalkalijskih kovin, lantanidov in aktinoidov, preko arhetipskih prehodnih kovin, z zaključkom pri fizikalno in kemijsko šibkih po-prehodnih kovinah. Nekovine se lahko preprosto razdelijo na večatomske nekovine, saj so bližje polkovinam in kažejo nekatere kovinske lastnosti v začetni stopnji; na nekovinske dvoatomske nekovine, nekovinske in skoraj popolnoma inertne monatomske žlahtne pline. Specializirane skupine, kot so ognjevarne kovine in plemenite kovine, so primeri podskupin prehodnih kovin, tudi poznane[30] in občasno označene.[31]
Uvrščanje elementov v kategorije in podkategorije, ki temeljijo samo na skupnih lastnostih, je nepopolno. V vsaki kategoriji se na mejah pojavljajo neskladja med lastnostmi, kot je to pri večini klasifikacijskih shem.[32] Berilij je na primer uvrščen med zemeljskoalkalijske kovine, čeprav je njegova amfoterna kemična sestava in težnja, da večinoma tvori kovalentne spojine, značilnosti kemijsko šibkih in po-prehodnih kovin. Možne so tudi druge klasifikacijske sheme, na primer delitev elementov na mineraloške kategorije pojavnosti ali na kristalne strukture. Kategorizacija elementov na ta način sega vsaj v leto 1869, ko je Hinrichs[33] zapisal, da je mogoče v periodnem sistemu postaviti preproste mejne črte, da se prikažejo elementi s skupnimi lastnostmi, kot so kovine, nekovine ali plinasti elementi.
Kategorije
[uredi | uredi kodo]Elementi periodnega sistema, ki so prikazani v tabeli, so razdeljeni v devet kategorij; šest kategorij za kovine in dve za nekovine ter kategorija polkovin. Različni avtorji lahko uporabljajo različne sheme kategorizacije, odvisno od lastnosti, ki nas zanimajo.
Posamezna kategorija ni nujno izključujoča glede na svoje ime, meje ali lastnosti. Na primer, medtem ko je berilij v skupini 2 obarvan kot zemljoalkalijska kovina, je v naravi bolj amfotermen kot alkalijska kovina. Težji člani skupine 3 so prikazani kot lantanoidi in aktinoidi, čeprav so oboji tudi prehodne kovine. Prehodne kovine v skupini 3; lantanoidi in aktinoidi, so v naravi alkalijske kovine, tako kot alkalijske kovine v skupini 1.
Znanstvenikom ni treba "izgubiti spanja zaradi težkih primerov, če klasifikacijski sistem prinaša ekonomičnost opisovanja, strukturiranje znanja in našega razumevanja, težki primeri pa predstavljajo malo manjšino."[34]
| Kategorije elementov periodnega sistema | ||||||||||
| Kovine | Polkovine | Nekovine | Neznani | |||||||
| Alkalijske kovine |
Zemljoalkalijske kovine |
Notranji prehodni elementi |
Prehodne kovine |
Šibke kovine |
Druge nekovine |
Halogeni | Žlahtni plini | |||
| Lantanoidi | Aktinoidi | |||||||||
Razlika med obema kategorijama je bolj stopnja lastnosti kot vrsta.[35] Kemiji obeh kategorij kovin sta si v veliki meri podobni.[36] Večina teh kovin tvori osnovne okside (Be je amfoteričen). Alkalijske kovine so lahke, mehke, visoko reaktivne z nizko temperaturo tališč in vrelišč. Zemljoalkalijske kovine imajo višja tališča, vrelišča in gostoto od alkalijskih kovin, po reaktivnosti so takoj za njimi.
Srednje do zelo goste kovine, z visoko temperaturo tališč in vrelišč; nekatere so zelo trde, so trdni in žilavi in odporni na korozijo. Elementi od Rf naprej so sintetizirani. Značilne lastnosti so spremenljiva valenca, barva in tvorba kompleksnih ionov. Oksidi so bazični, amfoterni ali kislinski, odvisno od oksidacijskega stanja.
So zelo podobni Ca, Sr in Ba, vendar so mnogi težji in tvorijo večinoma bledo obarvane spojine. Lantanoidi so si podobni in jih je zato težko ločiti. Obstaja jih veliko, ampak so razpršeni; komercialne koncentracije so zato redke. Oksidi so močno do zmerno bazični.
So mehke, goste in reaktivne kovine, tiste od Am naprej pa so sintetitizirane. Začetni aktinoidi (Th to Am) kažejo nekaj podobnosti s prehodnimi kovinami in imajo bazične ali amfoterne okside; kasnejši aktinidi so bolj podobni lantanoidom. Številni aktinoidi tvorijo obarvane spojine.
Mehke (ali krhke) kovine z nizko trdnostjo in s tališči nižjimi od prehodnih kovin (daleč nižje v primeru Hg, ki je kapljevina). Kemijsko kažejo značilno nagnjenosti k kovalentni vezavi, kislinsko-bazični amfoterizmu in anionskim vrstam, kot so aluminati, stanati in bizmutati. Lahko tvorijo tudi Zintlove faze (običajno krhke, obarvane in polprevodniške intermetalne spojine).
Med kovinami in nekovinami se nahajajo elementi z mešanico kovinskih, nekovinskih ali vmesnih lastnostih. Izgledajo kot kovine, so krhke in so običajno polprevodniki, in ne pravi prevodniki. Večinoma se kemijsko obnašajo kot nekovine. Polkovine tvorijo šibko kisle ali amfoterne okside.
So brezbarvne, obarvane ali pa imajo (pod belo svetlobo) kovinski izgled. Večinoma so trdnine ali plini. Medtem ko so trdnine krhke, je večina le-teh znana tudi v prožnih ali gnetljivih oblikah.
Za halogene, fluor, klor, brom in jod, je značilna njihova ostrina in toksičnost v naravnih oblikah. Preostale reaktivne nekovine, vodik, ogljik, dušik, kisik, fosfor, žveplo in selen, ki so stisnjeni med močno elektronegativnimi halogenskimi nekovinami in šibko nekovinskimi polkovinami, so v naravi (na splošno) zmerno nekovinske. Te nekovine, oz. večina izmed njih, privlači različna imena kategorij kot so biogen,[37] CHONPS, [38] vmesne,[39] lahke[40] ali druge nekovine.[41]
Reaktivnost reaktivnih nekovin je od relativno inertnega (N) do visoko reaktivnega (Cl, F). Tvorijo kisle in nevtralne (H2O, CO, NO, N2O ) okside.
Nevnetljivi plini brez barve in vonja in imajo zelo nizko kemijsko reaktivnost. Prva spojina žlahtnega plina, približno sestave XePtF6, je bila narejena šele leta 1962; spojine He in Ne še niso znane.
Druge kategorije
[uredi | uredi kodo]V splošni rabi obstaja veliko drugih imen za nabore kemijskih elementov. Sem spadajo na primer redke-zemeljske kovine, plemenite kovine in ognjevarne kovine
Skupine
[uredi | uredi kodo]Skupine ali družine elementov so predstavljene v stolpcih, običajno izražajo jasnejše trende od period. To razlagamo z dejstvom, da imajo elementi v isti skupini enako konfiguracijo elektronov v valenčni lupini, zato so podobno reaktivni, s predvidljivim spreminjanjem lastnosti ob večanju atomskega števila. Izražajo trende v atomskem polmeru, ionizacijski energiji in elektronegativnosti, kar je posledica dejstva, da so od vrha navzdol z večanjem števila energetskih nivojev valenčni elektroni vedno dlje od jedra, s tem pa se zmanjšujeta ionizacijska energija in elektronegativnost.
Po dogovoru označujemo skupine s številkami od 1 (alkalijske kovine skrajno levo) do 18 (žlahtni plini skrajno desno). Nekatere imajo trivialna imena, vendar so pri večini skupin taka imena redko v uporabi ali pa jih poimenujemo kar po prvem elementu, npr. »skandijeva skupina« za 3. skupino.
Periode
[uredi | uredi kodo]Periode predstavljajo vrstice periodnega sistema. Elementi po periodah kažejo trende v atomskem polmeru, ionizacijski energiji, elektronski afiniteti in elektronegativnosti, vendar so ti trendi šibkejši in manj pravilni kot po skupinah. Običajno se z leve proti desni atomski polmer manjša, kar je posledica dejstva, da ima vsak naslednji element dodaten proton v jedru, ki privlači elektrone bližje. To hkrati povečuje elektronsko afiniteto in elektronegativnost.
Zgodovina
[uredi | uredi kodo]
Potreba po urejevanju kemijskih elementov v sistemu se je pokazala, ko so znanstveniki ugotovili, da obstajajo določene povezave med lastnostmi različnih elementov. Prvi poskus periodnega sistema je začrtal Antoine Lavoisier (1743-1794) leta 1789. Potem ko je prevzel in dodelal skoraj sto let staro definicijo kemijskega elementa, ki jo je Robert Boyle (1627-1691) opisal kot snov, ki je s kemijsko reakcijo ne moremo razgraditi na bolj enostavne snovi, je Lavoisier skušal 33 do takrat znanih elementov postaviti v določeno pregledno obliko. Izbral si je štiri kategorije; plini, nekovine, kovine in »zemlje«. V tistem času je bilo znanih premalo elementov, da bi jih res lahko komu uspelo urediti v pregledno obliko. Lavoisier bi svoje delo najverjetneje dokončal, če ga ne bi zaradi političnih razlogov obglavili. Problem poznavanja lastnosti elementov je bil predvsem v tem, da večina elementov v skupini plinov sploh niso bili elementi, ampak spojine, ki jih še niso uspeli razgraditi na elemente.
Prelom v razumevanju urejenosti elementov je bilo delo Stanislaa Cannizzara (1826-1910) iz leta 1858. Dve leti po smrti njegovega rojaka Amadea Avogadra (1776-1856), ki je prvi določil osnovo množini snovi in povezavo z atomsko maso, je postavil osnovo, skupno vsem elementom – relativno atomsko maso.
Prvi, ki je opozoril na ponavljajoče se lastnosti elementov, je bil nemški znanstvenik Johann Wolfgang Döbereiner (1780-1849). Leta 1829 je ugotovil, da ima atom broma atomsko maso, ki je polovična vrednost vsote mas atomov klora in joda. To pomeni, da vsoto atomskih mas klora (35,5) in joda (126,9) delimo z 2 in dobimo vrednost 81,2, ki je zelo dober približek relativni atomski masi broma (79,9). Podoben vzorec je našel pri trojicah kalcij, stroncij, barij in žveplo, selen, telur. Te skupine je imenoval triade. Po mnenju ostalih znanstvenikov so bile te povezave zgolj naključne.
Leta 1860 je na prvem mednarodnem kemijskem kongresu, ki je bil organiziran prav zaradi periodnega sistema elementov, Cannizzaro predstavil svojo zamisel o pomembnosti atomskih mas elementov pri izgradnji periodnega sistema. Njegovo delo je temeljilo na Avogadrovi domnevi in Gay-Lussacovem zakonu o prostorninskih odnosih pri kemijskih reakcijah v plinastem stanju. Elementi so bili razvrščeni v sistem glede na znane vrednosti atomskih mas.
Naslednji velik je napravil angleški kemik John Newlands (1837-1898) leta 1862, saj je predpostavil, da je možno elemente, glede na naraščajočo atomsko maso urediti v sedem stolpcev. Po ureditvi so postale vidne tudi Döberienerjeve triade. Ureditev je imenoval zakon oktav, vendar znanstveniki tudi njegove ideje niso dobro sprejeli. V Evropi je periodni sistem prvi postavil Julius Lothar Meyer (1830-1895), vendar je leto pred njim ruski kemik Dimitrij Ivanovič Mendelejev oblikoval zgradbo periodnega sistema, s katero je lahko napovedal manjkajoče, še ne odkrite elemente. Z odkritjem žlahtnih plinov lorda Rayleigha (1842-1919) in Williama Ramsayja (1852-1916) od leta 1894 naprej je Mendelejev predlagal, naj se doda pred prvo skupino dodatna ničta skupina, ki bi vsebovala te elemente, sistem ostalih pa bi ostal nespremenjen. Tak periodni sistem je ostal v uporabi vse do leta 1930. Kmalu po Rutherfordovem (1871-1937) odkritju protona leta 1911 in Thomsonovi (1856-1940) potrditvi obstoja izotopov (obstoj izotopov je prvi predlagal Frederick Soddy, 1877-1956) je Henry Moseley (1887-1915) izpostavljal do takrat znane elemente rentgenskim žarkom. Izpeljal je povezavo med frekvenco sevanja in vrstnim številom. Po preureditvi elementov glede na večanje vrstnega (atomskega) števila in ne atomske mase je bilo tudi nekaj izjem iz periodnega sistema, ki so povzročale težave Mendelejevu, popravljenih. Sodobni periodni sistem je od takrat zgrajen na Moseleyjevem zakonu periodičnosti, ki temelji na vrstnem številu elementov.
Do leta 2012 je bilo odkritih 118 elementov, od tega jih Mednarodna zveza za čisto in uporabno kemijo (IUPAC), ki skrbi za standarde v kemiji, priznava 114. Zadnja dva potrjena sta bila flerovij (Fl, 114) in livermorij (Lv, 116).[42] Elementi z najvišjimi atomskimi števili so izredno nestabilni, sintetizirajo jih v laboratorijih z visokoenergijskimi reakcijami in dokazujejo na podlagi produktov radioaktivnega razpada. Še nepotrjeni elementi imajo začasna latinizirana imena, npr. ununoktij (118). V naravi se pojavlja 98 elementov, od tega večina samo v sledeh; nekateri so bili sintetizirani v laboratoriju pred odkritjem v naravi.
Različne tabele periodnega sistema
[uredi | uredi kodo]Dolga tabela oz tabela z 32 stolpci
[uredi | uredi kodo]
Sodobna tabela periodnega sistema je včasih razširjena svojo dolgo oz. 32-stolpično obliko z elementi bloka f v njihove naravne poziciji med blokoma s in d, kot je to leta 1905 predlagal Alfred Werner.[43] Za razliko od oblike z 18 stolpci ta ureditev ne povzroča "prekinitev v zaporedju naraščajočih atomskih števil".[44] Preglednejše je tudi razmerje bloka f do drugih blokov periodnega sistema.[45] Kljub tem prednostim se uredniki oblike z 32 stolpci običajno izogibajo zaradi razmerja pravokotne oblike v primerjavi z razmerjem strani knjige[46] in poznavanja sodobne oblike, kot jo je predstavil Seaborg.[47]
| Skupina → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alkalijske kovine | Zemljoalkalijske kovine | Borova skupina | Ogljikova skupina | Pniktogeni | Halkogeni | Halogeni | Žlahtni plini | |||||||||||||||||||||||||
| CAS: | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||||||||||||||
| stari IUPAC: | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | ||||||||||||||||
| ↓ Perioda | ||||||||||||||||||||||||||||||||
| 1 | Vodik
|
→element name vrstno število kemijski simbol |
Helij
| |||||||||||||||||||||||||||||
| 2 | Litij
|
Berilij
|
Bor
|
Ogljik
|
Dušik
|
Kisik
|
Fluor
|
Neon
| ||||||||||||||||||||||||
| 3 | Natrij
|
Magnezij
|
Aluminij
|
Silicij
|
Fosfor
|
Žveplo
|
Klor
|
Argon
| ||||||||||||||||||||||||
| 4 | Kalij
|
Kalcij
|
Skandij
|
Titan
|
Vanadij
|
Krom
|
Mangan
|
Železo
|
Kobalt
|
Nikelj
|
Baker
|
Cink
|
Galij
|
Germanij
|
Arzen
|
Selen
|
Brom
|
Kripton
| ||||||||||||||
| 5 | Rubidij
|
Stroncij
|
Itrij
|
Cirkonij
|
Niobij
|
Molibden
|
Tehnecij [97]
|
Rutenij
|
Rodij
|
Paladij
|
Srebro
|
Kadmij
|
Indij
|
Kositer
|
Antimon
|
Telur
|
Jod
|
Ksenon
| ||||||||||||||
| 6 | Cezij
|
Barij
|
Lantan
|
Cerij
|
Prazeodim
|
Neodim
|
Prometij [145]
|
Samarij
|
Evropij
|
Gadolinij
|
Terbij
|
Disprozij
|
Holmij
|
Erbij
|
Tulij
|
Iterbij
|
Lutecij
|
Hafnij
|
Tantal
|
Volfram
|
Renij
|
Osmij
|
Iridij
|
Platina
|
Zlato
|
Živo srebro
|
Talij
|
Svinec
|
Bizmut
|
Polonij [209]
|
Astat [210]
|
Radon [222]
|
| 7 | Francij [223]
|
Radij [226]
|
Aktinij [227]
|
Torij
|
Protaktinij
|
Uran
|
Neptunij [237]
|
Plutonij [244]
|
Americij [243]
|
Kirij [247]
|
Berkelij [247]
|
Kalifornij [251]
|
Ajnštajnij [252]
|
Fermij [257]
|
Mendelevij [258]
|
Nobelij [259]
|
Lavrencij [266]
|
Raderfordij [267]
|
Dubnij [268]
|
Siborgij [269]
|
Borij [270]
|
Hasij [269]
|
Majtnerij [278]
|
Darmštatij [281]
|
Rentgenij [282]
|
Kopernicij [285]
|
Nihonij [286]
|
Flerovij [289]
|
Moskovij [290]
|
Livermorij [293]
|
Tenes [294]
|
Oganeson [294]
|
- F: 18,998403163(6) — Standardna atomska teža[48]
- C: [12,0096; 12,0116] — Standard atomic weight is an interval[48]
- F: 18,998, C: 12,011 — Abridged and conventional value (formal short)[6]
- Po: [209] — masno število najstabilnejšega izotopa
Opombe
[uredi | uredi kodo]- ↑ The elements discovered initially by synthesis and later in nature are technetium (Z = 43), promethium (61), astatine (85), neptunium (93), and plutonium (94).
- ↑ An element zero (i.e. a substance composed purely of neutrons), is included in a few alternate presentations, for example, in the Chemical Galaxy.[7]
Sklici
[uredi | uredi kodo]- ↑ »Chemistry: Four elements added to periodic table«. BBC News. 4. januar 2016. Arhivirano iz prvotnega spletišča dne 4. januarja 2016.
- ↑ St. Fleur, Nicholas (1. december 2016). »Four New Names Officially Added to the Periodic Table of Elements«. New York Times. Arhivirano iz prvotnega spletišča dne 14. avgusta 2017.
- ↑ Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New izd.). New York: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Emsley, John (2001). Nature's Building Blocks ((Hardcover, First Edition) izd.). Oxford University Press. str. 521–22. ISBN 978-0-19-850340-8.
- ↑ 5,0 5,1 Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ 6,0 6,1 Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3). Table 2, 3 combined; uncertainty removed. doi:10.1515/pac-2015-0305.
- ↑ Labarca, M. (2016). »An element of atomic number zero?«. New Journal of Chemistry. 40 (11): 9002–06. doi:10.1039/C6NJ02076C.
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Gray, p. 6
- ↑ Ashley Strickland. »New elements on the periodic table are named«. CNN. Arhivirano iz prvotnega spletišča dne 10. junija 2016. Pridobljeno 11. junija 2016.
- ↑ »Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118«. International Union of Pure and Applied Chemistry. 30. december 2015. Arhivirano iz prvotnega spletišča dne 13. junija 2016.
- ↑ »Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table«. NPR.org. Arhivirano iz prvotnega spletišča dne 10. junija 2016. Pridobljeno 11. junija 2016.
- ↑ Koppenol, W. H. (2002). »Naming of New Elements (IUPAC Recommendations 2002)« (PDF). Pure and Applied Chemistry. 74 (5): 787–91. doi:10.1351/pac200274050787. Arhivirano (PDF) iz spletišča dne 31. oktobra 2008.
- ↑ Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New izd.). New York: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Silva, Robert J. (2006). »Fermium, Mendelevium, Nobelium and Lawrencium«. V Morss, L. R. (ur.). The Chemistry of the Actinide and Transactinide Elements (3. izd.). Dordrecht: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- ↑ Cornford, FM (1937). Plato's cosmology: the Timaeus of Plato translated with a running commentary by Francis Macdonald Cornford. London: Routledge and Kegan Paul. str. 249–50.
- ↑ Obrist, B (1990). Constantine of Pisa. The book of the secrets of alchemy: a mid-13th century survey of natural science,. Leiden: E J Brill. str. 163–64.
- ↑ Strathern, P (2000). Mendeleyev's dream: The quest for the elements. Hamish Hamilton,. str. 239. ISBN 0-241-14065-X.
{{navedi knjigo}}: Vzdrževanje CS1: dodatno ločilo (povezava) - ↑ Roscoe, HE; Schorlemmer, FRS (1894). A treatise on chemistry: Volume II: The metals. New York: D Appleton. str. 4.
- ↑ Goldsmith, RH (1982). »Metalloids«. Journal of Chemical Education. 59 (6): 526–527. doi:10.1021/ed059p526.
- ↑ Berzelius, JJ (1811). »Essai sur la nomenclature chimique«. Journal de Physique, de Chimie, d'Histoire Naturelle. LXXIII: 253‒286 (258).
- ↑ Partington, JR (1964). A history of chemistry. London: Macmillan. str. 168.
- ↑ Bache, AD (1832). »An essay on chemical nomenclature, prefixed to the treatise on chemistry; by J. J. Berzelius«. American Journal of Science. 22: 248–277 (250).
- ↑ Partington, JR (1964). A history of chemistry. London: Macmillan. str. 145, 168.
- ↑ Jorpes, JE (1970). Berzelius: his life and work, trans. B Steele,. Berkeley: University of California. str. 95.
- ↑ Berzelius, JJ (1825). Lehrbuch der chemie (Textbook of chemistry), vol. 1, pt. 1, trans. F Wöhle. Dresden: Arnold. str. 168.
- ↑ Hinrichs, GD (1869). »On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations«. Proceedings of the American Association for the Advancement of Science. 18: 112–124.
- ↑ Charles Janet, La classification hélicoïdale des éléments chimiques, Beauvais, 1928
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (4. izd.). New York: McGraw-Hill. str. 536. ISBN 978-0-07-111658-9.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. str. 376. ISBN 978-0-87170-825-0.
- ↑ Bullinger, H-J. (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. str. 8. ISBN 978-3-540-88545-0.
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. str. 169–71. ISBN 978-0-521-19436-5.
- ↑ Hinrichs, G. D. (1869). »On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations«. Proceedings of the American Association for the Advancement of Science. 18 (5): 112–24. Arhivirano iz spletišča dne 2. avgusta 2016.
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. str. 169–71. ISBN 978-0-521-19436-5.
- ↑ Choppin, G. R.; Johnsen, R. H. (1972). Introductory chemistry. Reading, Massachusetts: Addison-Wesley. str. 344.
- ↑ Hamm, D. I. (1969). Fundamental concepts of chemistry. New York: Appleton-Century-Croftsy. str. 371.
- ↑ Crawford, FH (1968). Introduction to the science of physics. New York: Harcourt, Brace & World. str. 540.
- ↑ Catling, DC (2013). Astrobiology: A very short introduction. Oxford: Oxford University Press. str. 12.
- ↑ Vernon, RE (2020). »Organising the metals and nonmetals«. Foundations of Chemistry. 22: 217–233. doi:10.1007/s10698-020-09356-6.
- ↑ Williams, RJP (1981). »The Bakerian lecture 1981: Natural section of the chemical elements«. Proc. R. Soc. Lond. B. 213: 213, 361–397. doi:10.1098/rspb.1981.0071.
- ↑ Gargaud, ur. (2006). Lectures in astrobiology, vol. 1, part 1: The early Earth and other cosmic habitats for life. Berlin: Springer. ISBN 3-540-29005-2.
- ↑ Loss, Robert D.; Corish, John (2012). »Names and symbols of the elements with atomic numbers 114 and 116 (IUPAC Recommendations 2012)«. Pure Appl. Chem. Zv. 84, št. 7. str. 1669–1672. doi:10.1351/PAC-REC-11-12-03.
- ↑ Werner, Alfred (1905). »Beitrag zum Ausbau des periodischen Systems«. Berichte der Deutschen Chemischen Gesellschaft. 38: 914–21. doi:10.1002/cber.190503801163.
- ↑ Scerri, Eric (2013). »Element 61 – Promethium«. A Tale of 7 Elements. New York: Oxford University Press (US). str. 175–94 [, 190], . ISBN 978-0-19-539131-2.
... no interruptions in the sequence of increasing atomic numbers ...
- ↑ Newell, S. B. (1980). Chemistry: An introduction. Boston: Little, Brown and Company. str. 196. ISBN 978-0-316-60455-0. Arhivirano iz prvotnega spletišča dne 28. marca 2019. Pridobljeno 27. avgusta 2016.
- ↑ Leach, M. R. (2012). »Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form«. Foundations of Chemistry. 15 (1): 13–29. doi:10.1007/s10698-012-9151-3.
- ↑ Thyssen, P.; Binnemans, K. (2011). Gschneidner Jr., K. A. (ur.). Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Handbook on the Physics and Chemistry of Rare Earths. Zv. 41. Amsterdam: Elsevier. str. 76. ISBN 978-0-444-53590-0.
- ↑ 48,0 48,1 Meija, Juris; in sod. (2016). »Atomic weights of the elements 2013 (IUPAC Technical Report)«. Pure and Applied Chemistry. 88 (3). Table 1: Standard atomic weights 2013, pp. 272–274. doi:10.1515/pac-2015-0305.
Glej tudi
[uredi | uredi kodo]Zunanje povezave
[uredi | uredi kodo]- Periodni sistem elementov Arhivirano 2003-10-01 na Wayback Machine., Izobraževalno društvo Svarog, Maribor
