Kemična reakcija

Kémična reákcija je proces, v katerem pride do trajne spremembe kemičnih in fizikalnih lastnosti snovi.[1] Klasične kemične reakcije obravnavajo procese, v katerih je prišlo do spremembe položaja elektronov med prekinjanjem starih in tvorbo novih vezi med atomi, pri čemer so ostala jedra prisotnih atomov nespremenjena. Takšne reakcije je običajno mogoče opisati s kemijskimi enačbami.
V reakcijo vstopajoče snovi so reaktanti ali reagenti, iz katerih nastane v kemični reakciji en ali več produktov. Lastnosti produktov se praviloma razlikujejo od lastnosti reaktantov. Reakcija pogosto poteka preko vmesnih, tako imenovanih osnovnih reakcij. Podatki o natančnem poteku reakcije so del reakcijskega mehanizma. V kemijskih enačbah so s simboli prikazane vstopajoče in izstopajoče snovi in njihova razmerja, včasih tudi vmesni produkti in reakcijski pogoji.
Kemične reakcije potekajo z neko hitrostjo, odvisno od temperature, tlaka, koncentracije in katalizatorjev. Hitrost reakcij z naraščajočo temperaturo praviloma raste, ker je na razpolago več toplotne energije, potrebne za aktiviranje reaktantov, se pravi cepljenje vezi med atomi.
Reakcije lahko potekajo samo v eno ali v obe smeri. Pri slednjih se po nekem času vzpostavi kemično ravnovesje, v katerem se reakcija navidezno ustavi. Reakcije, ki za svoj potek ne potrebujejo vnosa proste energije, se pogosto imenujejo spontane reakcije. Nespontane reakcije za svoj potek zahtevajo vnos proste energije. Primera takšne reakcije sta polnjenje baterije iz zunanjega vira električne energije in fotosinteza, ki jo poganja absorbcija elektromagnetnega sevanja v obliki sončne svetlobe.
Za sintezo bolj zapletenih produktov je pogosto potreben niz različnih zaporednih kemičnih reakcij. V biokemiji se zaporedje, v katerem produkt posamezne reakcije v naslednji reakciji postane reaktant, imenuje metabolizem. Tovrstne reakcije pogosto katalizirajo beljakovinski encimi, ki povečajo hitrosti reakcij ali omogočajo njihov potek v pogojih, v katerih sicer ne bi potekale.
Splošen pojem kemične reakcije se je v sodobni kemiji razširil tudi na reakcije med delci, manjšimi od atomov, in vključuje jedrske reakcije, radioaktivni razpad in reakcije med elementarnimi delci, opisanimi s kvantno teorijo. Poddisciplina kemije, ki obravnava kemične reakcije nestabilnih in radioaktivnih elementov, v katerih lahko pride tudi do elektronskih in jedrskih sprememb, je jedrska kemija.
Zgodovina[uredi | uredi kodo]

Kemične reakcije, kot so zgorevanje, fermentacija in redukcija kovinskih rud, so bile znane že v antiki. Prve teorije o pretvorbi snovi so razvili grški filozofi. Ena od njih je bila Empedoklejeva teorija štirih elementov, ki trdi, da je vsaka snov sestavljena iz štirih osnovnih elementov - ognja, vode, zraka in zemlje. V srednjem veku so kemične pretvorbe preučevali alkimisti. Ukvarjali so se predvsem z vprašanjem, kako pretvoriti svinec v zlato. V ta namen so izvajali predvsem reakcije svinca in zlitin svinec-baker z žveplom.[2]
Ob tem so mimogrede sintetizirali tudi snovi, ki se v naravi običajno ne pojavljajo. Sintezi žveplove in dušikove kisline, na primer, se pripisujeta kontroverznemu alkimistu Jābirju ibn Hayyānu. V proces je vključeno segrevanje sulfatnih oziroma nitratnih mineralov, kot so bakrov sulfat, galun in soliter. V 17. stoletju je Johann Rudolph Glauber iz natrijevega klorida in žveplove kisline proizvedel klorovodikovo kislino in natrijev sulfat. Razvoj svinčene komore leta 1746 in Leblancovega procesa sta omogočila proizvodnjo žveplove kisline in natrijevega karbonata na industrijski ravni. Kemične reakcije so dobile svoje mesto v industriji. Optimizacija tehnologije proizvodnje žveplove kisline je v 1880. letih privedla do kontaktnega postopka.[3] Fritz Haber je leta 1909–1910 razvil postopek za proizvodnjo amonijaka.[4]
Raziskovalci, med njimi Jan Baptist van Helmont, Robert Boyle in Isaac Newton, so se že v 16. stoletju trudili ugotoviti zakone, na katerih so temeljile pretvorbe v njihovih laboratorijskih poskusih. Johann Joachim Becher je leta 1667 predlagal flogistonsko teorijo, ki je predpostavila obstoj ognju podobnega elementa, imenovanega »flogiston«. Flogiston so vsebovale gorljive snovi in ga med zgorevanjem sproščale. Leta 1785 je Antoine Lavoisier dokazal, da je teorija napačna in odkril pravilno razlago gorenja kot reakcije s kisikom iz zraka.[5]
Joseph Louis Gay-Lussac je leta 1808 ugotovil, da plini med seboj vedno reagirajo v določenem volumskem razmerju. Na tej osnovi je John Dalton razvil svojo atomsko teorijo, Joseph Proust pa zakon o enostavnih razmerjih, ki je kasneje privedel do pojmov stehiometrija in kemijska enačba.[6]
Za organske spojine je dolgo časa veljalo, da lahko nastajajo samo v živih organizmih in da so preveč zapletene, da bi se lahko sintetizirale. Po načelu vitalizma je veljalo, da so organske spojine povezane z »vitalno silo« in se po tem razlikujejo od anorganskih spojin. Ločevanje se je končalo s sintezo sečnine iz anorganskih reaktantov, ki jo je izvedel Friedrich Wöhler leta 1828. K razvoju organske kemije so veliko prispevali Alexander William Williamson s sintezo etrov in Christopher Kelk Ingold, ki je, med drugim, odkril mehanizme substitucijskih reakcij.
Enačbe[uredi | uredi kodo]

4 + 2 O
2 → CO
2 + 2 H
2O je razvidno, da je treba pred kisikom na strani reaktantov in vodo na strani produktov postaviti koeficient 2, da bo v skladu z zakonom o ohranitvi mase količina vseh elementov ostala nespremenjena
Kemijske enačbe so grafični prikazi kemičnih reakcij. Sestavljene so iz kemijskih ali strukturnih formul reaktantov na levi in produktov na desni strani enačbe. Reaktanti in produkti so ločeni s puščico (→), ki simbolizira kemično spremembo in nakazuje smer in vrsto reakcije.[7] Povratne (reverzibilne) reakcije so označene z dvema nasprotnima puščicama (⇌). Enačbe morajo biti v skladu z zakonom o ohranitvi mase uravnovešene, tako da je število atomov vseh elementov na obeh straneh enačbe enako. Enostavno enačbo se uravnovesi s štetjem molekul A, B, C in D. Njihovo število se zapiše s celimi števili a, b, c in d pred formulami molekul:[8]
Bolj zapletene reakcije se prikazujejo z reakcijskimi shemami, ki razen reaktantov in produktov prikazujejo tudi vmesne produkte ali prehodna stanja. V kemijski enačbi je mogoče navesti tudi nekaj drugih podatkov. Ob kemijski formuli je lahko navedeno na primer agregatno stanje, nad puščico pa na primer dodajanje vode, segrevanje, osvetljevanje, katalizator in podobno. Enake podatke je mogoče zapisati tudi pod puščico, pogosto s predznakom minus (-).

Za zapletene sinteze je zelo uporabna retrosintezna analiza. Takšna analiza se začne iz produkta, na primer s cepljenjem izbranih kemičnih vezi, da bi se prišlo do uporabnih začetnih reaktantov. V retro reakcijah se uporablja posebna puščica (⇒).[9]
Osnovne reakcije[uredi | uredi kodo]
Osnovne reakcije so najenostavnejše reakcije, v katerih ni vmesnih produktov.[10] Večina kemičnih reakcij je sestavljenih iz več osnovnih reakcij, ki potekajo vzporedno ali zaporedno. Zaporedje korakov v posamezni osnovni reakciji se imenuje reakcijski mehanizem. V osnovne reakcije je vključenih samo nekaj molekul, običajno ena ali dve.[11]

Najpomembnejše osnovne reakcije so enomolekularne ali dvomolekulare reakcije. Med enomolekularne reakcije spadata na primer izomerizacija in disociacija v eno ali več drugih molekul. Takšne reakcije zahtevajo dodatek energije v obliki toplote ali svetlobe. Značilna enomolekularna reakcija je cis–trans izomerizacija spojine, v kateri se njena cis-oblika pretvori v trans-obliko in obratno.[12]
V značilni disociacijski reakciji se vez v molekuli razcepi (pretrga), pri čemer nastaneta dva fragmenta molekule. Razcepljenje je lahko homolitsko ali heterolitsko. V prvem primeru se vez razdeli tako, da vsak produkt obdrži svoj vezni elektron in postane nevtralen radikal. V drugem primeru elektrona iz kemične vezi ostaneta na enem od produktov, tako da nastaneta dna različno nabita iona. Disociacija igra pomembno vlogo v proženju verižnih reakcij, na primer reakcije vodik-kisik in polimerizacij.
- Disociacija molekule AB v fragmenta A in B
V dvomolekularnih reakcijah dve molekuli trčita in se zlijeta v eno. Takšno zlivanje se imenuje sinteza ali adicija.
Druga možnost je, da se samo del ene molekule prenese na drugo. Takšne so na primer redoks in kislo-bazične reakcije. V redoks reakcijah je preneseni delec elektron, v kislo-bazičnih reakcijah pa proton. Tovrstne reakcije se imenujejo tudi metateze.
na primer
Kemično ravnovesje[uredi | uredi kodo]
Večina kemičnih reakcij je reverzibilnih, se pravi da lahko tečejo v obe smeri. Reakciji v desno in v levo imata praviloma različni hitrosti, ki sta odvisni od koncentracij in se zato s časom reakcije spreminjata. Ker je koncentracija produktov na začetku enaka nič, je tudi hitrost povratne reakcije na začetku enaka nič. Z naraščanjem koncentracij produktov hitrost reakcije v levo raste, dokler ne doseže vrednosti, ki jo ima reakcija v desno. V tem trenutku se vzpostavi tako imenovano kemično ravnovesje. Čas do vzpostavitve ravnotežja je odvisen od reaktantov in produktov, temperature in tlaka in je določen z minimumom proste energije. V ravnotežju je Gibbsova prosta energija enaka nič. Odvisnost ravnotežja od tlaka se lahko razloži z Le Chatelierovim načelom: ker se s povečanjem tlaka zmanjša volumen, se bo ravnotežje z naraščanjem tlaka pomaknilo na tisto stran, kjer je manjše število molov plina.[13]
Reakcija se v ravnotežju stabilizira. Izkoristek reakcije se lahko poveča z odvzemanjem produktov iz reakcijske zmesi ali spremeni s spreminjanjem temperature in/ali tlaka. Sprememba koncentracij reaktantov ne vpliva na konstanto ravnotežja, vpliva pa na njegov položaj.
Termodinamika[uredi | uredi kodo]
Kemične reakcije se podrejajo zakonom termodinamike. Same od sebe potekajo samo, če so eksergone, se pravi da sproščajo energijo. Prosta energija reakcije je sestavljena iz dveh različnih termodinamičnih količin – entalpije in entropije:[14]
- .
- G: prosta energija, H: entalpija, T: temperatura, S: entropija, Δ: razlika (sprememba med začetnim in končnim stanjem)
Reakcije so lahko eksotermne ali endotermne. V eksotermnih reakcijah je sprememba entalpije ΔH negativna, se pravi da se energija v njih sprošča. Značilna primera eksotermnih reakcij sta obarjanje in kristalizacija, v katerih se iz neurejene plinske ali tekoče faze izloči trdna snov. Njihovo nasprotje so endotermne reakcije, ki za svoj potek porabljajo toploto iz okolice. V njih se poveča entropija sistema, pogosto s tvorbo plinastih reakcijskih produktov z visoko entropijo. Ker entropija s temperaturo raste, številne endotermne reakcije laže potekajo pri visokih temperaturah in obratno.
Sprememba temperature lahko včasih obrne predznak entalpije reakcije. Takšen primer je redukcija molibdenovega dioksida z ogljikovim monoksidom:
- ;
Reakcija tvorjenja ogljikovega dioksida in molibdena je pri nizkih temperaturah endotermna, z naraščanjem temperature pa vedno manj.[15] ΔH° pri 1855 K je enaka nič, nad to temperaturo pa postane reakcija eksotermna.
Sprememba temperature lahko obrne tudi tendenco smeri reakcije. Takšna je na primer tvorba vodnega plina:
ki poteka pri nizkih temperaturah, pri 1100 K pa se smer reakcije obrne.[15]
Reakcije se lahko opiše tudi z notranjo energijo, ki upošteva spremembe entropije, volumna in kemičnega potenciala. Slednji je odvisen od številnih dejavnikov, med drugim od aktivnosti udeleženih spojin.[16]
- U: notranja energija, S: entropija, p: tlak, μ: kemični potencial, n: število molekul, d: diferencial
Kinetika[uredi | uredi kodo]
Kemijska kinetika preučuje hitrosti kemičnih reakcij. Hitrost kemične reakcije je merilo, kako se med kemično reakcijo s časom spreminjajo koncentracije ali pritiski reaktantov in produktov. Hitrost kemične reakcije je zelo pomembna za načrtovanje industrijskih kemičnih procesov in računanje kemičnega ravnotežja. Na hitrost reakcije najbolj vplivajo:
- Koncentracija reaktantov. Z zvišanjem koncentracije reaktantov se hitrost reakcij praviloma poveča, ker se poveča število trkov med molekulami v enoti časa. Hitrost nekaterih reakcij ni odvisna od koncentracije reaktantov. Takšne reakcije se štejejo za reakcije ničtega reda.
- Površina, razpoložljiva za stik med reaktanti (aktivna površina), je pomembna zlasti za trdne reaktante v heterogenih sistemih. Večja aktivna površina pomeni večjo hitrost reakcije.
- Tlak. S povečanjem tlaka se zmanjša volumen med molekulami in poveča frekvenca trkov med njimi.
- Aktivacijska energija, ki je definirana kot količina energije, ki je potrebna, da reakcija steče in nato spontano poteka. Visoka aktivacijska energija pomeni, da reaktanti potrebujejo za začetek reakcije več energije od reaktantov z nižjo aktivacijsko energijo.
- Temperatura. S povečanjem temperature se poveča energija molekul in s tem gibljivost, kar pomeni več trkov v enoti časa.
- Prisotnost ali odsotnost katalizatorja. Katalizator je snov, ki spremeni mehanizem reakcije, zniža aktivacijsko energijo in s tem poveča hitrost reakcije. Katalizator se med reakcijo ne spremeni ali porabi in se lahko ponovno uporabi.
- V nekaterih reakcijah je za cepitev vezi na začetku reakcije potrebno elektromagnetno sevanje, običajno kot ultravijolična svetloba. To velja zlasti za reakcije, v katere so vključeni radikali:
Več teorij omogoča izračun hitrosti reakcij na molekularni ravni. To področje kemije se imenuje reakcijska dinamika. Hitrost reakcij prvega reda, na primer razpada snovi A, je enaka:
oziroma
- k: konstanta reakcijske hitrosti z dimenzijo 1/čas, [A](t): koncentracija v času t, [A]0: začetna koncentracija
Hitrost reakcij prvega reda je odvisna samo od koncentracije in lastnosti reaktantov. Reakcija sama se lahko opiše z zanjo značilnim razpolovnim časom. Za opis reakcij višjega reda je potrebnih več konstant hitrosti. Odvisnost konstante hitrosti od temperature je običajno skladna z Arrheniusovo enačbo:
- Ea: aktivacijska energija, kB: Boltzmanova konstanta
Eden od najenostavnejših modelov reakcijske hitrosti je teorija trkov. Bolj realistični modeli so prilagojeni specifičnim primerom in vključujejo teorijo prehodnega stanja, izračun potencialne energije površine, Marcusovo teorijo in Rice–Ramsperger–Kassel–Marcus (RRKM) teorijo.[17]
Vrste reakcij[uredi | uredi kodo]

Kemične reakcije razvrščamo po več kriterijih, ki se včasih bolj ali manj prekrivajo.
Štiri osnovne vrste[uredi | uredi kodo]
Sinteza[uredi | uredi kodo]
Sinteza je kemična reakcija, v kateri iz dveh ali več enostavnih snovi nastane bolj zapletena snov. Sinteze imajo naslednjo splošno obliko:
Primer sinteze je sinteza amonijaka iz dušika in vodika:
Drug primer je reakcija vodika in kisika, v kateri nastaja voda.[18]
Razpad ali analiza[uredi | uredi kodo]
Razpad je kemična reakcija, v kateri bolj zapletena spojina razpade na več enostavnih spojin ali elementov. Razpad je torej nasprotje sinteze in se lahko v splošni obliki zapiše kot:
Primer razpada je razpad amonijevega(VI) kromata:
Enojna zamenjava[uredi | uredi kodo]
Enojna zamenjava je kemična reakcija, v kateri se eden od elementov v spojini zamenja z drugim elementom.[18] Reakcija se zapiše v naslednji splošni obliki:
Primera enojne zamenjave sta naslednji reakciji:
Dvojna zamenjava[uredi | uredi kodo]
Dvojna zamenjava ali metateza je reakcija, v kateri anioni in kationi dveh spojin zamenjajo svoja mesta in tvorijo dve povsem novi spojini.[18] Reakcijo se zapiše v naslednji splošni obliki:[19]
Primer dvojne zamenjave je reakcija barijevega klorida (BaCl2) z magnezijevim sulfatom (MgSO4), v kateri SO42− anion zamenja mesto z anionom Cl-, da nastaneta spojini BaSO4 in MgCl2. Drug primer je reakcija natrijevega klorida s srebrovim nitratom, v kateri se obarja srebrov klorid:
Dvojna zamenjava je tudi reakcija svinčevega(II) nitrata s kalijevim jodidom, v kateri nastaneta svinčev(II) jodid in kalijev nitrat:
Oksidacija in redukcija[uredi | uredi kodo]


Redukcijsko/oksidacijske reakcije se poenostavljeno lahko razloži kot prenos enega ali več elektronov z enega reaktanta (reducent) na drugega (oksidant). V tem procesu reducent oksidira, oksidant pa se reducira. Takšna razlaga je za večino redoks reakcij zadostna, vendar ni povsem točna. Oksidacija je natančneje definirana kot zvišanje oksidacijskega stanja, redukcija pa kot znižanje oksidacijskega stanja. V praksi to pomeni, da prenos elektronov vedno spremeni oksidacijsko stanje, veliko reakcij iz kategorije redoks reakcij pa poteka tudi brez prenosa elektrona. Takšne so na primer reakcije spojin s kovalentnimi vezmi.[20]
V naslednji redoks reakciji kovinski natrij reagira s plinastim klorom in tvori ionsko spojino natrijev klorid (kuhinjska sol):
V tej reakciji je natrij prešel iz oksidacijskega stanja 0 (kot element) v oksidacijsko stanje +1. Povedano drugače, izgubil je en elektron in oksidiral. Oddani elektron je prejel klor in iz oksidacijskega stanja 0 (kot element) prešel v oksidacijsko stanje -1, torej se je reduciral. Klor kot prejemnik (akceptor) elektronov je oksidant, natrij kot dajalec (donor) elektronov pa reducent.
Poseben primer redoks reakcije je disproporcionacija, v kateri se del reaktanta oskidira, drug del pa se na ta račun reducira. Takšna je na primer disproporcionacija Sn2+ iona:
Kateri reaktant v redoks reakciji bo reducent in kateri oksidant, je mogoče napovedati iz elektronegativnosti njihovih elementov. Elementi z nizko elektronegativnostjo, kakršna je večina kovin, bodo zlahka donirali elektrone in oksidirali, torej so reducenti. V nasprotju z njimi je veliko njihovih ionov z visokimi oksidacijskimi števili, na primer H
2O
2, MnO−
4, CrO
3, Cr
2O2−
7, OsO
4, ki lahko prejmejo enega ali več elektronov in so močni oksidanti.
Število elektronov, oddanih ali sprejetih v redoks reakciji, je mogoče predvideti iz elektronske konfiguracije elementov reaktanta. Elementi poskušajo doseči nizkoenergijsko konfiguracijo žlahtnega plina, zato bodo alkalne kovine zlahka oddale, halogeni pa zlahka prejeli en elektron. Žlahtni plini so kemično neaktivni.[21]
Pomemben razred redoks reakcij so elektrokemične reakcije, v katerih kot reducent služijo elektroni iz zunanjega vira. Tovrstne reakcije so pomembne zlasti za proizvodnjo kemičnih elementov, na primer natrija, klora[22] in aluminija. Obratni procesi, v katerem se elektroni v redoks reakciji sproščajo, se dogajajo v primarnih in sekundarnih baterijah.
Tvorjenje kompleksov[uredi | uredi kodo]

Tvorjenje kompleksov je kemična reakcija, v kateri se na centralni (običajno kovinski) ion veže več ligandov in tvori koordinacijski kompleks oziroma kompleksno spojino. Ligandi so na centralni atom vezani praviloma s koordinirano kovalentno vezjo, tako da donirajo elektrone svojih samskih elektronskih parov prazni elektronski orbitali kovine. Od tod tudi izraz, da so koordinirani s centralnim atomom.
Ligandi so Lewisove baze. Lahko so ioni ali nevtralne molekule, na primer ogljikov monoksid, amonijak ali voda:
Število ligandov, ki se vežejo na centralni atom, se podreja pravilu 18 elektronov. Za kemijo kompleksnih spojin je značilno, da v njej prevladujejo interakcije med s in p molekulskimi orbitalami ligandov in d orbitalami kovinskih ionov. s, p in d orbitale kovine lahko sprejmejo skupno 18 elektronov (v bloku f se njihovo število poveča na 32). Maksimalno koordinacijsko število nekaterih kovin je torej odvisno od elektronske konfiguracije njihovega iona, točneje od števila praznih orbital, in od razmerja velikosti njihovega iona in velikosti ligandov.
V reakcije so lahko vključeni tudi izmenjava ligandov, v kateri se eden ali več ligandov zamenja z drugimi, in redoks procesi, ki spremenijo oksidacijsko stanje centralnega kovinskega iona.[23]
Kislo-bazične reakcije[uredi | uredi kodo]
Po Brønsted–Lowryjevi teoriji kislin in baz je v kislo-bazično reakcijo vključen prenos protona (H+) z enega reaktanta (kislina) na drugega (baza). Ko se proton odcepi od kisline, nastane kislinina konjugirana baza. Ko baza sprejme proton, nastane njena konjugirana kislina.[24] Povedano drugače, kisline so donorji, baze pa akceptorji protona:
Mogoča je tudi povratna reakcija, zato so kislina/baza in konjugirana baza/kislina vedno v ravnotežju. Ravnotežje je določeno s konstantama disociacije udeležene kisline (Ka) in baze (Kb). Poseben primer kislo-bazične reakcije je nevtralizacija, ki poteče med natančno enakima količinama kisline in baze, pri čemer nastane nevtralna sol.
Kislo-bazične reakcije so definirane na več načinov, odvisno od uporabljenega koncepta kislina-baza. Najbolj pogoste so:
- Arrheniusova definicija: kisline v vodi disociirajo in tvorijo H3O+ ione; baze v vodi disociirajo in tvorijo OH-ione.
- Brønsted-Lowryjeva definicija: kisline so donatorji protona (H+), baze pa akceptorji protona, kar vključuje Arrheniusovo definicijo.
- Lewisova definicija: kisline so akceptorji elektronskega para, baze pa donatorji elektronskega para, kar vključuje Brønsted-Lowryjevo definicijo.
Obarjanje[uredi | uredi kodo]

Obarjanje ali precipitacija je kemična reakcija, v kateri v raztopini ali trdni snovi nastane trden produkt. Obarjanje se pojavi, ko koncentracija raztopljenih ionov preseže mejo njihove topnosti.[25] Proces se pospeši z dodajanjem obarjalnega sredstva ali odstranjevanjem topila. V hitrem obarjanju nastajajo amorfne ali mikrokristalinične oborine, v počasnem pa lahko nastajajo veliki kristali. Veliki kristali lahko nastanejo tudi s prekristalizacijo mikrokristalnih soli.[26]
Reakcije trdnin[uredi | uredi kodo]
Reakcije potekajo tudi med trdninami. Zaradi relativno majhnih difuzijskih hitrosti v trdninah so hitrosti reakcij zelo majhne v primerjavi s hitrostmi v tekoči ali plinski fazi. Hitrosti rastejo z naraščanjem reakcijske temperature in večanjem površine, se pravi z uprašitvijo reaktantov.[27]
Reakcije na meji trdnina/plin[uredi | uredi kodo]
Reakcije na fazni meji trdnina/plin lahko potekajo tudi pri zelo nizkem tlaku, kot je ultravisok vakuum.[28][29] Reakcije so v nekaterih primerih povezane s katalizo.
Fotokemične reakcije[uredi | uredi kodo]

V fotokemičnih reakcijah atomi in molekuje absorbirajo energijo (foton) svetlobe, preidejo v vzbujeno stanje in nato vso absorbirano energijo porabijo za razbijanje kemičnih vezi in tvorjenje radikalov. Fotokemične reakcije vključujejo reakcije vodik-kisik, radikalske polimerizacije, verižne reakcije in preureditve.[30]
Fotokemijo vključujejo številni pomembni procesi. Najprimernejši zgled je zagotovo fotosinteza, s katero zelene rastline s pomočjo klorofila s sončno energijo pretvarjajo ogljikov dioksid in vodo v glukozo in kot stranski produkt sproščajo kisik. Ljudje s pomočjo sončne svetlobe tvorijo vitamin D. Vid omogoča sinteza rodopsina v očeh pod vplivom vidne svetlobe.[12] Pri kresnicah encim v zadku žuželke katalizira reakcijo, ki ima za posledico bioluminescenco.[31] Pomembna je tudi sinteza ozona v Zemljinem ozračju, ki spade v atmosfersko kemijo.
Kataliza[uredi | uredi kodo]
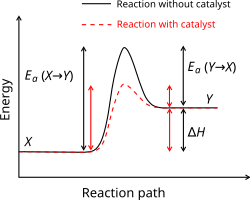

V kataliziranem procesu reakcija ne poteče neposredno, ampak preko reakcije s tretjo snovjo, imenovano katalizator. Katalizator je aktiven udeleženec reakcije, vendar se v njej ne porablja in se po končani reakciji vrne v začetno stanje. Stranski procesi lahko zavrejo delovanje katalizatorja, ga deaktivirajo ali celo uničijo. Katalizatorji so lahko v drugačnem agregatnem stanju kot reaktanti (heterogeni) ali enakem agregatnem stanju (homogeni). Pri heterogeni katalizi med značilne stranske procese spada koksanje, v katerem se površina katalizatorja prevleče s polimernimi stranskimi produkti. Heterogen katalizator se v sistemu trdno-tekoče lahko raztopi, v sistemu trdno-plin pa izpari. Katalizatorji, ki reakcije ne pospešujejo, ampak jo zavirajo, so inhibitorji.[32][33] Snovi, ki povečajo aktivnost katalizatorja, so promotorji, snovi, ki ga deaktivirajo, pa katalizatorski strupi. S katalizatorji lahko potekajo tudi reakcije, ki so kinetično inhibirane z visoko aktivacijsko energijo.
Heterogeni katalizatorji so običajno trdni in fino uprašeni, da se poveča njihova površina. Pri heterogeni katalizi so še posebej pomembne kovine iz platinske skupine in druge prehodne kovine, ki se uporabljajo pri hidrogeniranju, katalitskem reformingu in sintezi različnih kemikalij, na primer dušikove kisline in amonijaka. Med homogene katalizatorje spadajo kisline, ki povečajo nukleofilnost karbonilov in omogočajo reakcije, ki bi z elektrofili ne potekale. Prednost homogenih katalizatorjev je, da se zlahka mešajo z reaktanti, slabost pa, da jih je po končani reakciji težko izločiti iz produktov. V številnih industrijskih procesih se zato daje prednost heterogenim katalizatorjem.[34]
Reakcije v organski kemiji[uredi | uredi kodo]
V organski kemiji so razen oksidacije, redukcije in kislo-bazičnih reakcij prisotne tudi številne druge reakcije, v katere so vključene kovalentne vezi med ogljikovimi atomi ali ogljikovimi in heterogenimi atomi (kisik, dušik, halogeni…). Številne organske reakcije so dobile ime po njihovih odkriteljih.
Substitucija[uredi | uredi kodo]
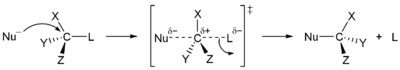
V substituciji se funkcionalna skupina v neki spojini zamenja z drugo funkcionalno skupino.[35] Reakcije se po vrsti substituenta delijo na nukleofilne, elektrofilne in radikalske substitucije.
V nukleofilni substituciji se atom ali molekula s prebitkom elektronov in s tem negativnim nabojem zamenja z drugim atomom ali delom substrata molekule. Elektronski par nukleofila napade substrat in tvori novo vez, skupina, ki se odcepi, pa s seboj odnese elektronski par. Nukleofili so lahko električno nevtralni ali negativno nabiti, substrat pa je običajno nevtralen ali pozitivno nabit. Primeri nukleofilov so hidroksidni ion, alkoksidi, amini in halidi. Tovrstne reakcije potekajo predvsem v alifatskih ogljikovodikih in redko v aromatskih ogljikovodikih. Slednji imajo visoko gostoto elektronov, zato lahko nukleofilna aromatska substitucija poteka samo s skupinami, ki zelo močno privlačijo elektrone. Nukleofilna substitucija poteka po dveh različnih mehanizmih, SN1 in SN2. V oznaki S pomeni substitucijo, N nukleofilno, številka pa kinetski red reakcije (enomolekularna ali dvomolekularna).[36]
Reakcija SN1 poteče v dveh korakih. V prvem koraku se zapuščajoča skupina odcepi, pri čemer nastane karbokation. Sledi hitra reakcija z nukleofilom.[37]
V mehanizmu SN2 tvori nukleofil z napadeno molekulo prehodno stanje, iz katerega se zatem odcepi zapuščajoča skupina. Mehanizma se razlikujeta po stereokemiji produktov. SN1 vodi do nestereospecifične adicije in ne vpliva na hiralno središče, ampak povzroči geometrijsko izomerijo (cis/trans). Mehanizem SN2 (Waldenova inverzija) v nasprotju s prvim povzroči spremembo stereokemije.[38]
Elektrofilna substitucija je nasprotje nukleofilne substitucije. Napadajoči atom ali molekula je elektrofil z majhno gostoto elektronov in zato pozitivnim nabojem. Značilni eletrofili so ogljikov atom karbonilne skupine, karbokationi ter žveplovi ali nitronijevi kationi. Reakcija je značilna skoraj izključno za aromatske ogljikovodike. Imenuje se elektrofilna aromatska substitucija. Napad elektrofila se odrazi v tako imenovanem σ-kompleksu, prehodnem stanju, v katerem aromatski sistem razpade. Ko kompleks zapusti odcepljena skupina, običajno proton, se aromatičnost ponovno vzpostavi. Alternativa aromatske elektrofilne substitucije je alifatska elektrofilna substitucija. Podobna je prvi in poteka po dveh glavnih mehanizmih, SE1 in SE2.[39]

Tretja vrsta substitucij so radikalske substitucije, v katerih je napadajoči delec radikal.[35] Radikalski procesi so značilni za verižne reakcije, na primer reakcije alkanov s halogeni. V prvem koraku svetloba ali toplota razcepi molekule, ki vsebujejo halogen, da nastanejo radikali. Reakcija se nadaljuje kot plaz, dokler se ne srečata dva radikala in se spojita.[40]
- Reakcije v verižni reakciji so radikalske substitucije
Adicija in eliminacija[uredi | uredi kodo]
Adicija in njeno nasprotje eliminacija sta reakciji, ki spremenita število substituent na ogljikovem atomu in tvorita ali cepita večkratne vezi. Dvojne ali trojne vezi lahko nastajajo z eliminacijo ustreznih skupin. Podobno kot nukleofilna substitucija imata tudi adicija in eliminacija več mogočih reakcijskih mehanizmov, imenovanih po redu reakcije. V mehanizmu E1 se najprej odcepi odhajajoča skupina, da nastane karbokation. V naslednjem koraku se z eliminacijo protona (deprotonacija) tvori dvojna vez. V mehanizmu E1cb je vrstni red obrnjen, tako da se najprej odcepi proton. Ta mehanizem zahteva udeležbo baze.[41] Zaradi podobnih reakcijskih pogojev je eliminacijama E1 in E1cb vedno nasprotna substitucija SN1.[42]



Tudi mehanizem E2 zahteva prisotnost baze. V tem mehanizmu potekata napad baze in eliminacija odhajajoče skupine istočasno, pri čemer nastane neionski vmesni produkt. V nasprotju z eliminacijo E1 ima lahko končni produkt v eliminaciji E2 več različnih stereokemijskih konfiguracij, ker se napad baze prednostno dogaja na anti- položaju glede na odhajajočo skupino. Zaradi podobnih pogojev in reagentov je eliminaciji E2 vedno nasprotna substitucija SN2.[43]

Nasprotje eliminacije je adicija, v kateri se dvojne ali trojne vezi pretvorijo v enojne vezi. Podobno kot v substitucijskih reakcijah je tudi v adicijskih reakcijah več mehanizmov, odvisnih od vrste napadajočega delca. V elektrofilni adiciji vodikovega bromida na primer elektrofil (proton) napade dvojno vez in tvori karbokation, ki nato reagira z nukleofilom (bromidni ion). Karbokation lahko nastane na eni ali drugi strani dvojne vezi, odvisno od skupin na obeh straneh dvojne vezi. Konfiguracijo se lahko napove z Markovnikovim pravilom,[44] ki pravi, da se bo v heterolitski adiciji polarne molekule na alken ali alkin bolj elektronegativen (nukleofilen) atom (ali del) vezal na ogljikov atom z manjšim številom vodikovih atomov.[45]
Če adicija funkcionalne skupine poteče na manj substituiranem ogljikovem atomu dvojne vezi, elektrofilna substitucija s kislinami ni mogoča. V tem primeru se lahko uporabi hidroboracijsko-oksidacijska reakcija, v kateri v prvem koraku bor deluje kot elektrofil in se adira na manj substituiran ogljikov atom. V drugem koraku borov atom napade nukleofilni vodikov peroksid ali halogenski anion.[46]
Adicije na elektronsko bogate alkene in alkine so večinoma elektrofilne. Nukleofilne adicije igrajo pomembno vlogo v spojinah z večkratnimi vezmi med ogljikom in heteroatomom. Najpomembnejši predstavnik takšne vezi je karbonilna skupina. Ti procesi so pogosto povezani z eliminacijo, tako da je po reakciji karbonilna skupina ponovno prisotna. Reakcija se zato imenuje adicijsko-eliminacijska in se pojavlja v derivatih karboksilnih kislin kot so kloridi, estri in anhidridi. Reakcijo pogosto katalizirajo kisline ali baze. Kisline povečajo elektrofilnost karbonilne skupine z vezavo na kisikov atom, medtem ko baze povečajo nukleofilnost z napadom na nukleofil.[47]

Nukleofilna adicija karboaniona ali kakšnega drugega nukleofila na dvojno vez alfa, beta nenasičene karbonilne spojine lahko poteče z Mihaelovo reakcijo, ki spade v obširen razred konjugiranih adicij. Je ena od najbolj uporabnih metod za mehko tvorjenje dvojnih vezi C-C.[48][49][50]
Nekaterih adicij se z nukleofili in elektrofili ne da izvesti, lahko pa se jih izvede s prostimi radikali. Ker radikalske adicije potekajo kot verižne reakcije, so osnova za tako imenovane radikalske polimerizacije.[51]
Druge organske reakcije[uredi | uredi kodo]



Prerazporeditev (izomerizacija) je kemična reakcija znotraj molekule, v kateri nastane strukturni izomer izvirne molekule. Ena od prerazporeditev je premik hidrida (H-) na primer v Wagner-Meerweinovi prerazporeditvi, v kateri se vodik, alkilna ali arilna skupina prestavijo z ogljikovega atoma na sosednji ogljikov atom. Večina prerazporeditev je povezanih s prekinitvijo stare in tvorbo nove vezi ogljik-ogljik. Drugi primeri so sigmatropske reakcije, na primer Copeova prerazporeditev.[52]
Ciklične prerazporeditve vključujejo cikloadicije in bolj splošno periciklične reakcije, v katerih molekule z dvema ali več dvojnimi vezmi tvorijo ciklično molekulo. Pomemben primer cikloadicije je Diels–Alderjeva reakcija ([4+2] cikloadicija) med konjugiranim dienom in substituiranim alkenom, v kateri nastane substituiran cikloheksenski sistem.[53]
Ali bo določena cikloadicija potekla ali ne, je odvisno od elektronskih orbital reaktantov, ker se bodo prekrile in tvorile nove vezi samo orbitale z enakim predznakom valovne funkcije. Cikloadicijo običajno pospešujeta svetloba ali toplota. Njuni učinki lahko povzročijo različne razporeditve vzbujenih elektronov vpletenih molekul, zato lahko dajo različne rezultate. Diels-Adlerjeve reakcije [4+2] pospešuje toplota, medtem ko cikloadicije [2+2] selektivno inducira svetloba.[54] Po cikloadiciji je potencial za razvoj stereoizomerov omejen z značilnostmi orbital in opisan z Woodward–Hoffmannovimi pravili.[55]
Biokemične reakcije[uredi | uredi kodo]

Biokemične reakcije, kakršne potekajo v organizmih, večinoma vodijo encimi. To so beljakovine, ki lahko specifično katalizirajo posamezno reakcijo, zato so reakcije vodene zelo natančno. Reakcija poteka na aktivnem mestu, majhnem delu encima, ki je običajno v razcepu ali žepu, obdanem z aminokislinskimi ostanki. Preostali del encima služi predvsem kot stabilizator. Katalitsko delovanje encimov temelji na več mehanizmih, v katere so vključeni oblika molekule, jakost vezi, sosedstvo in orientacija molekul, sorodnih encimu, oddajanje ali prejemanje protonov (kislo/bazična kataliza), elektrostatične interakcije in še veliko drugih.[56]
Biokemične reakcije potekajo v živih organizmih in so kot celota znane kot presnova. Med najpomembnejše mehanizme spada anabolizem, v katerem različni z DNA in encimi kontrolirani procesi iz majhnih molekul proizvajajo velike molekule, na primer beljakovine in ogljikove hidrate.[57] Vire energije za te procese preučuje bioenergetika. Pomemben vir energije je glukoza, ki jo lahko proizvajajo rastline s fotosintezo ali se dobiva iz hrane. Vsi organizmi uporabijo to energijo za sintezo adenozin trifosfata (ATP), ki služi kot vir energije v drugih reakcijah.
Uporaba[uredi | uredi kodo]

Kemične reakcije so ključne za kemijsko inženirstvo, v katerem se uporabljajo za sintezo novih spojin iz naravnih surovin, kot so nafta in rude. Ključna je učinkovitost reakcije, ki poveča izkoristek in zmanjša količino reagentov, vnesene energije in odpadkov. Za zmanjšanje potrebne energije in povečanje hitrosti reakcij so izredno pomembni katalizatorji.[58][59]
Nekatere specifične reakcije imajo zelo specifično uporabnost. Termitska reakcija, na primer, je uporabna za generiranje svetlobe in toplote v pirotehniki in varjenju. Reakcija je manj obvladljiva kot običajno avtogeno, obločno in električno varjenje, vendar zahteva mnogo manj opreme in znanja, zato se še vedno uporablja predvsem v odročnih krajih.[60]
Spremljanje reakcij[uredi | uredi kodo]
Mehanizmi spremljanja kemičnih reakcij so zelo odvisni od hitrosti reakcije. Sorazmerno počasni procesi se lahko analizirajo in situ z merjenjem koncentracij in vrst produktov. Pomembna orodja za analiziranje v realnem času so merjenje pH, optičnih lastnosti (barva) in emisijskega spektra. Manj dostopna, toda precej učinkovita metoda je vključitev radioaktivnega izotopa v reakcijo in opazovanje njegovega gibanja in spreminjanja s časom. Ta metoda se pogosto uporablja za analiziranje prerazporeditve snovi v človeškem telesu. Hitrejše reakcije se pogosto spremljajo z ultrahitro lasersko spektroskopijo. S femtosekundnimi laserji je mogoče opazovati kratkoživa prehodna stanja v času do nekaj femtosekund.[61]
Sklici[uredi | uredi kodo]
- ↑ IUPAC. »chemical reaction«. Compendium of Chemical Terminology Internet edition.
- ↑ Weyer, J. (1973). »Neuere Interpretationsmöglichkeiten der Alchemie«. Chemie in Unserer Zeit. Zv. 7, št. 6. str. 177–181. doi:10.1002/ciuz.19730070604.
- ↑ Friedman, Leonard J., Friedman, Samantha J. (2008). The History of the Contact Sulfuric Acid Process (PDF). Boca Raton, Florida: Acid Engineering & Consulting, Inc.
- ↑ Stranges, Anthony N. (2000). "Germany's synthetic fuel industry, 1935–1940". In Lesch, John E. (ur.). The German Chemical Industry in the Twentieth Century. Kluwer Academic Publishers. str. 170. ISBN 978-0-7923-6487-0.
- ↑ Brock, str. 34–55
- ↑ Brock, str. 104–107.
- ↑ Myers, Richard (2009). The Basics of Chemistry. Greenwood Publishing Group. str. 55. ISBN 978-0-313-31664-7.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "chemical reaction equation". doi:10.1351/goldbook.C01034.
- ↑ Corey, E.J. (1988). "Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples". Chemical Society Reviews. 17: 111–133. doi:10.1039/CS9881700111.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "elementary reaction". doi: 10.1351/goldbook.E02035.
- ↑ Frenking, Gernot (2006). Elementarreaktionen. Römpp Chemie-Lexikon. Thieme.
- ↑ 12,0 12,1 Kandori, Hideki (2006). Retinal Binding Proteins. V Dugave, Christophe (ur.). Cis-trans Isomerization in Biochemistry. Wiley-VCH. str. 56. ISBN 978-3-527-31304-4.
- ↑ Atkins, str. 114.
- ↑ Atkins, str. 106–108.
- ↑ 15,0 15,1 Reaction Web.
- ↑ Atkins, str. 150.
- ↑ Atkins, str. 963.
- ↑ 18,0 18,1 18,2 To react or not to react? Utah State Office of Education. Pridobljeno 4. junija 2011.
- ↑ The six types of reaction – The Cavalcade o' Chemistry. Pridobljeno 11. februarja 2016.
- ↑ Glusker, Jenny P. (1991). "Structural Aspects of Metal Liganding to Functional Groups in Proteins". V Christian B. Anfinsen (ur.). Advances in Protein Chemistry. 42. San Diego: Academic Press. str. 7. ISBN 978-0-12-034242-6.
- ↑ Wiberg, str. 289–290.
- ↑ Wiberg, str. 409.
- ↑ Wiberg, str. 1180–1205.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). (2006–) "conjugate acid–base pair". doi: 10.1351/goldbook.C01266
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "precipitation".doi:10.1351/goldbook.P04795.
- ↑ Wingender, Jörg; Ortanderl, Stefanie (July 2009). "Ausfällung". Römpp Chemie-Lexikon. Thieme.
- ↑ Meyer, H. Jürgen (2007). "Festkörperchemie". V Erwin Riedel (ur.). Modern Inorganic Chemistry (3rd ed.). de Gruyter. str. 171. ISBN 978-3-11-019060-1.
- ↑ Wintterlin, J. (1997). "Atomic and Macroscopic Reaction Rates of a Surface-Catalyzed Reaction". Science. 278 (5345): 1931–4. Bibcode:1997Sci...278.1931W. doi:10.1126/science.278.5345.1931. PMID 9395392.
- ↑ Waldmann, T.; Künzel, D.; Hoster, H.E.; Groß, A.; Behm, R.J.R. (2012). "Oxidation of an Organic Adlayer: A Bird's Eye View". Journal of the American Chemical Society. 134 (21): 8817–8822. doi:10.1021/ja302593v. PMID 22571820.
- ↑ Atkins, str. 937–950.
- ↑ Saunders, David Stanley (2002). Insect clocks (Third ed.). Amsterdam:Elsevier. str. 179. ISBN 978-0-444-50407-4.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "catalyst". doi: 10.1351/goldbook.C00876.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "inhibitor". doi: 10.1351/goldbook.I03035.
- ↑ Elschenbroich, Christoph (2008). Organometallchemie (6th ed.). Wiesbaden: Vieweg+Teubner Verlag. str. 263. ISBN 978-3-8351-0167-8.
- ↑ 35,0 35,1 March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7.
- ↑ Hartshorn, S.R. (1973). Aliphatic Nucleophilic Substitution. London:Cambridge University Press. str. 1. ISBN 978-0-521-09801-4.
- ↑ Bateman, Leslie C.; Church, Mervyn G.; Hughes, Edward D.; Ingold, Christopher K.; Taher, Nazeer Ahmed (1940). "188. Mechanism of substitution at a saturated carbon atom. Part XXIII. A kinetic demonstration of the unimolecular solvolysis of alkyl halides. (Section E) a general discussion". Journal of the Chemical Society 979. doi:10.1039/JR9400000979.
- ↑ Brückner, str. 63–77.
- ↑ Brückner, str. 203–206.
- ↑ Brückner, str. 16.
- ↑ Brückner, str. 192.
- ↑ Brückner, str. 183.
- ↑ Brückner, str. 172.
- ↑ Wiberg, str. 950, 1602.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Markownikoff rule". doi: 10.1351/goldbook.M03707.
- ↑ Brückner, str. 125.
- ↑ Latscha, Hans Peter; Kazmaier, Uli; Klein, Helmut Alfons (2008). Organische Chemie: Chemie-basiswissen II (v nemščini). 2 (6th ed.). Springer. str. 273. ISBN 978-3-540-77106-7.
- ↑ Organic Reactions. 2004. doi:10.1002/0471264180. ISBN 978-0-471-26418-7.
- ↑ Hunt, Ian. Chapter 18: Enols and Enolates — The Michael Addition reaction. University of Calgary.
- ↑ Brückner, str. 580.
- ↑ Lechner, Manfred; Gehrke, Klaus; Nordmeier, Eckhard (2003). Macromolecular Chemistry (3rd ed.). Basel: Birkhäuser. str. 53–65. ISBN 978-3-7643-6952-1.
- ↑ Fox, Marye Anne; Whitesell, James K. (2004). Organic chemistry (Third ed.). Jones & Bartlett. str. 699. ISBN 978-0-7637-2197-8.
- ↑ Diels, O.; Alder, K. (1928). "Synthesen in der hydroaromatischen Reihe". Justus Liebig's Annalen der Chemie 460: 98–122. doi:10.1002/jlac.19284600106.
- ↑ Brückner, str. 637–647.
- ↑ Woodward, R.B.; Hoffmann, R. (1965). "Stereochemistry of Electrocyclic Reactions". Journal of the American Chemical Society 87 (2): 395–397.doi:10.1021/ja01080a054..
- ↑ Karlson, Peter; Doenecke, Detlef; Koolman, Jan; Fuchs, Georg; Gerok, Wolfgang (2005). Karlson Biochemistry and Pathobiochemistry (v nemščini) (16th ed.).Thieme. str. 55–56. ISBN 978-3-13-357815-8.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–).
- ↑ Emig, Gerhard; Klemm, Elias (2005). Technical Chemistry (v nemščini) (5th ed.).Springer. str. 33–34. ISBN 978-3-540-23452-4.
- ↑ Trost, B. (1991). "The atom economy – a search for synthetic efficiency". Science. 254 (5037): 1471–1477. Bibcode:1991Sci...254.1471T.doi:10.1126/science.1962206. PMID 1962206.
- ↑ Weismantel, Guy E (1999). John J. McKetta (ur.). Encyclopedia of Chemical Processing and Design. 67. CRC Press. str. 109. ISBN 978-0-8247-2618-8https://books.google.com/books?id=MfjDlUe8Kc0C&pg=PA109.
- ↑ Atkins, str. 987
Viri[uredi | uredi kodo]
- Samuel Glasstone. Textbook of Physical Chemistry, 14. izdaja, Naučna knjiga, Beograd 1967.
- Eckhar Eckhard Ignatowitz, Gerhard Haering. Chemie für Schule und Beruf. Europa-Lehrmittel, Haan-Gruiten. str. 22ff, 41ff. ISBN 3-8085-7054-7.
- Michael Wächter. Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik, Hamburg 2000, str. 154-169 ISBN 3-582-01235-2.
- Gerhart Jander. Einführung in das anorganisch-chemische Praktikum. S. Hirzel Verlag, Stuttgart 1990 (in 13. Aufl.), ISBN 3-7776-0477-1.
- Bertram Schmidkonz: Praktikum Anorganische Analyse. Verlag Harri Deutsch, Frankfurt 2002, ISBN 3-8171-1671-3
- Atkins, Peter W.; de Paula, Julio (2006). Physical Chemistry (4th izd.). Weinheim: Wiley-VCH. ISBN 978-3-527-31546-8.
- Brock, William H. (1997). Viewegs Geschichte der Chemie (v nemščini). Braunschweig: Vieweg+Teubner Verlag. ISBN 978-3-540-67033-9.
- Brückner, Reinhard (2004). Reaktionsmechanismen (v nemščini) (3. izd.). München: Spektrum Akademischer Verlag. ISBN 978-3-8274-1579-0.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold F. (2001). Inorganic chemistry. Academic Press. ISBN 978-0-12-352651-9.
- . Enciklopedija Britannica (v angleščini). Zv. 6 (11. izd.). 1911. str. 26–33.














![{\displaystyle v=-{\frac {d[{\ce {A}}]}{dt}}=k\cdot [{\ce {A}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf12af76b73ff89be826e56cd391bf7e8d401128)
![{\displaystyle {\ce {[A]}}(t)={\ce {[A]_0}}\cdot e^{-k\cdot t}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f43504955387f0b7ee848c9d91e40dd63706dd5)














![{\displaystyle {\ce {CuSO4 + 4H2O -> [FeSO4(H2O)4]SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d22803a117e6c6523bb708ba7af72ee5aa323af2)