Aminokislina
Amínokislína je v kemiji na splošno vsaka molekula, ki vsebuje tako aminsko (–NH2) kot karboksilno (–COOH) funkcionalno skupino. V biokemiji se ta krajši in splošnejši termin pogosto uporablja za α-aminokisline – aminokisline, pri katerih sta aminska in karboksilna skupina vezani na isti ogljikov atom.
Amínokislínski ostanek je, kar ostane od aminokisline, ko se odcepi molekula vode pri nastanku peptidne vezi.
Vloga aminokislin
[uredi | uredi kodo]Aminokisline so osnovni gradniki beljakovin. Polimerno verigo aminokislinskih ostankov, povezanih s peptidno vezjo, imenujemo polipeptid oziroma beljakovina (protein), če gre za daljšo verigo. Proces nastanka beljakovin v organizmu poteka s prevajanjem informacijske RNK (mRNK). mRNK služi kot matrica za nastanek polipeptidne verige.

Aminokisline, ki so kodirane v standardnem genetskem kodu, se imenujejo proteinogene (beljakovinotvorne) aminokisline. Poznamo 20 proteinogenih (standardnih) aminokislin. Različne kombinacije teh aminokislin tvorijo vse beljakovine, ki jih telo sintetizira; podobno kot 25 črk slovenske abecede tvori celotno naše besedišče. Poleg omenjenih dvajset standardnih aminokislin sta še vsaj dve, ki sta prav tako kodirani v dednini:
Ostale aminokisline, ki so lahko prisotne v beljakovinah, nastanejo iz standardnih aminokislin s pomočjo posttranslacijske modifikacije. Torej v procesu prevajanja mRNK nastane ena od standardnih aminokislin, ki pa kasneje podleže modifikaciji. Posttranslacijska modifikacija je često potrebna, da beljakovina, na primer encim, postane aktivna.
Prolin je edina proteinogena aminokislina, katere α-amino skupina je vključena v cikel. Posledično je prolin sekundarni amin.
V naravi nahajamo poleg proteinogenih aminokislin več kot sto drugih aminokislin. Nekatere so zaznali tudi na meteoritih.
Poleg proteinske sinteze imajo aminokisline tudi druge pomembne vloge v organizmu. Glicin in glutamat imata tudi funkcijo živčnega prenašalca. Mnoge aminokisline se udeležujejo sinteze drugih nebeljakovinskih molekul, pomembnih v organizmu:
- triptofan je prekurzor serotonina,
- glicin je eden od reaktantov za sintezo porfirinov (na primer hema),
- arginin je substrat za sintezo dušikovega oksida ...
Tudi številne neproteinogene aminokisline imajo pomembne fiziološke funkcije:
- γ-aminomaslena kislina (GABA) ima vlogo živčnega prenašalca,
- karnitin je pomemben pri prenosu lipidov znotraj celic,
- ornitin je intermediat ciklusa sečnine,
- hidroksiprolin je sestavni del kolagena ...
Nekatere od 20 standardnih aminokislin imenujeno esencialne aminokisline; to so aminokisline, ki jih telo ne more sintetizirati samo in zato jih moramo nujno vnašati v telo s hrano. Histidin in arginin sta esencialni aminokislini le pri otrocih, ki ju ne morejo sami sintetizirati zaradi nerazvite presnove.
| Esencialne | Neesencialne |
|---|---|
| izolevcin | alanin |
| levcin | asparagin |
| lizin | aspartat |
| metionin | cistein |
| fenilalanin | glutamat |
| treonin | glutamin |
| triptofan | glicin |
| valin | prolin |
| arginin* | serin |
| histidin* | tirozin |
(*) Pogojno esencialni aminokislini
Splošna struktura aminokislin
[uredi | uredi kodo]Splošna struktura proteinogenih α-aminokislin:
R
|
H2N-C-COOH
|
H
R (radikal) predstavlja stransko verigo, ki je specifična za vsako aminokislino posebej. Glede na lastnosti stranske verige razvrstimo aminokisline često v štiri skupine; stranska veriga lahko ima lastnosti šibke baze, šibke kisline, če pa je nevtralna, pa je lahko polarna ali nepolarna.
β-aminokisline:
Pri β-aminokislinah se aminska skupina nahaja na tretjem ogljikovem atomu, vključujoč ogljikov atom iz karboksilne skupine. Po izrazoslovju IUPAC se te aminokisline pravilno imenujejo 3-aminokarboksilne kisline. Najpreprostejši predstavnik je β-alanin.
γ-aminokisline: Aminska skupina se nahaja na četrtem ogljikovem atomu. Pravilen naziv po izrazoslovju IUPAC je 4-aminokarboksilna kislina. Najpreprostejši predstavnik je γ-aminomaslena kislina (GABA).
Nadalje sledi poimenovanje aminokislin po enaki shemi - grška črka v imenu označuje ogljikov atom, na katerega je pripeta amino skupina z ozirom na oddaljenost od karboksilne skupine.
Kisle in bazične lastnosti
[uredi | uredi kodo]V vodnih raztopinah so aminokisline v obliki iona dvojčka (zwitterion), kar pomeni, da je aminska skupina protonirana in karboksilna skupina deprotonirana. Posplošena struktura aminokisline v obliki iona dvojčka:
- H3N+-CHR-COO-
Pri tem deluje aminska skupina kot baza in karboksilna skupina kot kislina.
Kislinsko-bazična titracija aminokisline poteka po naslednji shemi:
- H3N+-CHR-COOH ⇔ H3N+-CHR-COO- ⇔ H2N-CHR-COO-
Če tudi stranska veriga R izkazuje kisle ali bazične lastnosti, tudi ta del molekule sodeluje pri teh ravnotežnih reakcijah.
Neto naboj aminokisline je odvisen od pH-ja topila in od stranske verige aminokisline. Pri določenem pH-ju je vrednost neto naboja nič - to vrednost imenujemo izoelektrična točka.
Izomerija
[uredi | uredi kodo]Skorajda vse aminokisline izkazujejo optično izomerijo in so lahko v dveh izomernih oblikah: L in D. V proteinih in nasploh v naravi nahajamo povečini L-aminokisline. D-aminokisline so prisotne le v nekaterih beljakovinah, ki jih proizvajajo določeni morski organizmi in v komponentah celične stene nekaterih bakterij. D-aspartat se nahaja v nekaterih beljakovinah kot posledica posttranslacijske modifikacije.
Označevanje z L in D deskriptorjema je sicer starejši način označevanja stereoizomerov in temelji na primerjavi z molekulo gliceraldehida, ne pa na optičnih lastnostih posamezne molekule. L in D oznaki se ne ujemata nujno s sučnostjo polarizirane svetlobe. Na osnovi sučnosti temelji označevanje z deskriptorjema S (levosučna molekula) in R (desnosučna).
Izjeme
[uredi | uredi kodo]Glede na stereoizomerijo obstajata med aminokislinami dve izjemi:
- glicin, ki nima stranske verige, temveč je R = H; zatorej ima somerne lastnosti in ne izkazuje stereoizomerije,
- pri cisteinu ne velja, da L izomer levosučen in D izomer levosučen, marveč obratno. Vsebnost žvepla namreč spremeni zapovrstje skupin okrog centralnega atoma po pravilu Cahn-Ingold-Prelog (pravilo, ki določa prioriteto posameznih skupin okrog atoma, ki predstavlja center izomerije in predstavlja orodje za določanje R-S konfiguracije).
Reakcije
[uredi | uredi kodo]Beljakovine nastanejo s polimerizacijo aminokislin. Gre za reakcijo kondenzacije, kjer COOH skupina ene aminokisline in NH2 skupina druge aminokisline tvorita peptidno vez, pri tem pa izstopi voda.
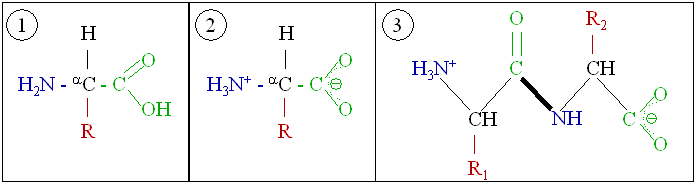
1. Aminokislina; 2, Struktura iona dvojčka; 3, Dve aminokislini tvorita peptidno.
Seznam standardnih aminokislin
[uredi | uredi kodo]Strukture
[uredi | uredi kodo]Strukture in tričrkovne ter enočrkovne oznake dvajsetih aminokislin, ki so kodirane v standardnem genetskem kodu:
-
L-alanin (Ala / A)
-
L-arginin (Arg / R)
-
L-asparagin (Asn / N)
-
L-asparaginska kislina (Asp / D)
-
L-cistein (Cys / C)
-
L-glutaminska kislina (Glu / E)
-
L-glutamin (Gln / Q)
-
glicin (Gly / G)
-
L-histidin (His / H)
-
L-izolevcin (Ile / I)
-
L-levcin (Leu / L)
-
L-lizin (Lys / K)
-
L-metionin (Met / M)
-
L-fenilalanin (Phe / F)
-
L-prolin (Pro / P)
-
L-serin (Ser / S)
-
L-treonin (Thr / T)
-
L-triptofan (Trp / W)
-
L-tirozin (Tyr / Y)
-
L-valin (Val / V)
Kemijske lastnosti
[uredi | uredi kodo]V sledeči preglednici so prikazane tričrkovne in enočrkovne oznake, kemijske lastnosti stranske verige. Molekulska masa je povprečna masa vseh znanih izotopov in vključuje maso H2O.
| Okrajšava | Ime aminokisline | Lastnost stranske verige | Masa | Izoelektrična točka | pK1 (α-COOH) |
pK2 (α-+NH3) |
pKr (R) | Opombe | |
|---|---|---|---|---|---|---|---|---|---|
| A | Ala | alanin | hidrofobna | 89.09 | 6.01 | 2.35 | 9.87 | Zelo razširjena aminokislina. Bolj toga od glicina. Majhna molekula, ki izkazuje v beljakovinski strukturi le majhne sterične ovire. Alanin je nevtralna aminokislina. Nahajamo ga tako v hidrofilnih kot v hidrofobnih regijah beljakovin. | |
| C | Cys | cistein | hidrofobna (Nagano, 1999) | 121.16 | 5.05 | 1.92 | 10.70 | 8.18 | V oksidirajočih pogojih se 2 molekuli cisteina združita preko disuldidnega mostu (-S-S-) in tvorita aminokislino cistin. Če je v beljakovini prisoten cistin, le-ta poveča obstojnost terciarne strukture beljakovine in takšna beljakovina je manj občutljiva na denaturacijo (na primer insulin). |
| D | Asp | asparaginska kislina | kisla | 133.10 | 2.85 | 1.99 | 9.90 | 3.90 | Izkazuje podobne lastnosti kot glutaminska kislina. Stranska veriga je hidrofilna z izrazitim negativnim nabojem. Navadno se nahaja na zunanjih hidrofilnih površinah beljakovin. Na negativni naboj v stranski verigi se pogosto vežejo kovinski kationi. |
| E | Glu | glutaminska kislina | kisla | 147.13 | 3.15 | 2.10 | 9.47 | 4.07 | Podobne lastnosti kot asparaginska kislina. Ima daljšo, nekoliko bolj gibljivo stransko verigo. |
| F | Phe | fenilalanin | hidrofobna | 165.19 | 5.49 | 2.20 | 9.31 | Za ljudi esencialna aminokislina. Fenilalanin vsebuje tako kot tirozin in triptofan veliko togo aromatsko skupino v stranski verigi. Naštete aminokisline so med največjimi. Poleg izolevcina, levcina in valina so hidrofobne aminokisline in se običajno nahajajo v notranjosti beljakovin. | |
| G | Gly | glicin | hidrofobna | 75.07 | 6.06 | 2.35 | 9.78 | Zaradi dveh vodikovih atomov na α-ogljiku glicin ni optično aktiven. Glicin je najmanjša aminokislina, ki zlahka rotira in je zelo fleksibilna. Vrine se lahko v zelo majhne prostore, na primer med trojno vijačnico kolagena. Kot strukturna prvina beljakovin se zaradi prevelike fleksibilnosti pojavlja redkeje kot alanin. | |
| H | His | histidin | bazična | 155.16 | 7.60 | 1.80 | 9.33 | 6.04 | Protoniranje aminske skupine nastopi tudi v šibko kislem okolju. Histidin je prisoten v številnih beljakovinah, kjer spremeni konformacijo in lastnosti beljakovine. |
| I | Ile | izolevcin | hidrofobna | 131.17 | 6.05 | 2.32 | 9.76 | Za človeka esencialna aminokislina. Izolevcin, levcin in valin imajo relativno velike alifatske hidrofobne stranske verige. Te molekule so toge. Za pravilno zvitje proteinov so pomembne hidrofobne interakcije, ki se vzpostavljajo med stranskimi verigami teh aminokislin. Prisotne so zlasti v notranjosti beljakovin. | |
| K | Lys | lizin | bazična | 146.19 | 9.60 | 2.16 | 9.06 | 10.54 | Za človeka esencialna aminokislina. Ima podobne lastnosti kot arginin. Poseduje dolgo fleksibilno stransko verigo s pozitivno nabitim koncem. Lizin in arginin sta zaradi svoje fleksibilnosti pripravni aminokislini za vezavo na molekule z negativnim nabojem. Zaradi močnega naboja sta lizin in arginin predvsem na zunanji površini beljakovin. |
| L | Leu | levcin | hidrofobna | 131.17 | 6.01 | 2.33 | 9.74 | Za človeka esencialna aminokislina. Ima podobne lastnosti kot izolevcin in valin. Glej izolevcin. | |
| M | Met | metionin | hidrofobna | 149.21 | 5.74 | 2.13 | 9.28 | Za človeka esencialna aminokislina. Vedno prva aminokislina, ki se vgradi v beljakovino; po translaciji se nato včasih odstrani. Kot cistein tudi metionin vsebuje žveplo, vendar ima vezano še metilno skupino. Ta metilna skupina se lahko aktivira in zato je metionin vključen v številne reakcije, pri katerih se dodaja nov ogljikov atom. | |
| N | Asn | asparagin | hidrofilna | 132.12 | 5.41 | 2.14 | 8.72 | Nevtralizirana inačiva asparaginske kisline.. | |
| P | Pro | prolin | hidrofobna | 115.13 | 6.30 | 1.95 | 10.64 | Vsebuje za aminokisline neobičajen cikel, ki vsebuje α-aminsko skupino v obliki amidne skupine (CO-NH). Če je prisotna v peptidnem zaporedju, povzroči obrat peptidne verige in tako prekinja sekundarne strukture beljakovine (α-vijačnica, β-list). Prisoten je v kolagenu, kjer se posttranslacijsko spremeni v hidroksiprolin. | |
| Q | Gln | glutamin | hidrofilna | 146.15 | 5.65 | 2.17 | 9.13 | Nevtralizirana inačica glutaminske kisline. V beljakovinah predstavlja zalogo amonijaka. | |
| R | Arg | arginin | bazična | 174.20 | 10.76 | 1.82 | 8.99 | 12.48 | Funkcionalno podoben lizinu. |
| S | Ser | serin | hidrofilna | 105.09 | 5.68 | 2.19 | 9.21 | Serin in treonin imata kratko stransko verigo, ki se konča s hidroksilno skupino. Vodik iz hidroksilne skupine se zlahka odstrani, zato serin in treonin pogosto nastopata kot donorja vodika v encimih. Oba sta zelo hidrofilna, zato so predvsem zunanje površine beljakovin bogate s tema aminokislinama. | |
| T | Thr | treonin | hidrofilna | 119.12 | 5.60 | 2.09 | 9.10 | Za človeka esencialna aminokislina. Ima podobne lastnosti kot serin. | |
| V | Val | valin | hidrofilna | 117.15 | 6.00 | 2.39 | 9.74 | Za človeka esencialna aminokislina. Izkazuje podobne lastnosti kot izolevcin in levcin. Glej izolevcin. | |
| W | Trp | triptofan | hidrofilna | 204.23 | 5.89 | 2.46 | 9.41 | Za človeka esencialna aminokislina. Ima podobne lastnosti kot fenilalanin in tirozin. Je prekurzor serotonina. | |
| Y | Tyr | tirozin | hidrofobna | 181.19 | 5.64 | 2.20 | 9.21 | 10.46 | Ima podobne lastnosti kot triptofan ali fenilalanin. Je prekurzor melanina, adrenalina in ščitničnih hormonov. |
Glej tudi
[uredi | uredi kodo]Aminokisline in proteini v prehrani in prehranskih dopolnilih




















