Atom

Atóm je najmanjši del snovi, ki ga kemijsko ne moremo več razstaviti. Beseda izhaja iz stare grščine: starogrško ἄτομος: átomos - nedeljiv, iz a- - ne- + tomos - rez.[1][2] Atomi so gradniki molekul in snovi kot take. Atomi se pri kemijskih reakcijah ohranjajo, že dobrih sto let pa je znano, da v resnici niso nedeljivi, ampak so sestavljeni iz še manjših delcev. Velikosti atomov so od 10 do 100 pm, v velikostnem razredu, kjer njihovega vedenja zaradi kvantnih pojavov ni mogoče napovedati z zakoni klasične mehanike.
Atomi se lahko med seboj začasno povezujejo s kemičnimi vezmi in tvorijo spojine, kot so molekule in kristali. Ta sposobnost asociacije in disociacije je odgovorna za večino fizičnih sprememb, ki jih lahko opazujemo v naravi. Kemija je znanstvena veda, ki se ukvarja s preučevanjem teh sprememb.
Zgradba atomov
[uredi | uredi kodo]Podatomski delci
[uredi | uredi kodo]Včasih so veljali atomi za nedeljive, zdaj pa vemo, da jih sestavljajo elektroni, protoni in nevtroni.
Elektron je z 911×10−31 kg daleč najlažji delec, ima negativen naboj in premajhen premer, da bi ga lahko izmerili z zdaj znanimi tehnikami.[3] Do odkritja mase nevtrina je bil najlažji delec s pozitivno mirovno maso, ki so ga izmerili. V običajnih okoliščinah so elektroni vezani na pozitivno nabito jedro s privlakom, ki je posledica nasprotnega električnega naboja. Če ima atom več ali manj elektronov kot je njegovo atomsko število, postane kot celota negativno ali pozitivno nabit; nabitemu atomu pravimo ion.
Protoni imajo pozitiven naboj in maso, 1836-krat večjo od elektrona (16726×10−27 kg). Število protonov v atomu označujemo z njegovim atomskim številom. Protone poznamo od začetka 20. stoletja, ko je Ernest Rutherford odkril, da dušik, obstreljevan z delci alfa izvrže delec, po lastnostih enak jedru vodika. V objavi leta 1920 je jedro vodika opredelil kot podatomski delec in ga poimenoval proton.
Nevtroni so brez električnega naboja in imajo maso 16749×10−27 kg ali 1.839-kratno maso elektrona.[4][5] S tem so najmasivnejši od treh podatomskih delcev, toda vezavna energija jedra lahko njihovo maso zmanjša. Nevtroni in protoni, ki jim skupaj pravimo nukleoni, imajo podobne mere, približno 25×10−15 m (čeprav "površine" teh delcev ni mogoče natančno definirati).[6] Nevtron je odkril angleški fizik James Chadwick leta 1932.
V standardnem modelu fizike so elektroni pravi osnovni delci brez notranje zgradbe, protoni in nevtroni pa so sestavljeni iz osnovnih delcev kvarkov. V atomih sta dva tipa kvarkov, ki imata vsak del električnega naboja. Protoni so sestavljeni iz dveh kvarkov Gor (vsak z nabojem +2/3) in enega kvarka Dol (z nabojem -1/3). Nevtroni so sestavljeni iz enega kvarka Gor in dveh kvarkov Dol. To pojasni razliko v masi in naboju obeh delcev.[7][8]
Kvarke drži skupaj močna jedrska sila oz. močna interakcija, ki jo posredujejo gluoni. Protone in nevtrone pa drži skupaj ostanek močne jedrske sile, ki ima največji vpliv na kratki razdalji znotraj jedra. Gluon spada v družino umeritvenih bozonov, ki so nosilci osnovnih sil.[7][8]
Jedro
[uredi | uredi kodo]
Vsi vezani protoni in nevtroni v atomu tvorijo drobno jedro, imenujemo jih s skupnim imenom nukleoni. Premer jedra znaša približno femtometra, kjer je skupno število nukleonov.[9] To je precej manj od premera atoma, ki je v velikostnem razredu 105 fm. Nukleone veže skupaj potencial s kratkim dosegom, ki mu pravimo ostanek močne jedrske sile. Na razdaljah, manjših od 2,5 fm, je ta sila mnogo močnejša od elektrostatske sile, zaradi katere se pozitivno nabiti protoni odbijajo med seboj.[10]
Atomi istega elementa imajo enako število protonov, ki mu pravimo atomsko število. Znotraj elementa se lahko spreminja število nevtronov, kar razlikuje izotope tega elementa. Vsota števila protonov in nevtronov določa nuklid. Razmerje med številoma nevtronov in protonov določa stabilnost jedra; nekateri izotopi so zaradi nestabilnosti podvrženi radioaktivnemu razpadu.[11]
Proton, elektron in nevtron spadajo v skupino fermionov. Fermioni ubogajo Paulijevo izključitveno načelo, ki preprečuje nerazločljivim fermionom hkrati zasedati enako kvantno stanje. To pomeni, da mora imeti vsak proton v jedru drugačno kvantno stanje od ostalih protonov, to velja tudi za nevtrone v jedru in elektrone v elektronskem oblaku.[12]
Jedro z neenakomernim številom protonov in nevtronov lahko z radioaktivnim razpadom preide v nižje energetsko stanje, v katerem se števili protonov in nevtronov bolj ujemata. Posledično so atomi z enakim številom obeh delcev odpornejši proti razpadu, pri čemer pa s povečevanjem atomskega števila medsebojni odboj protonov narašča delež nevtronov, ki omogočajo ohranitev stabilnosti jedra.[12]
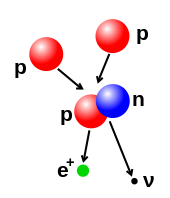
Število protonov in nevtronov v jedru je možno spremeniti, kar pa zaradi močne jedrske sile zahteva zelo veliko energije. Do jedrske fuzije pride, ko se več atomskih delcev združi v težje jedro, to se zgodi denimo pri visokoenergetskem trku jeder. V jedru Sonca se denimo protona združita pri vnosu energije 3 to 10 keV, kar je dovolj, da presežeta medsebojni odboj in se zlijeta v eno jedro.[13] Obraten proces je jedrska cepitev, ob kateri se jedro razdeli v dve lažji, običajno z radioaktivnim razpadom. Jedro je možno spremeniti tudi z obstreljevanjem z visokoenergetskimi podatomskimi delci ali fotoni, ki izbijajo nukleone. Če se med obstreljevanjem spremeni število protonov, nastane drug kemični element.[14][15]
Če je masa jedra po fuziji manjša od vsote mas ločenih delcev, se lahko razlika odda v obliki uporabne energije, na primer žarka gama ali kinetične energije delca beta. Ta pojav opisuje Einsteinova enačba ekvivalence masa-energija (), kjer je izguba mase in hitrost svetlobe. Ta primanjkljaj je del vezavne energije novega jedra.[16]
Fuzija jeder, s katero nastanejo večja jedra z nižjim atomskim številom od železa in niklja—okrog 60 nukleonov—je običajno eksotermna, torej odda več energije kot je je potrebne za zlivanje.[17] Zaradi tega je fuzija v zvezdah verižna reakcija. V težjih jedrih se vezavna energija na nukleon v jedru zmanjšuje, kar pomeni, da je fuzija, pri kateri nastanejo jedra z atomskim številom približno 26 ali več in atomsko maso približno 60 ali več, endotermna. Taka jedra ne morejo nastajati v reakcijah, s kakršnimi se vzdržuje hidrostatično ravnovesje zvezde.[12]
Elektronski oblak
[uredi | uredi kodo]
Elektrone v atomu privlačijo protoni z elektromagnetno silo. Ta veže elektrone znotraj elektrostatične potencialne jame, ki obkroža drobno jedro. Elektron lahko ubeži le s pritokom energije od zunaj. Bližje jedra kot je elektron, večja je privlačna sila in s tem tudi energija, potrebna za ubeg.
Tako kot drugi delci imajo elektroni hkrati lastnosti delca in valovanja. Elektronski oblak je območje znotraj potencialne jame, kjer vsak elektron tvori nekakšen tridimenzionalen stoječ val—valovno obliko, ki se ne premika v odnosu do jedra. Ta pojav opisuje atomska orbitala, matematična funkcija, ki določa verjetnost, da se bo elektron navidez nahajal na določeni lokaciji, ko ga izmerimo.[18] Obstaja le določna diskretna (kvantizirana) množica teh orbital okrog jedra, vse ostale možne valovne oblike se hitro spremenijo v stabilnejšo obliko.[19] Orbitale imajo lahko enega ali več prstanov ali vozlov, med seboj se razlikujejo po velikosti, obliki in orientaciji.[20]

Vsaka orbitala ustreza energetskemu nivoju elektrona. Elektron lahko preide na višji nivo tako, da absorbira foton z dovoljšnjo energijo. S spontano emisijo lahko v nasprotni smeri preide tudi na nižji nivo, pri tem pa odda razliko v energiji kot foton. Razlike v energiji, ki odgovarjajo razlikam v energiji kvantnih stanj, so značilne za določen atom; opazujemo jih lahko kot spektralne črte.[19]
Ionizacijska energija je energija, ki je potrebna za dodajanje ali odvzem elektrona, mnogo manjša je od vezavne energije nukleonov. Za izbitje elektrona v stacionarnem stanju vodikovega atome je potrebno le 13,6 eV energije, mnogo manj kot 2.23 milijona eV za razcep jedra devterij.[21] Atomi so električno nevtralni, če imajo enako število protonov in elektronov, sicer so pozitivno ali negativno nabiti ioni. Elektroni, ki so najdlje od jedra, lahko prehajajo med sosednjimi atomi ali si jih sosednji atomi delijo. Na ta način se tvorijo kemične vezi in nastajajo molekule ali podobne spojine, kot so ionske ali kovalentne kristalne mreže.[22]
Lastnosti
[uredi | uredi kodo]Lastnosti jedra
[uredi | uredi kodo]Atome najprej razvrščamo po lastnostih jedra, glavna je število protonov ali vrstno število – po definiciji pripadata katerakoli dva atoma z enakim številom protonov istemu kemičnemu elementu. Atomi z enakim številom protonov in različnim številom nevtronov pa so izotopi istega elementa. Za primer, vsi vodikovi atomi imajo natanko en proton, obstajajo pa izotopi brez nevtronov (vodik-1 ali protij, ki je daleč najpogostejši[23]), enim nevtronom (devterij), dvema nevtronoma (tritij) ali več. Vsi znani elementi tvorijo množico z naraščajočimi vrstnimi števili od enoprotonskega vodika do oganesona s 118 protoni.[24] Vsi znani izotopi elementov z vrstnimi števili nad 82 so radioaktivni, čeprav je radioaktivnost bizmuta (83) praktično zanemarljiva.[25][26]
V naravi se na Zemlji pojavlja približno 339 različnih nuklidov,[27] od katerih 252 (približno 74 %) ni podvrženih spontanemu razpadu, zato jih imenujemo stabilni izotopi. Teoretično je takih le 90, razpada nadaljnjih 162 pa le nikoli nismo zaznali, čeprav je energetsko to možno. Vsi so formalno opredeljeni kot »stabilni«. Še nadaljnjih 34 radioaktivnih nuklidov ima razpolovni čas daljši od 100 milijonov let in so dovolj stabilni, da so prisotni že vse od nastanka Osončja. Skupaj z 252 stabilnimi izotopi jih imenujemo prvobitni nuklidi. Preostalih 53 neobstojnih nuklidov se pojavlja v naravi kot produkt razpada primordialnih nuklidov (na primer radij iz urana) ali kot produkt visokoenergetskih pojavov, kot je obstreljevanje s kozmičnimi žarki (tako nastane denimo ogljik-14).[28]
80 elementov ima vsaj po en stabilen izotop. Praviloma imajo elementi le peščico stabilnih izotopov, povprečje je 3,2. 26 elementov ima en sam stabilen izotop, največ – 10 – pa jih ima kositer. Elementi tehnecij (43), prometij (61) in vsi nad 83 nimajo stabilnih izotopov.[29]:1–12
Stabilnost izotopov je odvisna od medsebojnega deleža protonov in nevtronov, pa tudi obstoja določenih »magičnih števil« nevtronov ali protonov, ki predstavljajo zaprte ali izpolnjene kvantne ovojnice. Te ovojnice ustrezajo energetskim nivojem v modelu jedrnih ovojnic; napolnjene ovojnice, kot je polna ovojnica 50 protonov kositra, daje nenavadno stabilnost nuklidu. Od 252 znanih stabilnih nuklidov imajo le štirje liho število protonov in hkrati liho štedvilo nevtronov: vodik-2 (devterij), litij-6, bor-10 in dušik-14. Dodatni štirje lihi-lihi radioaktivni nuklidi, ki se pojavljajo v naravi, imajo razpolovni čas več kot milijardo let: to so kalij-40, vanadij-50, lantan-138 in tantal-180m. Večina lihih-lihih jeder je zelo nestabilnih in podvrženih razpadu beta, kar pripisujemo dejstvu, da so produkti razpada sodi-sodi in zato močneje povezani .[30]
Masa
[uredi | uredi kodo]Veliko večino mase atoma prispevajo protoni in nevtroni jedra. Skupno število teh delcev (nukleonov) v atomu je masno število. Masno število je pozitivno celo število brez enote. Z njim opisujemo nukleone, na primer »ogljik-12« za izotop ogljika, ki ima šest protonov in šest nevtronov.
Dejansko mirovno maso atoma pogosto izražamo z enotami atomske mase (dalton, Da). Ta enota je definirana kot dvanajstina mase prostega nevtralnega atoma ogljik-12, ki znaša približno 166×10−27 kg.[31] Najlažji nuklid, vodik-1, ima atomsko maso 1,007825 Da.[32] Atom ima atomsko maso približno enako (razlika manj kot 1 %) mastnemu številu krat atomsko masno število. Za primer, masa dušika-14 je približno 14 Da, le ogljik-12 ima po definiciji maso točno 12 Da.[33] Najtežji stabilni atom je svinec-208[25] z maso 207,9766521 Da.[34]
Celo najtežji atomi so mnogo prelahki, da bi jih bilo praktično opisovati neposredno, zato v kemiji namesto tega uporabljajo mole. Mol atomov elementa ima določeno število atomov (približno 6,022×1023). Definicija mola povezuje enoto atomske mase (u) in kilogram: en mol elementa z atomsko maso 1 u ima maso približno 1 gram (0,001 kg). Po definiciji enote atomske mase ima atom ogljika-12 atomsko maso natanko 12 Da, torej mol atomov ogljika-12 tehta natanko 0,012 kg.[31]
Zgodovina
[uredi | uredi kodo]Prvi so o zgradbi snovi razmišljali že stari Grki. Raznovrstne snovi, ki jih srečujemo v vsakdanjem življenju, so sestavljene iz posamičnih atomov, ki jih je vsega nekaj deset različnih vrst. Obstoj takšnih delcev so prvi predlagali v 6. stoletju pr. n. št. grški filozofi (Demokrit, Levkip in Epikur), vendar je predlog utonil v pozabo, dokler ga ni v 18. stoletju oživil Bošković, zares pa je zaživel, ko je John Dalton predlagal njegovo uporabo v kemiji.
Bošković je svojo teorijo zasnoval na Newtonovi mehaniki in jo leta 1758 objavil pod naslovom Theoria philosophiae naturalis redacta ad unicam legem virium in natura existentium. V njegovi teoriji so atomi točke brez notranje zgradbe, ki med seboj delujejo z odbojnimi in privlačnimi silami, odvisno od razdalje. Dalton je s teorijo o atomih pojasnil, zakaj se plini vedno spajajo v celoštevilčnih deležih. Šele Amedeo Avogadro pa je v 19. stoletju začel pravilno razlikovati med atomi in molekulami.
Prvi model atoma je postavil Joseph John Thomson, ki je odkril, da atomi niso nedeljivi, marveč so sestavljeni iz manjših delcev (elektronov). Dandanes lahko atome tudi eksperimentalno opazujemo. Elektroni se ne gibljejo po tirnicah,ampak si jih predstavljamo kot elektronski oblak,ki zapolnjuje prostor okoli jedra.
Sklici
[uredi | uredi kodo]- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. str. 31–33. ISBN 978-0-19-515040-7.
- ↑ Melsen (1952). From Atomos to Atom, pp. 18-19
- ↑ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1. izd.). Springer. str. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ↑ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. str. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ↑ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" Arhivirano 2012-02-11 na Wayback Machine. (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ↑ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. str. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ↑ 7,0 7,1 Particle Data Group (2002). »The Particle Adventure«. Lawrence Berkeley Laboratory. Arhivirano iz spletišča dne 4. januarja 2007.
- ↑ 8,0 8,1 Schombert, James (18. april 2006). »Elementary Particles«. University of Oregon. Arhivirano iz spletišča dne 21. avgusta 2011.
- ↑ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. str. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- ↑ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. str. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ↑ Wenner, Jennifer M. (10. oktober 2007). »How Does Radioactive Decay Work?«. Carleton College. Arhivirano iz spletišča dne 11. maja 2008.
- ↑ 12,0 12,1 12,2 Raymond, David (7. april 2006). »Nuclear Binding Energies«. New Mexico Tech. Arhivirano iz prvotnega spletišča dne 1. decembra 2002.
- ↑ Mihos, Chris (23. julij 2002). »Overcoming the Coulomb Barrier«. Case Western Reserve University. Arhivirano iz spletišča dne 12. septembra 2006.
- ↑ »ABC's of Nuclear Science«. Lawrence Berkeley National Laboratory. 30. marec 2007. Arhivirano iz spletišča dne 5. decembra 2006.
- ↑ Makhijani, Arjun; Saleska, Scott (2. marec 2001). »Basics of Nuclear Physics and Fission«. Institute for Energy and Environmental Research. Arhivirano iz spletišča dne 16. januarja 2007.
- ↑ Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. str. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- ↑ Fewell, M.P. (1995). »The atomic nuclide with the highest mean binding energy«. American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ↑ Mulliken, Robert S. (1967). »Spectroscopy, Molecular Orbitals, and Chemical Bonding«. Science. 157 (3784): 13–24. Bibcode:1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ↑ 19,0 19,1 Brucat, Philip J. (2008). »The Quantum Atom«. Univerza Floride. Arhivirano iz prvotnega spletišča dne 7. decembra 2006.
- ↑ Manthey, David (2001). »Atomic Orbitals«. Orbital Central. Arhivirano iz spletišča dne 10. januarja 2008.
- ↑ Bell, R.E.; Elliott, L.G. (1950). »Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron«. Physical Review. 79 (2): 282–285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ↑ Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. str. 249–272. ISBN 978-0-387-95550-6.
- ↑ Matis, Howard S. (9. avgust 2000). »The Isotopes of Hydrogen«. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Arhivirano iz spletišča dne 18. decembra 2007.
- ↑ Weiss, Rick (17. avgust 2006). »Scientists Announce Creation of Atomic Element, the Heaviest Yet«. The Washington Post. Arhivirano iz spletišča dne 21. avgusta 2011.
- ↑ 25,0 25,1 Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. str. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
- ↑ Dumé, Belle (23. april 2003). »Bismuth breaks half-life record for alpha decay«. Physics World. Arhivirano iz spletišča dne 14. decembra 2007.
- ↑ Lindsay, Don (30. julij 2000). »Radioactives Missing From The Earth«. Don Lindsay Archive. Arhivirano iz spletišča dne 28. aprila 2007.
- ↑ Tuli, Jagdish K. (april 2005). »Nuclear Wallet Cards«. National Nuclear Data Center, Brookhaven National Laboratory. Arhivirano iz spletišča dne 3. oktobra 2011.
{{navedi splet}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ CRC Handbook (2002).
- ↑ Krane, K. (1988). Introductory Nuclear Physics. John Wiley & Sons. str. 68. ISBN 978-0-471-85914-7.
- ↑ 31,0 31,1 Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2. izd.). Oxford: Mednarodna zveza za čisto in uporabno kemijo, Komite za terminologijo fizikokemičnih simbolov in enot, Blackwell Scientific Publications. str. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
{{navedi knjigo}}: Vzdrževanje CS1: url-status (povezava) - ↑ Chieh, Chung (22. januar 2001). »Nuclide Stability«. University of Waterloo. Arhivirano iz prvotnega spletišča dne 30. avgusta 2007.
- ↑ »Atomic Weights and Isotopic Compositions for All Elements«. Narodni urad za standarde in tehnologijo. Arhivirano iz spletišča dne 31. decembra 2006. Pridobljeno 4. januarja 2007.
- ↑ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). »The Ame2003 atomic mass evaluation (II)« (PDF). Nuclear Physics A. 729 (1): 337–676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003. Arhivirano (PDF) iz spletišča dne 16. oktobra 2005.
Bibliografija
[uredi | uredi kodo]- Andrew G. van Melsen (2004) [1952]. From Atomos to Atom: The History of the Concept Atom. Prevod: Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
Zunanje povezave
[uredi | uredi kodo]- Sharp, Tim (8. avgust 2017). »What is an Atom?«. Live Science. Pridobljeno 13. aprila 2018.
- »Hitchhikers Guide to the Universe, Atoms and Atomic Structure«. h2g2. BBC. 3. januar 2006. Pridobljeno 13. aprila 2018.

![{\displaystyle 1.07{\sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)



