Sol (kemija)
Sol je ionska spojina med nekovino in kovino. Sestavljena je iz anionov in kationov v takem razmerju, da je spojina električno nevtralna.[1] Soli delimo po kislinskih preostankih (kloridi, jodidi, acetati, nitrati, sulfati ...).
Pogost primer je kuhinjska sol s pozitivno nabitimi natrijevimi ioni in negativno nabitimi kloridnimi ioni.
Sestavni ioni v solni spojini so lahko anorganski, kot je klorid (Cl-), ali organski, kot je acetat (CH
3CO−
2). Vsak ion je lahko monoatomski, kot je fluorid (F−) ali poliatomski, kot je sulfat (SO2−
4).
Vrste soli
[uredi | uredi kodo]Soli lahko razvrstimo na različne načine. Soli, ki pri raztapljanju v vodi proizvajajo hidroksidne ione, imenujemo alkalne soli. Soli, ki pri raztapljanju v vodi proizvajajo vodikove ione, pa kisle soli. Nevtralne soli so tiste soli, ki niso niti kisle niti bazične. Zwitterioni (ioni dvojčki) v isti molekuli obstajajo v obliki pozitivno in negativno nabitih ionov[2], vendar se ne štejejo za soli. Primeri zwitterionov so aminokisline, številni presnovki, peptidi in beljakovine.[3]
Lastnosti
[uredi | uredi kodo]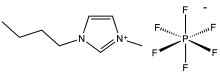
Barva
[uredi | uredi kodo]Trdne soli so običajno prozorne, kot je to natrijev klorid. V mnogih primerih je navidezna motnost ali prosojnost povezana le z razliko v velikosti posameznih monokristalov. Ker se svetloba odbija od mej zrn (meje med kristaliti), so večji kristali običajno prozorni, medtem ko polikristalni agregati izgledajo kot neprozorni prah ali gmota.
Soli obstajajo v številnih različnih barvah, ki izhajajo iz anionov, kationov ali solvatov. Na primer:
- natrijev kromat je rumen zaradi kromatnega iona
- kalijev dikromat je oranžen zaradi dikromatnega iona
- kobaltov nitrat je rdeč zaradi kromofora hidratiranega kobalta(II) ([Co(H2O)6]2+).
- bakrov sulfat je modre barve zaradi bakrovega(II) kromofora
- kalijev permanganat ima vijolično barvo permanganatnega aniona.
- nikljev klorid je običajno zelen zaradi hidriranega nikljevega(II) klorida [NiCl2(H2O)4]
- natrijev klorid, magnezijev sulfat heptahidrat so brezbarvni ali beli, ker sestavni kationi in anioni ne absorbirajo v vidnem delu spektra.
Le malo mineralov je soli, ker bi jih voda stopila. Podobno anorganski pigmenti običajno niso soli, ker je za obstojnost potrebna netopnost. Nekatera organska barvila so soli, vendar so praktično netopna v vodi.
Okus
[uredi | uredi kodo]Različne soli lahko razvijejo vseh pet osnovnih okusov, lahko so npr. slane (natrijev klorid), sladke (svinčev diacetat, ki povzroči zastrupitev s svincem), kisle (kalijev bitartrat), grenke (magnezijev sulfat) in umami (mononatrijev glutamat).
Vonj
[uredi | uredi kodo]Soli močnih kislin in močnih baz ("močne soli") so nehlapne in pogosto brez vonja. Soli šibkih kislin ali šibkih baz ("šibke soli") lahko dišijo kot konjugirana kislina (npr. acetati, kot je ocetna kislina (kis) in cianidi, kot je vodikov cianid (mandlji)) ali konjugirana baza (npr. amonijeve soli, kot je amonijak) sestavnih ionov. To počasno, delno razgradnjo običajno pospeši prisotnost vode, saj je hidroliza drugi del reverzibilne reakcijske enačbe tvorbe šibkih soli.
Topnost
[uredi | uredi kodo]Mnoge ionske spojine so dobro topne v vodi ali drugih polarnih topilih. Za razliko od molekularnih spojin, soli v raztopini disociirajo na anionske in kationske komponente. Mrežna energija, kohezivne sile med temi ioni v trdni snovi, določajo topnost. Topnost je odvisna od tega, kako dobro vsak ion reagira s topilom. Na primer, soli natrija, kalija in amonija so običajno topne v vodi. Pomembnejši izjemi sta amonijev heksakloroplatinat in kalijev kobaltinitrit. Večina nitratov in veliko sulfatov je topnih v vodi. Izjeme so barijev sulfat, kalcijev sulfat (zmerno topen) in svinčev(II) sulfat. Večina kovinskih karbonatov ni topnih v vodi. Nekatere topne karbonatne soli so: natrijev karbonat, kalijev karbonat in amonijev karbonat.
Prevodnost
[uredi | uredi kodo]
Soli so tipično izolatorji. Staljene soli ali raztopine soli prevajajo električni tok. Zaradi tega razloga se lahko kot elektroliti uporabljajo utekočinjene (stopljene) soli in raztopine, ki vsebujejo raztopljene soli (npr. natrijev klorid v vodi).
Tališče
[uredi | uredi kodo]Za soli je značilno, da imajo visoka tališča. Na primer, natrijev klorid se tali pri 801 °C. Nekatere soli z nizko mrežno energijo so tekoče pri ali blizu sobne temperature. Sem spadajo staljene soli, ki so običajno mešanice soli, in ionske tekočine, ki običajno vsebujejo organske katione.
Nastanek soli
[uredi | uredi kodo]Soli nastanejo v glavnem na štiri načine:
1. Z nevtralizacijo
Pri nevtralizaciji poteče kemijska reakcija med kislino in bazo. Pri tem nastane sol (sestavljena iz kationa kisline in aniona baze). Nastane tudi voda, če baza vsebuje karbonatni ion pa tudi ogljikov dioksid. Primer take reakcije:
H2SO4 + CaCO3 --> CaSO4 + H2O + CO2
2. S spajanjem kovine in nekovine
V tem primeru poteče reakcija med kovino ter nekovino. Pri tem nastane samo sol (sestavljena iz kovinskega aniona ter nekovinskega kationa). Primer take reakcije:
3. Z reakcijo med kislino in kovino
Tukaj poteče reakcija med kislino in kovino, nastaneta sol (iz aniona kovine ter kationa kisline) in vodik. Primer take reakcije:
CH3-COOH + Rb --> CH3-COORb + H2
4. Z reakcijo med kislino in kovinskim oksidom
V tem primeru poteče reakcija med kislino in kovinskim oksidom, nastaneta sol (iz aniona kisline ter kationa kovinskega oksida) in voda. Primer take reakcije:
Zgornje reakcije so neurejene.
Glej tudi
[uredi | uredi kodo]Sklici
[uredi | uredi kodo]- ↑ IUPAC, Compendium of Chemical Terminology, 2. izd. (the "Gold Book") (1997). Spletna izdaja: (2006–) "salt". DOI: 10.1351/goldbook.S05447
- ↑ »Ioni dvojčki - zwitter ioni«. i-učbenik za kemijo v 3. letniku gimnazije. Zavod RS za Šolstvo. 2014. ISBN 978-961-03-0143-1. Arhivirano iz prvotnega spletišča dne 22. oktobra 2022. Pridobljeno 22. oktobra 2022.
- ↑ Voet, D.; Voet, J. G. (2005). Biochemistry (3. izd.). Hoboken, NJ: John Wiley & Sons Inc. str. 68. ISBN 9780471193500. Arhivirano iz prvotnega spletišča dne 11. septembra 2007.
- ↑ D. Chasseau; G. Comberton; J. Gaultier; C. Hauw (1978). »Réexamen de la structure du complexe hexaméthylène-tétrathiafulvalène-tétracyanoquinodiméthane«. Acta Crystallographica Section B. 34 (2): 689. doi:10.1107/S0567740878003830.
