Izrek H
Izrek H (tudi H-izrek) v termodinamiki, kinetični teoriji in klasični statistični mehaniki opisuje težnjo po zmanjševanju količine (definirane spodaj) skoraj idealnega plina molekul v ireverzibilnih procesih na podlagi Boltzmannove enačbe. Izrek je podal Ludwig Boltzmann leta 1872 v dolgem članku Nadaljnja raziskovanja... (Weitere Studien...).[1][2]:256[3]
Ker naj bi ta količina predstavljala entropijo iz termodinamike, je bil izrek H zgodnji prikaz moči statistične mehanike, saj je trdil, da iz reverzibilne mikroskopske mehanike izpelje drugi zakon termodinamike – izjavo o bistveno ireverzibilnih procesih. Tako se na prvi pogled morda zdi, da izrek opisuje nepovratno povečanje entropije na podlagi mikroskopskih reverzibilnih enačb dinamike. Tedaj je ta rezultat povzročil burno razpravo. Domneva se, da dokazuje drugi zakon termodinamike,[4][5][6] čeprav ob predpostavki začetnih pogojev z nizko entropijo.[7]
Izrek H je naravna posledica kinetične enačbe, ki jo je izpeljal Boltzmann, in, ki je postala znana kot Boltzmannova (transportna) enačba. Izrek H je povzročil veliko razprav o njegovih dejanskih posledicah, pri čemer so glavne teme:
- Kaj je entropija? V kakšnem smislu Boltzmannova količina ustreza termodinamični entropiji?
- Ali so privzetki (zlasti privzetek o molekularnem kaosu) v ozadju Boltzmannove enačbe premočni? Kdaj so ti privzetki kršeni?
Poimenovanje izreka
[uredi | uredi kodo]Izrek se je najprej imenoval Boltzmannov izrek o minimumu.[8][9][2]:256[10]:4 Boltzmann je v svojem izvirnem članku iz leta 1872 za svojo statistično funkcijo zapisal simbol (kot pri entropiji).[1] Kasneje je Samuel Hawksley Burbury, eden od kritikov izreka,[11] leta 1890 zapisal funkcijo s simbolom [12] in ta zapis je pri sklicevanju na svoj »izrek H« prevzel Boltzmann.[13] Zapis je povzročil nekaj zmede glede imena izreka. Čeprav se izjava običajno imenuje »izrek ha«, se včasih namesto tega imenuje »izrek eta«, saj velike grške črke η (Η) ni mogoče razlikovati od velike različice latinske črke h (H).[14] Sprožile so se razprave o tem, kako naj bi se simbol razumel, vendar to ostaja nejasno zaradi pomanjkanja pisnih virov iz časa nastanka izreka.[14][15] Študije o tipografiji in delo Josiaha Gibbsa[16] so izgleda naklonjeni interpretaciji H kot η.[17]
Definicija in pomen količine H
[uredi | uredi kodo]Vrednost količine se določi iz funkcije , ki je brezrazsežna porazdelitvena funkcija kinetične energije molekul v času .[a] Vrednost funkcije je število molekul, ki imajo kinetično energijo med in . Če se za dani trk med dvema molekulama zapišeta kinetični energiji med in pred trkom ter kinetični energiji med in po trku, se lahko število trkov v času zapiše kot:
kjer je funkcija določena s posebnimi vrstami trkov, ustreznih za tak sistem. Spremenljivka , kinetična energija druge molekule po trku, iz enačbe izpade, saj je sistem omejen z ohranjanjem energije, in zato .[22]:4 Odvod po času te porazdelitve je Boltzmann izrazil z integralom:[1]:294
Funkcija je odvisna od sile med molekulama in Boltzmann jo je imel za simetrično: , kar pomeni, da je trk popolnoma reverzibilen.[2]:256 Izraz za je odvisen le od trkov, in transportna enačba se lahko izrazi kot bilančna enačba, v kateri se izgube odštejejo od prirastkov med trki.[19]:3 Količino sámo je Boltzmann definiral kot integral:[1]:295[18]:88
Je neposredno sorazmerna z negativno entropijo plina.[23]:14[b] Za izolirani idealni plin (s fiksno skupno energijo in fiksnim skupnim številom delcev) je funkcija najmanjša, če imajo delci Maxwell-Boltzmannovo porazdelitev. Če pa so molekule idealnega plina porazdeljene na drug način (na primer, da imajo vse enako kinetično energijo), potem bo vrednost višja. Boltzmannov izrek H, opisan v naslednjem razdelku, kaže, da so takšne porazdelitve nestabilne, ko so med molekulami trki dovoljeni, in se nagibajo k ireverzibilni težnji proti minimalni vrednosti (proti Maxwell-Boltzmannovi porazdelitvi).[c]
Izrek
[uredi | uredi kodo]
Boltzmann je razmišljal o tem, kaj se zgodi med trkom dveh delcev. Osnovno dejstvo mehanike je, da se pri prožnem trku med dvema delcema (kot so trde krogle) energija, ki se prenaša med delcema, spreminja glede na začetne pogoje (kot trka itd.).
Podal je ključni privzetek, kakor pred njim James Clerk Maxwell leta 1867, sedaj znan kot Stoßzahlansatz[d] (SZA – privzetek o številu trkov (privzetek o naključnosti), v sodobni različici – privzetek o molekularnem kaosu), da imata med katerim koli trkom v plinu dva delca, ki sodelujeta pri trku:
- neodvisno izbrani kinetični energiji iz porazdelitve,
- neodvisni smeri hitrosti in
- samostojni izhodišči.
Pod temi tremi privzetki in glede na mehaniko prenosa energije bosta energiji delcev po trku sledili določeni novi naključni porazdelitvi, ki jo je mogoče izračunati. Skupna porazdelitev hitrosti za par delcev se lahko zapiše kot produkt dveh neodvisnih porazdelitev.[22]:4
Ob upoštevanju ponavljajočih se nekoreliranih trkov med katero koli in vsemi molekulami v plinu je Boltzmann sestavil svojo kinetično enačbo (Boltzmannovo enačbo). Iz te kinetične enačbe naravno sledi, da neprekinjen proces trka povzroči, da se količina zmanjšuje, dokler ne doseže minimuma:
Količina je od spodaj omejena in ne more zavzeti vrednosti minus neskončno. Zato se njena vrednost ne more zmanjševati neskončno dolgo, ampak mora težiti k limiti, kjer velja ta neenakost ().[25] Boltzmann je privzel, da SZA velja ves čas, in tako zagotovil, da se količina ves čas obnaša homogeno.[19]:4
Vpliv izreka
[uredi | uredi kodo]Čeprav se je izkazalo, da Boltzmannov izrek H ni absolutni dokaz drugega zakona termodinamike, kot je prvotno trdil (glej razdelek Kritike in izjeme spodaj), je izrek H vodil Boltzmanna v zadnjih letih 19. stoletja do vse več verjetnostnih argumentov o naravi termodinamike. Verjetnostni pogled na termodinamiko je dosegel vrhunec leta 1902 z Gibbsovo statistično mehaniko za popolnoma splošne sisteme (ne samo pline) in uvedbo posplošenih statističnih ansamblov.
Kinetična enačba in zlasti Boltzmannov privzetek o molekularnem kaosu sta navdihnili celo družino Boltzmannovih enačb, ki se še danes uporabljajo za modeliranje gibanja delcev, kot so elektroni v polprevodniku. V mnogih primerih je privzetek o molekularnem kaosu zelo točen, zmožnost zavračanja zapletenih korelacij med delci pa naredi izračune veliko enostavnejše.
Proces termalizacije se lahko opiše z izrekom H ali relaksacijskim izrekom, ki je njegova posplošitev.[26]
Kritike in izjeme
[uredi | uredi kodo]Članek zaradi preverljivosti potrebuje dodatne sklice. |
Spodaj je opisanih več pomembnih razlogov, zakaj izrek H, vsaj v svoji izvirni obliki iz leta 1872, ni povsem strog. Kot bi Boltzmann sčasoma priznal, časovna puščica v izreku H pravzaprav ni čisto mehanska, ampak je v resnici posledica predpostavk o začetnih pogojih.[27]
Loschmidtov paradoks
[uredi | uredi kodo]Kmalu po tem, ko je Boltzmann objavil svoj izrek H, je Josef Loschmidt leta 1876 ugovarjal, da iz časovno simetrične dinamike in časovno simetričnega formalizma ne bi smelo biti mogoče izpeljati ireverzibilnega procesa.[28] Če se sčasoma v enem stanju zmanjša, potem mora obstajati ujemajoče se obrnjeno stanje, kjer s časom narašča (Loschmidtov paradoks). Razlaga je, da Boltzmannova enačba temelji na privzetku »molekularnega kaosa«, tj. da iz osnovnega kinetičnega modela izhaja ali je vsaj skladna z njim, da se delci štejejo za neodvisne in nekorelirane. Izkazalo se je, da ta privzetek v subtilnem smislu prekine simetrijo časovnega obrata in zato zahteva vprašanje. Ko je delcem dovoljeno trčiti, njihove smeri hitrosti in lege dejansko postanejo korelirane (vendar so te korelacije kodirane na izjemno zapleten način). To kaže, da (trajni) privzetek o neodvisnosti ni skladen z osnovnim modelom delcev.
Boltzmannov odgovor Loschmidtu je bil, da je priznal možnost teh stanj, vendar je opozoril, da so tovrstna stanja tako redka in nenavadna, da so v praksi nemogoča. Boltzmann je nadaljeval z izostritvijo tega pojma »redkosti« stanj, kar je privedlo do njegove slavne enačbe, njegove formule za entropijo iz leta 1877 (glej Boltzmannova formula za entropijo).
Spinski odmev
[uredi | uredi kodo]Kot prikaz Loschmidtovega paradoksa je slavni sodobni protiprimer (ne Boltzmannovemu izvirnemu izreku H, povezanemu s plinom, temveč tesno povezanemu analogu) pojav spinskega odmeva.[29] Pri pojavu spinskega odmeva je fizično mogoče inducirati časovni obrat v medsebojno delujočem sistemu spinov.
Analog Boltzmannovi količini za spinski sistem je mogoče definirati v smislu porazdelitve spinskih stanj v sistemu. V poskusu je spinski sistem sprva moten v neravnovesno stanje (velika vrenost ) in, kot napoveduje izrek H, se količina kmalu zmanjša na ravnovesno vrednost. Na neki točki se uporabi skrbno sestavljen elektromagnetni impulz, ki obrne gibanja vseh spinov. Spini nato razveljavijo časovni razvoj pred impulzom in čez nekaj časa se dejansko poveča proč od ravnovesja (ko se razvoj popolnoma ustavi, se ponovno zmanjša na najmanjšo vrednost). V nekem smislu se časovno obrnjena stanja, ki jih je opazil Loschmidt, niso izkazala za povsem nepraktična.
Poincaréjev izrek o vrnitvi in Zermelov paradoks
[uredi | uredi kodo]Henri Poincaré je leta 1890 med preučevanjem problema treh teles v nebesni mehaniki pokazal zelo splošen izrek – izrek o vrnitvi.[30][31] Ta izrek pravi, da se bo za skoraj vse začetne pogoje konzervativni dinamični sistem, katerega fazni prostor ima končno prostornino,[e] sčasoma vrnil čim bližje svojemu začetnemu pogoju, kot se želi, in to večkrat.[f]
Leta 1896 je Ernst Zermelo opazil nadaljnji problem z izrekom H, ki je bil v tem, da če sistemska v poljubnem času ni najmanjša, potem se mora zaradi Poincaréjeve vrnitve neminimalna ponoviti (čeprav po zelo dolgem času).[32][33] Poudaril je, da se zdi, da je Poincaréjeva vrnitev v nasprotju z dejstvom, da se lahko dinamična količina monotono spreminja, kot se spreminja na primer . Boltzmann je priznal, da bi do teh vrnitvenih dvigov vrednosti tehnično prišlo, vendar je poudaril, da v daljšem časovnem obdobju sistem preživi le majhen del svojega časa v enem od teh vrnitvenih stanj.[24][34] Njegov odgovor je bil sestavljen iz ocene povprečnega časa takšne vrnitve – za makroskopski plin, ki vsebuje molekul, ga je ocenil z velikostjo reda – v običajnem merilu pa te vrnitve niso vidne.
Drugi zakon termodinamike pravi, da se entropija toplotno izoliranega sistema vedno poveča do največje ravnovesne vrednosti. To strogo drži le v termodinamični meji neskončnega števila delcev. Pri končnem številu delcev bodo vedno prisotne fluktuacije entropije. Na primer, v fiksni prostornini izoliranega sistema je največja entropija dosežena, ko je polovica delcev v eni polovici prostornine, polovica v drugi, včasih pa bo na eni strani začasno nekaj več delcev kot na drugi, kar bo predstavljalo zelo majhno zmanjšanje entropije. Te fluktuacije entropije so take, da dlje ko se čaka, se bodo verjetno v tem času opazile večje fluktuacije entropije, čas, ki ga je treba čakati na dano fluktuacijo entropije, pa je vedno končen, tudi za fluktuacijo na najmanjšo možno vrednost. Lahko obstaja na primer izjemno nizko entropijsko stanje, če so vsi delci v eni polovici posode. Plin bo hitro dosegel svojo ravnovesno vrednost entropije, a če bo dovolj časa, se bo isto stanje ponovilo. Za praktične sisteme, npr. plina v 1-litrski posodi pri sobni temperaturi in zračnem tlaku, je ta čas res ogromen, več mnogokratnikov starosti Vesolja in, praktično gledano, se to možnost lahko zanemari.
Fluktuacije H v majhnih sistemih
[uredi | uredi kodo]Ker je mehansko definirana spremenljivka, ki se ne ohranja, bo kot katera koli druga taka spremenljivka (tlak itd.) kazala toplotne fluktuacije. To pomeni, da redno kaže spontano povečanje od najmanjše vrednosti. Tehnično to ni izjema od izreka H, saj je bil izrek H namenjen samo uporabi za plin z zelo velikim številom delcev. Te fluktuacije se zaznajo le, če je sistem majhen in časovni interval, v katerem se ga opazuje, ni izjemno velik.
Če se interpretira kot entropijo, kot je nameraval Boltzmann, potem se lahko to razume kot manifestacijo fluktuacijskega izreka.
Povezava s teorijo informacij
[uredi | uredi kodo]je predhodnica Shannonove informacijske entropije. Shannon je svojo mero informacijske entropije označil s po izreku H.[35] Članek o Shannonovi informacijski entropiji vsebuje razlago diskretne protipostavke količine , znane kot informacijska entropija ali informacijska negotovost (z znakom minus). Z razširitvijo diskretne informacijske entropije na zvezno informacijsko entropijo, imenovano tudi diferencialna entropija, se dobi izraz v enačbi iz zgornjega razdelka Definicija in pomen količine H in tako se bolje razume pomen .
Povezava izreka H med informacijo in entropijo igra osrednjo vlogo v nedavni polemiki, imenovani informacijski paradoks črnih lukenj.
Tolmanov izrek H
[uredi | uredi kodo]Knjiga Richarda Tolmana The Principles of Statistical Mechanics iz leta 1938 posveča celo poglavje študiji Boltzmannovega izreka H in njegovi razširitvi v Gibbsovi posplošeni klasični statistični mehaniki. Nadaljnje poglavje je posvečeno kvantnomehanski različici izreka H.
Klasičnomehansko
[uredi | uredi kodo]Naj so in posplošene koordinate za množico delcev. Nato se obravnava funkcijo , ki vrne gostoto verjetnosti delcev v stanjih v faznem prostoru. Upoštevati je treba kako je to mogoče pomnožiti z majhnim območjem v faznem prostoru, označenim z , da se dobi (povprečno) pričakovano število delcev v tem območju:
Tolman ponuja naslednje enačbe za definicijo količine v Boltzmannovem izvirnem izreku H:
Tukaj se sešteje področja, na katera je razdeljen fazni prostor, indeksirana z . In v meji za infinitezimalno prostornino faznega prostora se lahko vsoto zapiše kot integral:
se lahko zapiše tudi v smislu števila molekul, prisotnih v vsaki od celic:
Dodatni način za izračun količine je:
kjer je verjetnost, da se najde naključno izbran sistem iz navedenega mikrokanoničnega ansambla. Končno se lahko zapiše kot:
kjer je število klasičnih stanj.[pojasni]
Količina se lahko definira tudi kot integral čez hitrostni prostor:[navedi vir]
kjer je verjetnostna porazdelitev.
Z Boltzmannovo enačbo se lahko pokaže, da se vrednost lahko samo zmanjšuje.
Za sistem statistično neodvisnih delcev je povezana s termodinamično entropijo prek zveze:[41]
Tako lahko po izreku H entropija samo narašča.
Kvantnomehansko
[uredi | uredi kodo]V kvantni statistični mehaniki, (ki je kvantna različica klasične statistične mehanike), je funkcija funkcija oblike:[42]
kjer vsota poteka čez vsa možna različna stanja sistema, pa je verjetnost, da se sistem najde v i-tem stanju.
To je tesno povezano z Gibbsovo formulo za entropijo:
V nadaljevanju se bo namesto količine rabila količina . (glede na primer Waldram (1985), str. 39).
Odvod po času najprej da:
(če se uporabi dejstvo, da je , ker je , je tako drugi člen enak 0. Kasneje se bo videlo, da bo koristno to razdeliti na dve vsoti.)
Fermijevo zlato pravilo sedaj da glavno enačbo za povprečno hitrost kvantnih skokov iz stanja v ; in iz stanja v . (Seveda Fermijevo zlato pravilo sámo daje določene približke in uvedba tega pravila je tisto, kar uvaja ireverzibilnost. To je v bistvu kvantna različica Boltzmannovega SZA.) Za izolirani sistem bodo skoki prispevali:
kjer reverzibilnost dinamike zagotavlja, da se v obeh izrazih pojavi ista prehodna konstanta .
Tako je:
Dva člena razlik v vsoti imata vedno enak predznak. Na primer:
in potem:
tako se bosta na splošno dva negativna predznaka izničila.
Zato:
za izolirani sistem.
Včasih se rabi enaka matematika za prikaz, da je relativna entropija funkcija Ljapunova markovskega procesa v podrobnem ravnovesju in drugih kemijskih kontekstih.
Gibbsov izrek H
[uredi | uredi kodo]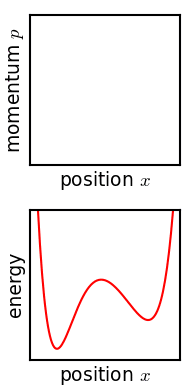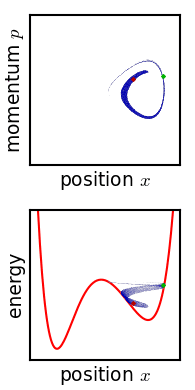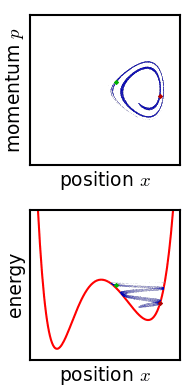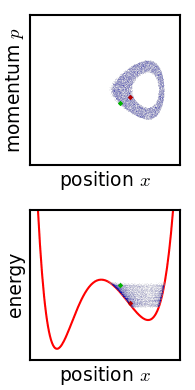
Gibbs je opisal drug način, v katerem bi se entropija mikroskopskega sistema s časom povečevala.[43] Kasnejši pisci so to poimenovali »Gibbsov izrek H«, saj je njegov zaključek podoben Boltzmannovemu.[44] Gibbs sam tega nikoli ni imenoval izrek H in pravzaprev se njegova definicija – in mehanizma povečevanja – zelo razlikujeta od Boltzmannove. Ta razdelek je vključen zaradi zgodovinske celostnosti.
Nastavitev Gibbsovega izreka o nastajanju entropije je v ansambelski statistični mehaniki, količina entropije pa je Gibbsova entropija (informacijska entropija), definirana v smislu verjetnostne porazdelitve za celotno stanje sistema. To je v nasprotju z Boltzmannovo količino , definirano v smislu porazdelitve stanj posameznih molekul v določenem stanju sistema.
Gibbs je obravnaval gibanje ansambla, ki je na začetku omejen na majhno območje faznega prostora, kar pomeni, da je stanje sistema znano s precejšnjo točnostjo, čeprav ne povsem eksaktno (nizka Gibbsova entropija). Razvoj tega ansambla s časom poteka po Liouvillovi enačbi. Za skoraj vse vrste realističnih sistemov Liouvillova evolucija teži k »mešanju« ansambla v faznem prostoru, kar je analogen proces kot mešanje barvila v nestisljivi tekočini.[43] Čez nekaj časa se zdi, da je ansambel razpršen po faznem prostoru, čeprav je v resnici vzorec s finimi črtami, pri čemer se skupna prostornina ansambla (in njegova Gibbsova entropija) ohranja. Zagotovljeno je, da Liouvillova enačba ohranja Gibbsovo entropijo, saj na sistem ne deluje noben naključni proces – načeloma je mogoče prvotni ansambel kadar koli obnoviti z obračanjem gibanja.
Kritična točka izreka je torej: če je fina struktura v vznemirjenem ansamblu iz kakršnega koli razloga zelo rahlo zamegljena, se Gibbsova entropija poveča in ansambel postane ravnovesni ansambel. Obstaja več predlaganih mehanizmov, zakaj naj bi do zamegljenosti v resnici prišlo. Eden od predlaganih mehanizmov je na primer, da je fazni prostor iz nekega razloga grobozrnat (analogno pikselizaciji pri simulaciji faznega prostora, prikazani na sliki). Za katero koli zahtevano končno stopnjo finosti postane ansambel po končnem času »čutno enoten«. Ali pa, če sistem doživi majhno nenadzorovano interakcijo s svojim okoljem, se bo ostra koherentnost ansambla izgubila. Edwin Thompson Jaynes je trdil, da je zameglitev subjektivne narave in preprosto ustreza izgubi znanja o stanju sistema.[45]:391 V vsakem primeru, ne glede na to, ali se zgodi, je povečanje Gibbsove entropije nepovratno, če zamegljenosti ni mogoče obrniti.
Eksaktno razvijajoča se entropija, ki se ne poveča, je znana kot drobnozrnata entropija. Zamegljena entropija je znana kot grobozrnata entropija. Leonard Susskind je analogiziral to razlikovanje s pojmom prostornine vlaknaste krogle bombaža:[46] po eni strani je prostornina samih vlaken konstantna, po drugi strani pa obstaja večja grobozrnata prostornina, ki ustreza obrisu krogle.
Gibbsov mehanizem povečevanja entropije rešuje nekatere tehnične težave, ki se jih najde v Boltzmannovem izreku H: Gibbsova entropija ne fluktuira niti ne kaže Poincaréjeve vrnite, zato je povečanje Gibbsove entropije, ko se pojavi, nepovratno, kot se od termodinamike pričakuje. Gibbsov mehanizem se enako dobro uporablja tudi za sisteme z zelo malo prostostnimi stopnjami, kot je na primer sistem z enim delcem, prikazan na sliki. V kolikor se sprejme, da ansambel postane zamegljen, je Gibbsov pristop jasnejši dokaz drugega zakona termodinamike.[45]:391
Na žalost, kot so poudarili John von Neumann in drugi na začetku razvoja kvantne statistične mehanike, se ta vrsta argumentov ne prenese na kvantno mehaniko.[47] V kvantni mehaniki ansambel ne more podpirati vedno finejšega procesa mešanja zaradi končne razsežnosti ustreznega dela Hilbertovega prostora. Namesto da bi se vse bolj približevala ravnovesnemu ansamblu (časovno povprečen ansambel), kot v klasičnem primeru, bo matrika gostote kvantnega sistema nenehno kazala razvoj in celo kazala vrnitve. Razvijanje kvantne različice izreka H brez prizivanja na SZA je torej bistveno bolj zapleteno.[47]
Glej tudi
[uredi | uredi kodo]Opombe
[uredi | uredi kodo]- ↑ Boltzmann je izvirno rabil funkcijo porazdelitve (gostote) za kinetično energijo (označeno z ), za katero je funkcija nekoliko kompleksnejša.[18]:87 Po navadi se pri obravnavi izreka H rabi porazdelitvena funkcija za hitrost ,[19]:3 za gibalno količino [20] ali po točkah v faznem prostoru , .[21]:565
- ↑ Boltzmann jo je opredelil kot nekakšno mero odstopanja prevladujočega stanja od maxwellovske.[24]
- ↑ Boltzmann je za količino izvirno uporabil črko , večina literature za njim pa uporablja črko kot v tem članku. Boltzmann je uporabil tudi simbol za označevanje kinetične energije delca.
- ↑ Boltzmann neposredno ni rabil tega izraza. Uvedel ga je Paul Ehrenfest leta 1912.
- ↑ Molekule so na primer vsebovane v posodi s končno prostornino, s čimer je izključeno, da lege postanejo neskončne. Predpostavi se tudi, da hitrosti vedno ostajajo končne.
- ↑ Obstaja nekaj izjemnih stanj, za katera to ni preverjeno, vendar so ta izjemna stanja zanemarljiva med vsemi možnimi stanji, in to v smislu, ki ga je mogoče narediti matematično eksaktnega.
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 1,2 1,3 Boltzmann (1872).
- ↑ 2,0 2,1 2,2 Strnad (2003).
- ↑ Uffink (2004).
- ↑ Lesovik idr. (2016).
- ↑ »We May Have Found a Way to Cheat the Second Law of Thermodynamics«. Popular Mechanics (v angleščini). 31. oktober 2016. Pridobljeno 2. novembra 2016.
- ↑ Jha (2013).
- ↑ Zeh (1989).
- ↑ Boltzmann (1895).
- ↑ Boltzmann (1905).
- ↑ Bettini (2004).
- ↑ »S. H. Burbury«. The Information Philosopher (v angleščini). Pridobljeno 10. decembra 2018.
- ↑ Burbury (1890).
- ↑ Boltzmann (1896a).
- ↑ 14,0 14,1 Chapman (1937).
- ↑ Brush (1967).
- ↑ Gibbs (1902).
- ↑ Hjalmars (1977).
- ↑ 18,0 18,1 French (1984).
- ↑ 19,0 19,1 19,2 Brown; Myrvold (2008).
- ↑ Kvasnikov (2011).
- ↑ Mandula; Zhao (2012).
- ↑ 22,0 22,1 Parker (2009).
- ↑ Mayr (2021).
- ↑ 24,0 24,1 Boltzmann (1896b).
- ↑ Fitzpatrick (2016).
- ↑ Reid; Evans; Searles (2012).
- ↑ Uffink (2006).
- ↑ Loschmidt (1876).
- ↑ Rothstein (1957).
- ↑ Poincaré (1890).
- ↑ Boltzmann (1897a).
- ↑ Zermelo (1896a).
- ↑ Zermelo (1896b).
- ↑ Boltzmann (1897b).
- ↑ Gleick (2011).
- ↑ Tolman (1938), str. 135, formula 47.5.
- ↑ Tolman (1938), str. 135, formula 47.6.
- ↑ Tolman (1938), str. 135, formula 47.7.
- ↑ Tolman (1938), str. 135, formula 47.8.
- ↑ Tolman (1938), str. 136, formula 47.9.
- ↑ Huang (1987), str. 79, enačba 4.33.
- ↑ Tolman (1938), str. 460, formula 104.7.
- ↑ 43,0 43,1 Gibbs (1902), § XII.
- ↑ Tolman (1938).
- ↑ 45,0 45,1 Jaynes (1965).
- ↑ Susskind (2013).
- ↑ 47,0 47,1 Goldstein idr. (2010).
Viri
[uredi | uredi kodo]- Badino, Massimiliano (2011), »Mechanistic Slumber vs. Statistical Insomnia: The early history of Boltzmann's H-theorem (1868–1877)«, European Physical Journal H, 36 (3): 353–378, Bibcode:2011EPJH...36..353B, doi:10.1140/epjh/e2011-10048-5, S2CID 120302680
- Bettini, Stefano (2004), Anthropic Reasoning in Cosmology: A Historical Perspective, arXiv:physics/0410144
- Boltzmann, Ludwig (1866), »Über die mechanische Bedeutung des zweiten Hauptsatzes der Wärmetheorie«, Wiener Berichte, 53: 195–220
- Boltzmann, Ludwig (1868), »Studien uber das Gleichgewicht der lebendigen Kraft zwischen bewegten materiellen Punkten«, Wiener Berichte, 58: 517–560
- Boltzmann, Ludwig (1871), »Uber das Wärmegleichgewicht zwischen mehratomigen Gasmolekülen«, Wiener Berichte, 63: 397–418
- Boltzmann, Ludwig (1872), »Weitere Studien über das Wärmegleichgewicht unter Gasmolekülen« (PDF), Sitzungsberichte der Akademie der Wissenschaften zu Wien, mathematisch-naturwissenschaftliche Klasse, 66: 275–370, JFM 04.0566.01, arhivirano iz prvotnega spletišča (PDF) dne 17. oktobra 2019, pridobljeno 30. septembra 2022; ponatisnjeno v Boltzmann (1909), Vol. I, str. 316–402 [WA-1, 316].
Angleški prevod: Boltzmann, L. (2003). »Further Studies on the Thermal Equilibrium of Gas Molecules«. The Kinetic Theory of Gases. History of Modern Physical Sciences. Zv. 1. str. 262–349. Bibcode:2003HMPS....1..262B. doi:10.1142/9781848161337_0015. ISBN 978-1-86094-347-8. - Boltzmann, Ludwig (1877a), »Bemerkungen über einige Probleme der mechanische Wärmetheorie«, Wiener Berichte, 75: 62–100
- Boltzmann, Ludwig (1877b), »Über die Beziehung zwischen dem zweiten Hauptsatz der mechanischen Wärmetheorie und der Wahrscheinlichkeitsrechnung resp. den Sätzen uber das Wärmegleichgewicht«, Wiener Berichte, 76: 373–435
- Boltzmann, Ludwig (1878), »Weitere Bemerkungen uber einige Probleme der mechanischen Wärmetheorie«, Wiener Berichte, 78: 7–46
- Boltzmann, Ludwig (1879), »Erwiderung auf die Bemerkung des Hrn. Oscar Emil Meyer«, Wiedemanns Annalen, 8: 653–655
- Boltzmann, Ludwig (1880), »Erwiderung auf die Notiz des Hrn. O. E. Meyer: ˝Über eine veränderte Form" usw.«, Wiedemanns Annalen, 11: 529–534
- Boltzmann, Ludwig (1883), »Über das Arbeitsquantum, welches bei chemischen Verbindungen gewonnen werden kann«, Wiener Berichte, 88: 861–896
- Boltzmann, Ludwig (4. julij 1895), »On the Minimum Theorem in the Theory of Gases«, Nature, 51 (1340): 221, Bibcode:1895Natur..52R.221B, doi:10.1038/052221b0, ISSN 1476-4687, JFM 26.1059.11
- Boltzmann, Ludwig (1896a), Vorlesungen über Gastheorie, I. Theil, Leipzig: Johann Ambrosius Barth, JFM 26.1056.06
- Boltzmann, Ludwig (1896b), »Entgegnung auf die wärmetheoretische Betrachtung des Hrn E. Zermelo«, Wiedemanns Annalen (v nemščini), 57: 773–784, Bibcode:1896AnP...293..773B, doi:10.1002/Andp.18962930414, JFM 27.0760.01
- Boltzmann, Ludwig (1897a), »Über einen mechanischen Satz von Poincaré« (PDF), Sitzungsberichte der Akademie der Wissenschaften zu Wien, mathematisch-naturwissenschaftliche Klasse (v nemščini), 106: 12–19, JFM 28.0638.01
- Boltzmann, Ludwig (1897b), »Zu Hrn. Zermelo's Abhandlung „Über die mechanische Erklärung irreversibler Vorgänge"︁«, Wiedemanns Annalen (v nemščini), 60: 392–398, doi:10.1002/Andp.18972960216, JFM 28.0810.01
- Boltzmann, Ludwig (1905), Populäre Schriften, Leipzig: J. A. Barth, JFM 36.0040.03; ponovno izdano – Braunschweig: F. Vieweg, 1979
- Boltzmann, Ludwig (1909), Hasenöhrl, Fritz (ur.), Wissenschaftliche Abhandlungen, I, II, III. Band, Leipzig: J. A. Barth, JFM 40.0028.03, pridobljeno 9. septembra 2022; ponovno izdano – New York: Chelsea, 1969
- Brown, Harvey Robert; Myrvold, Wayne C.; Uffink, Jos (Maj 2009), »Boltzmann's H-theorem, its discontents, and the birth of statistical mechanics«, Studies in History and Philosophy of Modern Physics, 40 (2): 174–191, Bibcode:2009SHPMP..40..174B, doi:10.1016/j.shpsb.2009.03.003, ISSN 1355-2198, Zbl 1228.82052
- Brush, Stephen George (1967), »Boltzmann's "Eta Theorem": Where's the Evidence?«, American Journal of Physics, 35 (9): 892, Bibcode:1967AmJPh..35..892B, doi:10.1119/1.1974281
- Burbury, Samuel Hawksley (1890), »On some problems in the kinetic theory of gases«, The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 30 (185): 298–317, doi:10.1080/14786449008620029, ISSN 1478-6435, JFM 22.1176.01
- Cercignani, Carlo (1998), »5 Time irreversibility and the H-theorem«, Ludwig Boltzmann: The Man Who Trusted Atoms, Oxford: Oxford University Press, Bibcode:1998lbmt.book.....C, COBISS 26365701, doi:10.1093/acprof:oso/9780198570646.003.0005, ISBN 0-19-850154-4, MR 1700775, Zbl 0917.01028
- Chafaï, Djalil (2015), »From Boltzmann to random matrices and beyond«, Annales de la Faculté des sciences de Toulouse, (Mathématiques, Serie 6), 24 (4): 641–689, arXiv:1405.1003, doi:10.5802/afst.1459, ISSN 0240-2963, Zbl 1342.80001
- Chapman, Sydney (Maj 1937), »Boltzmann's H-Theorem«, Nature (v angleščini), 139 (3526): 931, Bibcode:1937Natur.139..931C, doi:10.1038/139931a0, S2CID 4100667
- Chliamovitch, Gregor; Malaspinas, Orestis; Chopard, Bastien (2017), »Kinetic theory beyond the Stosszahlansatz«, Entropy, 19 (8): 381, Bibcode:2017Entrp..19..381C, doi:10.3390/e19080381
- Fitzpatrick, Richard (23. januar 2016), »Boltzmann H-Theorem«, Univerza Teksasa v Austinu (v angleščini), pridobljeno 9. septembra 2022
- French, Steven (november 1984). Identity and Individuality in Classical and Quantum Physics (PDF). Oddelek za zgodovino in filozofijo znanosti, Kolidž Chelsea, Univerza v Londonu (diplomska naloga).
{{navedi thesis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - Gibbs, Josiah Willard (Marec 1902), Elementary Principles in Statistical Mechanics (v angleščini), New York: Schribner
- Gleick, James (2011), The Information: A History, a Theory, a Flood, Random House Digital, ISBN 978-0-375-42372-7
- Goldstein, Sheldon; Lebowitz, Joel Louis; Tumulka, Roderich; Zanghì, Nino (2010), »Long-time behavior of macroscopic quantum systems«, The European Physical Journal H, 35 (2): 173–200, arXiv:1003.2129, Bibcode:2010EPJH...35..173G, doi:10.1140/epjh/e2010-00007-7, ISSN 2102-6459, S2CID 5953844
- Grad, Harold (1. marec 1965), »On Boltzmann's H-Theorem«, Journal of the Society for Industrial and Applied Mathematics, Society for Industrial and Applied Mathematics (SIAM), 13 (1): 259–277, doi:10.1137/0113016, ISSN 0368-4245
- Gull, Stephen Frank (1989), »Some Misconceptions about Entropy«, v Buck, Brian; Macaulay, Vincent A. (ur.), Maximum Entropy in Action, Oxford: Oxford University Press (objavljeno 1991), ISBN 978-0-19-853963-6, arhivirano iz prvotnega spletišča dne 4. februarja 2012
- Halpern, Otto; Doermann, F. W. (1. junij 1939), »A New Proof of the H Theorem«, Physical Review, 55 (11): 1077–1082, Bibcode:1939PhRv...55.1077H, doi:10.1103/PhysRev.55.1077
- Hjalmars, Stig (2. februar 1977), »Evidence for Boltzmann H as capital eta«, American Journal of Physics, 45 (2): 214–215, Bibcode:1977AmJPh..45..214H, doi:10.1119/1.10664
- Huang, Kerson (1987), Statistical Mechanics (2. izd.), Random House Digital, Bibcode:1987stme.book.....H, COBISS 1240137, ISBN 978-0-471-81518-1
- Jaynes, Edwin Thompson (1. maj 1965), »Gibbs vs Boltzmann Entropies«, American Journal of Physics, 33 (5): 391–398, Bibcode:1965AmJPh..33..391J, doi:10.1119/1.1971557, Zbl 0127.21601
- Jha, Alok (1. december 2013). »What is the second law of thermodynamics?«. The Guardian (v britanski angleščini). ISSN 0261-3077. Pridobljeno 2. novembra 2016.
- Kvasnikov, Iridii Aleksandrovich (2001) [1994]. »Boltzmann H-theorem«. Encyclopedia of Mathematics. EMS Press.
- Lesovik, Gordey Borisovich; Lebedev, Andrey Vladimirovich; Sadovskyy, Ivan Aleksandrovich; Suslov, Mikhail Vasilyevich; Vinokur, Valerii Markovich (12. september 2016), »H-theorem in quantum physics«, Scientific Reports (v angleščini), 6: 32815, arXiv:1407.4437, Bibcode:2016NatSR...632815L, doi:10.1038/srep32815, ISSN 2045-2322, PMC 5018848, PMID 27616571
- Lifshitz, Evgeny Mikhailovich; Pitaevskii, Lev Petrovich (1981), Physical Kinetics, (Course of Theoretical Physics), zv. 10 (3. izd.), Pergamon, Bibcode:1981phki.book.....L, ISBN 978-0-08-026480-6
- Loschmidt, Johann Josef (1876), »Űber den Zustand des Wärmegleichgewichtes eines Systems von Kőrpern mit Rücksicht auf die Schwerkraft, I«, Sitzungsber. Kais. Akad. Wiss. Wien, Math. Naturwiss. Classe, II. Abteilung 73: 128–142, OCLC 834721197
- Manca, Vincenzo (Februar 2017), »An Informational Proof of H-Theorem«, Open Access Library Journal, 4 (2): 1–15, doi:10.4236/oalib.1103396
- Mandula, Buren; Zhao, Ying-Chun (15. oktober 2012), »An Exact Solution to the Two-Particle Boltzmann Equation System for Maxwell Gases«, Communications in Theoretical Physics, 58 (4): 565–568, Bibcode:2012CoTPh..58..565B, doi:10.1088/0253-6102/58/4/20, ISSN 0253-6102, MR 3097768
- Mayr, Julian (november 2021), The Boltzmann Equation and H-theorem (PDF), pridobljeno 8. septembra 2022
{{citation}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - Medel-Portugal, Carlos; Solano-Altamirano, Juan Manuel; Carrillo-Estrada, José Luis E. (2021), »Classical and Quantum H-Theorem Revisited: Variational Entropy and Relaxation Processes«, Entropy, 23 (3): 366, Bibcode:2021Entrp..23..366M, doi:10.3390/e23030366
- Parker, Daniel (november 2009), The H-Theorem, Molecular Disorder and Probability: Perspectives from Boltzmann’s Lectures on Gas Theory [preprint], PhilSci-Archive, pridobljeno 14. septembra 2022
{{citation}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - Poincaré, Henri (1890), »Sur le problème des trois corps et les équations de la dynamique«, Acta Mathematica, 13 (1–2): 1–270, JFM 22.0907.01
- Poincaré, Henri (1893), »Le mécanisme et l'expérience«, Revue de métaphysique et de morale, 1: 534–537, JFM 27.0049.15
- Reid, James Cowie; Evans, Denis James; Searles, Debra Joy (11. januar 2012), »Communication: Beyond Boltzmann's H-theorem: Demonstration of the relaxation theorem for a non-monotonic approach to equilibrium« (PDF), The Journal of Chemical Physics, 136 (2): 021101, Bibcode:2012JChPh.136b1101R, doi:10.1063/1.3675847, hdl:1885/16927, ISSN 0021-9606, PMID 22260556
- Reif, Frederick (1965), Fundamentals of Statistical and Thermal Physics, McGraw-Hill, Bibcode:1965fstp.book.....R, ISBN 978-0-07-051800-1
- Rothstein, Jerome (1957), »Nuclear Spin Echo Experiments and the Foundations of Statistical Mechanics«, American Journal of Physics, 25 (8): 510–518, Bibcode:1957AmJPh..25..510R, doi:10.1119/1.1934539, Zbl 0077.40404
- Strnad, Janez (2003), Razvoj fizike, Ljubljana: DZS, d. d., COBISS 122516736, ISBN 86-341-1872-X, OCLC 446245699
- Susskind, Leonard (2013), »Statistical Mechanics Lecture 7«, YouTube
- Tolman, Richard Chace (1938), The Principles of Statistical Mechanics, (International Series of Monographs on Physics), Oxford: Clarendon Press, Bibcode:1938psm..book.....T, COBISS 310249, JFM 64.0886.07, Zbl 0019.35902
- Uffink, Jos (2004), »Boltzmann's Work in Statistical Physics«, Stanford Encyclopedia of Philosophy, pridobljeno 7. septembra 2022
- Uffink, Jos (2. februar 2006), Compendium of the foundations of classical statistical physics [preprint], PhilSci-Archive, pridobljeno 3. septembra 2022
- Villani, Cédric (2008), H-Theorem and beyond: Boltzmann’s entropy in today’s mathematics (PDF), Boltzmann's legacy, (ESI Lectures in Mathematics and Physics), Zürich: Evropsko matematično društvo, str. 129–143, MR 2509760, Zbl 1156.82313, pridobljeno 8. septembra 2022
- Waldram, John Ryder (1985), The Theory of Thermodynamics, Cambridge ; London ; New York: Cambridge University Press, Bibcode:1985thth.book.....W, COBISS 2565125, ISBN 978-0-521-28796-8
- Weingartner, Paul (1998–1999), »Are Statistical Laws Genuine Laws ? A Concern of Poincaré and Boltzmann«, Philosophia Scientiae, Éditions Kimé, 3 (2): 215–235
- Zeh, Heinz-Dieter (1989), The physical basis of the direction of time (1. izd.), Berlin : Heidelberg : New York: Springer-Verlag, Bibcode:1989pbdt.book.....Z, ISBN 0-387-50930-5, OCLC 611546370 (2. izd. (1992): (COBISS), Zbl 0770.00002)
- Zermelo, Ernst (1896a), »Über einen Satz der Dynamik und die mechanische Wärmetheorie«, Wiedemanns Annalen (v nemščini), 57 (3): 485–494, Bibcode:1896AnP...293..485Z, doi:10.1002/andp.18962930314, JFM 27.0759.03
- Zermelo, Ernst (1896b), »Über mechanische Erklärungen irreversibler Vorgänge. Eine Antwort auf Hrn. Boltzmann's „Entgegnung"︁«, Wiedemanns Annalen (v nemščini), 59 (12): 793–801, Bibcode:1896AnP...295..793Z, doi:10.1002/andp.18962951216, JFM 27.0760.02
Zunanje povezave
[uredi | uredi kodo]- Weisstein, Eric Wolfgang. "H-Theorem". ScienceWorld (angleško)
















![{\displaystyle {\frac {\partial f(W_{k},t)}{\partial t}}=\int _{0}^{\infty }\int _{0}^{W_{k}+W'_{k}}\left[{\frac {f(\xi ,t)}{\sqrt {\xi }}}{\frac {f(W_{k}+W'_{k}-\xi ,t)}{\sqrt {W_{k}+W'_{k}-\xi }}}-{\frac {f(W_{k},t)}{\sqrt {W_{k}}}}{\frac {f(W'_{k},t)}{\sqrt {W'_{k}}}}\right]{\sqrt {W_{k}W'_{k}}}\psi (W_{k},W'_{k},\xi )\,\mathrm {d} W'_{k}\,\mathrm {d} \xi \!\,.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4499ed343cb3ffd349ab24cd7d612f57198a615d)














































