Celično dihanje

Celično dihanje ali celična respiracija je skupek presnovnih (metabolnih) reakcij in procesov, ki potekajo v celicah organizmov, in v katerih se kemična energija kisikovih molekul[1] ter hranil pretvarja v molekule adenozina trifosfata (ATP) in odpadne produkte.[2] Biokemijske reakcije, ki predstavljajo del celičnega dihanja, so katabolne reakcije, pri katerih večje molekule (makromolekule) razpadejo na manjše, pri čemer se sprošča energija, ker so šibke in z energijo bogate vezi (predvsem tiste v dvoatomarnih molekulah kisika) nadomeščene z močnejšimi vezmi nastalih produktov.[3] Med hranila, ki jih za pridobivanje energije v procesu celične respiracije najpogosteje uporabljajo živalske in rastlinske celice, spadajo ogljikovi hidrati (predvsem v obliki glukoze), aminokisline in maščobne kisline, medtem ko je najpogosteje uporabljen oksidant dvoatomarni kisik.[1] Celično dihanje običajno delimo na tri glavne faze: glikolizo, Krebsov cikel (ciklus trikarboksilnih skupin[4], pa tudi cikel citronske kisline[5] in citratni cikel[6]) in dihalno verigo (tudi elektronsko transportno verigo[7][8] ali elektronsko prenašalno verigo[9]).[10][11]
Glikoliza[uredi | uredi kodo]
Glikoliza ali glikolitična pot[12] je prva faza celičnega dihanja, za katero je značilna odsotnost kisika, saj je proces v svoji osnovi anaeroben.[13][14] Reakcije glikolize so med organizmi zelo razširjene in veljajo za evolucijsko zgodnje presnovne procese[13][14][15], saj se jih poslužujejo skoraj vsi živeči organizmi, četudi obstaja nekaj alternativ in različic glikolitične poti.[16][13] Proces naj bi predstavljal univerzalni način za proizvodnjo energijskih molekul; strokovnjaki sklepajo, da naj bi glikolitično pot uporabljali že organizmi, ki so bivali v času pred pojavom kisika v ozračju in pred nastankom prve evkariontske celice.[15] Proces poteka v citoplazmi tako prokariontskih kot tudi evkariontskih celic.[13]
Glukoza, ki predstavlja osnovo za potek glikolize, v celico heterotrofnih organizmov vstopa preko aktivnega transporta, ki je največkrat sekundaren, saj glukoza prehaja v smeri naraščajočega koncentracijskega gradienta (iz območja, kjer je manjša koncentracija glukoznih molekul, na predel, kjer je koncentracija glukoznih molekul večja).[13] Delež prenašanja glukoze v celico pa opravijo tudi integralne beljakovine, ki se imenujejo glukozni transporterji (tudi samo GLUT).[17] Delovanje tovrstnih membranskih prenašalcev temelji na procesu difuzije, pri čemer transporterji izvajajo tako imenovano olajšano (pospešeno ali facilitirano[18]) difuzijo glukoznih molekul.[13]
V proces glikolize vstopa posamična glukozna molekula, za katero je značilna ciklična zgradba iz šestih ogljikovih atomov, medtem ko sta končni produkt glikolitičnih reakcij dve sladkorni molekuli iz treh ogljikovih atomov, ki ju imenujemo piruvat (anion piruvične kisline[19]).[13] Do piruvata se lahko v glikolitični poti razgradijo tudi drugi monosaharidi, kot sta fruktoza in galaktoza.[15] Pogosto se glikolizo deli na dva sklopa biokemijskih reakcij, pri čemer se v prvi polovici glikolitične poti energija porablja (pripravljalna stopnja), medtem ko v drugi polovici energija nastaja (donosna stopnja) in se shranjuje v obliki molekul ATP ter NADH (reducirana oblika nikotinamidadenindinukleotida[20]).[13][15]

Prva polovica glikolize (pripravljalna stopnja)[uredi | uredi kodo]
Reakcije prve polovice glikolize lahko razdelimo na pet glavnih korakov.
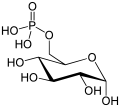
V prvem koraku encim heksokinaza s pomočjo molekule ATP (ki predstavlja vir fosfata) fosforilira glukozno molekulo, pri čemer nastaja reaktivnejša oblika glukoze (pravimo, da se glukoza aktivira[21]), ki se imenuje glukoza-6-fosfat (G6P).[22] Gre za reakcijo prenosa skupin.[15] Zaradi strukturne spremembe fosforilirana glukozna molekula ne more zapustiti celice (preprečeno je vnovično prehajanje glukoznih transporterjev), saj jo pri tem ovira fosfat, ki je negativno nabit in zatorej nezdružljiv z nepolarnim ter hidrofobnih slojem celične membrane.[13][14]
V drugem koraku je bistveno delovanje encima izomeraze, tj. encima, ki katalizira pretvorbo substrata iz ene izomere v drugo.[23][24][25] V dotičnem primeru glikolitičnih reakcij izomeraza (natančneje glukoza-6-fosfat izomeraza[26] ali fosfoglukoizomeraza[15]) katalizira pretvorbo produkta prvega koraka glikolize, glukoze-6-fosfata, v fruktuzo-6-fosfat (krajšava F6P), ki je eden izmed izomerov glukoze-6-fosfata; gre za izomerizacijo.[13][14][15]
 |
ATP ADP heksokinaza ali glukokinaza |
 |
glukoza-6-fosfat izomeraza |

|
| α-D-glukoza | α-D-glukoza-6-fosfat | α-D-fruktoza-6-fosfat |
Tretji korak prve polovice glikolize predstavlja fosforilacija fruktoze-6-fosfata, ki jo izvede encim fosfofruktokinaza (tudi PFK[27]). Fosfat, ki se v procesu fosforilacije veže na molekulo fruktoze-6-fosfata, izvira iz druge molekule ATP (prva je namreč svoj fosfat predala glukozni molekuli v prvem koraku glikolize), pri sami reakciji pa nastane fruktoza-1,6-bifosfat (F1,6BP). Dodan fosfat, za katerega je značilna visoka energijska vrednost, dodatno destabilizira molekulo fruktoze-1,6-bifosfata.[13][14] Tudi v tem koraku gre za reakcijo prenosa skupin.[15] Encim fosfofruktokinaza obenem opravlja regulatorno vlogo[27][14], saj do neke mere nadzira potek glikolitične poti. Največjo aktivnost encim pokaže, kadar je koncentracija adenozina difosfata (ADP) visoka, medtem ko se aktivnost močno spusti, kadar je raven ADP-ja nizka in koncentracija ATP-ja visoka. Na tak način fosfofruktokinaza upočasni oziroma deloma onemogoči presnovo pot, kadar je v sistemu dovolj molekul ATP.[13]
 |
ATP ADP fosfofruktokinaza |

|
| β-D-fruktoza-6-fosfat | β-D-fruktoza-1,6-bifosfat |
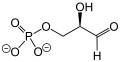
Bistveni element četrtega koraka glikolize je encim aldolaza (aldehid liaza[28]), specifično fruktoza-1,6-bisfosfat aldolaza[28], ki poskrbi za cepitev (nehidrolitično cepitev[15]) fruktoze-1,6-bifosfata v dva izomera s tremi ogljikovimi atomi, in sicer dihidroksiacetonfosfat (DHAP) in gliceraldehid-3-fosfat (GADP).[13][14]
V petem koraku, ki je zadnja faza prve polovice glikolize, encim izomeraza (natančneje trioza-fosfat izomeraza ali triozafosfat-izomeraza[15]) povzroči pretvorbo dihidroksiacetonafosfata v gliceraldehid-3-fosfat, njegov izomer (reakcija izomerizacije[15]). Posledično v nadaljnjih reakcijah sodelujeta dve molekuli enakega izomera (gliceraldehida-3-fosfata). Celoten izkupiček prve polovice glikolize je negativen, saj sta bili v opisanih korakih porabljeni dve molekuli ATP.[13][14][21]
 |
aldolaza |
 |
trioza-fosfat izomeraza |

|
| β-D-fruktoza-1,6-bifosfat | dihidroksiacetonfosfat | D-gliceraldehid-3-fosfat |
Druga polovica glikolize (donosna stopnja)[uredi | uredi kodo]
Če se v prvi polovici glikolize energetsko bogate molekule ATP porabijo, je za drugo polovico glikolize značilno nastajanje ATP.[13] Proces se odvija dvakrat, ker se je glukoza posredno razdelila na dve molekuli sladkorja, pri čemer vsaka sestoji iz treh ogljikovih atomov (v sistemu sta dva gliceraldehida-3-fosfata: en izvira iz četrtega koraka, medtem ko je drug pretvorjen dihidroksiacetonfosfat iz petega koraka).[14]
V prvem koraku druge polovice glikolize (oziroma sedmem koraku glikolize) najprej poteče oksidacija gliceraldehida-3-fosfata, ki izvira iz petega koraka glikolitične poti.[13][14] Pri tem procesu se sprostijo energijsko bogati elektroni, ki jih prevzame prenašalec elektronov[29], NAD+ (nikotinamidadenindinukleotid), pri čemer se tvori molekula NADH (reducirana oblika NAD+). Sledi fosforilacija, pri čemer se na oksidiran sladkor doda še ena fosfatna skupina, nakar nastane molekula 1,3-bifosfatglicerata (1,3PG).[13][14] Reakcijo katalizira encim gliceraldehid-3-fosfat dehidrogenaza[30] in je eksotermna.[14] V prvem koraku druge polovice glikolize gre za reakciji prenosa skupin in oksidoredukcije (oksidacije in redukcije).[15] Za samo fosforilacijo ni potreben razpad dodatne molekule ATP. Nadaljevanje glikolitične poti je odvisno od razpoložljivosti molekule prenašalca elektronov NAD+, oksidirane oblike NADH. Za nadaljnje korake so bistvene neprekinjene reakcije oksidacije molekule NADH nazaj v NAD+, brez katerega se reakcije druge polovice glikolize upočasnijo ali v izjemnih primerih tudi popolnoma ustavijo. Pri aerobnem tipu celičnega dihanja (ob prisotnosti kisika) oksidacija NADH poteka redno v kasnejših reakcijah celičnega dihanja, pri čemer se ob oksidaciji sproščajo z energijo bogati vodikovi elektroni, ki se zatem uporabijo za nastajanje molekul ATP. Tudi anaerobni procesi pridobivanja energije, kot je denimo vrenje (fermentacija), imajo mehanizme, s pomočjo katerih pride do pretvorbe molekul NADH v oksidirano obliko NAD+.[13]
 |
NAD+ NADH + Pi + H+  gliceraldehid-3-fosfat dehidrogenaza |

|
| D-gliceraldehid-3-fosfat | D-1,3-bifosfoglicerat |
Sledi drugi korak druge polovice glikolize (sedmi korak glikolize), v katerem je ključen encim fosfoglicerat kinaza (fosfoglicerat-kinaza[15]), ki poskrbi za odcep ene z energijo bogate fosfatne skupine iz molekule 1,3-bifosfoglicerata, pri čemer se fosfat veže na molekulo ADP, kar vodi v nastajanje ene molekule ATP. Po odstranitvi fosfatne skupine se karbonilna skupina 1,3-bifosfoglicerata oksidira v karboksilno skupino, pri čemer nastane molekula, imenovana 3-fosfoglicerat (krajšava 3PG).[13][14] Gre za reakcijo prenosa skupin.[15]
 |
fosfoglicerat kinaza ADP ATP  |

|
| D-1,3-bifosfoglicerat | D-3-fosfoglicerat |
Za osmi korak je značilno delovanje encima mutaze (encima iz skupine izomeraz[31]), natančneje fosfoglicerat mutaze, ki povzroči pretvorbo 3-fosfoglicerata v 2-fosfoglicerat (2PG).[32] Gre za reakcijo izomerizacije, pri kateri se ena molekula pretvori v drugačen izomer.[33][15] Pri nastajanju 2-fosfoglicerata iz 3-fosfoglicerata se spremeni položaj fosfatne skupine, ki se odcepi od tretjega ogljikovega atoma in se veže na drugi ogljikov atom.[13][14]
V devetem koraku glikolize (četrtem koraku druge polovice glikolize) sledi dehidracijska reakcija, pri čemer se iz molekule sladkorja (2-fosfoglicerata) odcepi molekula vode, kar vodi v nastajanje dvojne vezi, višanje potencialne energije fosfatne skupine, nakar nastane molekula fosfoenolpiruvata (krajšava PEP).[13] Reakcijo katalizira glikolitični encim enolaza.[34][35] Molekula fosfoenolpiruvata je relativno nestabilna.[14]
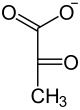
Deseti korak, zadnjo fazo glikolitične poti, pospešuje encim, ki se imenuje piruvat kinaza (krajšava PK). Pri reakciji poteče prenos fosfatne skupine iz fosfoenolpiruvata na molekulo adenozina difosfata, pri čemer pride do nastanka piruvata (aniona piruvične kisline[19]) in druge molekule ATP. Sama reakcija je nepovratna (ireverzibilna).[36]
 |
fosfoglicerat mutaza |
 |
−H2O enolaza  |
 |
ADP ATP piruvat kinaza |
|
| D-3-fosfoglicerat | D-2-fosfoglicerat | fosfoenolpiruvat | piruvat |
Izkupiček glikolize[uredi | uredi kodo]
V proces glikolitičnih reakcij vstopa ena molekula glukoze, ki se v sosledju opisanih reakcij pretvori v dve molekuli piruvata.[14][37][11] Hkrati pri procesu nastanejo štiri molekule ATP (druga faza glikolize se namreč odvije dvakrat, enkrat za vsak ogljikov hidrat, ki je sestavljen iz treh ogljikovih atomov[14]), četudi končni energijski izkupiček obsega zgolj dve molekuli ATP, ker se dve porabita za aktivacijo glukozne molekule na samem začetku glikolize.[11][37][21] Obenem sta končni produkt glikolitične poti tudi dve molekuli NADH, ki se uporabita v nadaljnjih reakcijah celičnega dihanja. V redkih primerih, kadar primanjkuje encima piruvat kinaze, ki katalizira zadnji korak glikolize (pretvorbo fosfoenolpiruvata v piruvat), v celotnem procesu nastaneta le dve molekuli adenozina trifosfata.[37][11]
Vmesni produkti glikolize[uredi | uredi kodo]
-
Glukoza-6-fosfat, ki je produkt prvega koraka glikolize.
-
V drugem koraku encim izomeraza povzroči pretvorbo v fruktuzo-6-fosfat, ki je prikazana na sliki.
-
Produkt tretjega koraka glikolize je na sliki prikazana fruktoza-1,6-bifosfat.
-
Dihidroksiacetonfosfat, eden izmed dveh produktov četrtega koraka glikolize.
-
Gliceraldehid-3-fosfat nastane že v četrtem koraku, medtem ko se v petem koraku dihidroksiaceton-fosfat pretvori v še eno molekulo gliceraldehida-3-fosfata.
-
S fosforilacijo nastane molekula 1,3-bifosfoglicerata.
-
Poteče odcepitev fosfatne skupine, hkrati se karbonilna skupina pretvori v karboksilno, nakar nastane 3-fosfoglicerat.
-
V reakciji izomerizacije se 3-fosfoglicerat pretvori v 2-fosfoglicerat (na sliki).
-
Produkt deveta koraka glikolize je fosfoenolpiruvat.
-
Na sliki je prikazan končni produkt glikolize, piruvat, ki je anion piruvične kisline.
Oksidativna dekarboksilacija piruvata[uredi | uredi kodo]

Glikolizi sledi vmesna stopnja[38], ki ji pravimo oksidativna dekarboksilacija piruvata ali oksidacija piruvata[15], in je odvisna od kisika, in v kateri se piruvat, končni produkt glikolitične poti, preoblikuje. Transformacija piruvata je nujen pogoj za nadaljevanje reakcij celičnega dihanja. Sam proces poteka v mitohondriju, kamor je piruvat prenesen iz citosola, kjer se odvija glikolitična pot. V procesu preoblikovanja se piruvat pretvori v acetilno skupino, na katero zatem deluje koencim A (krajšava CoA[39]), osnovno sestavino pa predstavlja vitamin B5 (pantotenska kislina), kar vodi v nastajanje spojine, ki ji rečemo acetil-CoA (tudi acetilkoencim A). Bistvena funkcija slednjega je prenos acetilne skupine piruvata v nadaljnje reakcije celičnega dihanja (natančneje Krebsov cikel).[13][40][41][42] Acetilkoencim A lahko nastane tudi v procesu oksidacije beta, kjer se oksidirajo maščobne kisline.[43]
Poenostavljena reakcija[15]: 1 piruvat + 1 NAD+ + CoA → 1 acetil-CoA + NADH + CO2 + H+
Potek[uredi | uredi kodo]
Pretvorbo piruvata lahko razdelimo v tri glavne korake:
- Najprej poteče odstranitev karboksilne skupine (-COOH) iz molekule piruvata, pri čemer se v obkrožajočo tekočino sprosti molekula ogljikovega dioksida[13][41], ki zatem difundira iz celice.[42] Nastala molekula ima sedaj dva atoma ogljika in je funkcionalno hidroksietilna skupina.[13] Reakcijo katalizira encim piruvat dehidrogenaza, ki deluje v kompleksu (kompleks piruvat dehidrogenaze ali PDH[44])[45], sestavljenem iz treh encimov in petih koencimov.[40][15] Proces poteče dvakrat, ker v reakcije vstopata dve molekuli piruvata.[13][42]
- Obenem poteče redukcija molekule NAD+ do NADH, saj se hidroksietilna skupina oksidira do acetilne skupine, pri čemer se sprostijo elektroni, ki jih nase veže NAD+ in se zato pretvori v NADH.[13][42]
- Zadnji korak pretvorbe piruvata predstavlja prenos acetilne skupine do koencima A, kar vodi v nastanek acetil-CoA.[13]
Krebsov cikel[uredi | uredi kodo]
Krebsov cikel ali ciklus trikarboksilnih skupin[4], pa tudi cikel citronske kisline[5] in citratni cikel[6], je skupek biokemijskih reakcij, ki sledi oksidativni dekarboksilaciji piruvata, in se odvija v matriksu, mitohondrijski tekočini. Za Krebsov cikel je značilno veliko število različnih encimov, ki jim je skupna topnost (izjema je v notranjo membrano mitohondrija vgrajen encim sukcinat dehidrogenaza). Bistvena značilnost Krebsovega cikla je tudi cikličnost, ki je razvidna že iz imena, saj reakcije potekajo v urejenem krožnem zaporedju, pri čemer je produkt zadnje reakcije hkrati substrat za izvajanje prve reakcije. Navadno se cikel deli na sedem korakov, za katere so značilne razne reakcije, kot so denimo redoks reakcije, dehidracije, hidracije in dekarboksilacije. Končni izkupiček procesa sta dve molekuli ogljikovega dioksida, ena molekula ATP-ja ali GTP-ja (gvanozina trifosfata) in NADH ter FADH2 (flavinadenindinukleotid) v svoji reducirani obliki. Za razliko od prejšnjih reakcij je citratni cikel aerobni proces, kar pomeni, da je zanj nujna prisotnost kisika, ki je v reakcije sicer udeležen posredno. NADH in FADH2 morata oddati svoje elektrone v nadaljnje reakcije, v katerih sodeluje tudi kisik; v nasprotnem primeru se oksidacijske reakcije Krebsovega cikle ne dogajajo.[13] Citratni cikel je tudi presnovno središče mnogih drugih reakcij, ki se na tem mestu končujejo ali začnejo (denimo nastajanje raznih aminokislin, pirimidinskih nukleotidov, purinskih nukleotidov in drugih molekul).[21]

Potek[uredi | uredi kodo]
V nadaljevanju sledi opis poteka Krebsovega cikla, ki je razdeljen v sedem korakov.
Pred začetkom citratnega cikla poteče oksidacija piruvata (oksidativna dekarboksilacija piruvata), v kateri se piruvat pretvori v acetil-CoA.[38] Zatem sledi nastajanje molekule citrata; združita se acetilna skupina (z dvema ogljikovima atomoma) in oksaloacetat (s štirimi ogljikovimi atomi).[13][43] Reakcijo adicije acetilne skupine na ketoskupino oksaloacetata katalizira encim citrat sintaza.[46][15] Acetilna skupina izvira iz acetila-CoA, čigar CoA (koencim A) se v prvem koraku Krebsovega cikla veže na sulfhidrilno skupino (R-SH) in s tem zapusti reakcije ter se vrne v procese oksidativne dekarboksilacije piruvata. Za ta korak citratnega cikla je značilna možnost nadzora, saj večje količine ATP-ja upočasnjujejo cikel, medtem ko se raven poteka zviša ob premajhnih koncentracijah ATP.[13]

Sledi drugi korak, kjer se od citrata (produkta prvega koraka) najprej odcepi ena molekula vode (eliminacija vode) in nastane dvojna vez, nakar se zgodi vezava druge vodne molekule (adicija) na dvojno vez, obenem pa se citrat pretvori v svoj izomer, izocitrat.[13][47][15] Reakcijo postopne pretvorbe citrata v izocitrat preko cis-akonitata (vmesnega produkta) katalizira encim akonitaza.[48][15]

V tretjem koraku poteče reakcija oksidacije, v kateri je izocitrat posredno (preko nestabilnega vmesnega produkta) oksidiran v molekulo α-ketoglutarata (tudi oksoglutarat[49]). Pri tem nastanejo tudi molekula ogljikovega dioksida in dva elektrona, ki vodita redukcijo NAD+ v NADH.[13][15] Reakcijo katalizira encim izocitrat dehidrogenaza.[50][47]
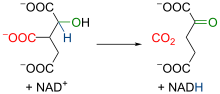
V sledečem četrtem koraku nastane sukcinilna skupina, nakar se nanjo veže koencim A, kar vodi v nastajanje molekule sukcinilkoencim A (tudi sukcinil-CoA[51]). Tudi v tem koraka potečeta tako oksidacija kot dekarboksilacija molekule, pri čemer se sprostijo elektroni, ki so odgovorni za redukcijo NAD+ v NADH, odcepi pa se tudi karboksilna skupina, ki tvori molekulo ogljikovega dioksida.[13] Reakcijo katalizira encimski kompleks α-ketoglutarat dehidrogenaza.[52][47][15]

Za peto reakcijo je značilen mehanizem iz treh korakov. V prvem koencim A iz molekule sukcinilkoencima A zamenja nukleofilni anorganski fosfat, kar vodi v nastajanje molekule sukcinil fosfata. Potem encim izkoristi histidinski preostanek, da iz sukcinil fosfata odstrani fosfatno skupino, nakar nastane sukcinat. Fosforiliran histidin prenese fosfatno skupino nukleozidnemu difosfatu (bodisi GDP bodisi ADP), s tem se tvori nukleozidni trifosfat (bodisi GTP bodisi ATP). Reakcijo katalizira encim sukcinilkoencim A sintetaza.[53][54][47]

Reakcija šestega koraka je reakcija oksidacije, v kateri se sukcinat (produkt petega koraka) pretvori v fumarat. Hkrati nastane tudi FADH2; na FAD se vežeta dva vodikova atoma.[13] Pretvorbo sukcinata v fumarat katalizira encim sukcinat dehidrogenaza.[55][47][13]

Za potek sedmega koraka je nujen encim fumarat hidrataza, ki katalizira nastajanje malata iz fumarata (fumarat postane substrat za adicijo vode[15]).[56] Sledi zadnja reakcija citratnega cikla, v kateri se malat oksidira v oksaloacetat (reakcijo katalizira malat dehidrogenaza[57]), nakar sledijo reakcije prvega koraka cikla. Obenem z redukcijo NAD+ nastane ena molekula NADH.[13][57][47]


Izkupiček[uredi | uredi kodo]
Glukozno molekulo, ki vstopa v reakcije glikolize, sestavlja šest ogljikovih atomov, medtem ko v Krebsov cikel vstopi acetilkoencim A, ki v svoji acetilni skupini (izvirajoči iz piruvata) vsebuje le še dva ogljikova atoma, sam cikel pa se odvije dvakrat (za vsak od dveh acetilkoencimov A). V vsakem ciklu se sprostita dve molekuli ogljikovega dioksida, tri molekule NADH, en ATP (ali GTP) in ena molekula FADH2. Nekatere vmesne produkte cikla lahko celica uporabi pri sintezi neesencialnih aminokislin.[13][43][47][58][59]
Oksidativna fosforilacija[uredi | uredi kodo]
Oksidativna fosforilacija je zadnja stopnja aerobnega celičnega dihanja, v kateri celica s pomočjo različnih reakcij pridobi energijo v obliki ATP.[60] Gre za poseben tip fosforilacije (ADP v ATP), ki je tesno povezana (sklopljena) s prenašanjem vodikovih elektronov vzdolž dihalne verige.[61] Odvija se v mitohondriju, natančneje na notranji membrani mitohondrija pri evkariontskih organizmih ali v (oziroma ob) celični membrani pri prokariontskih organizmih.[62][61] Bistveni strukturi za potek procesa oksidativne fosforilacije sta dihalna veriga (elektronska transportna veriga) in encimatski kompleks ATP-sintaza, na katerem se s fosfatom fosforilirajo molekule ADP.[60] Običajno s pojmom oksidativna fosforilacija mislimo na procesa oksido-redukcijskih reakcij (oksidacij in redukcij) dihalne verige in fosforilacije adenozina difosfata v adenozin trifosfat na ATP-sintazi.[43][63][15] Pogosto se celično dihanje poenostavljeno deli na tri glavne faze (glikolizo, Krebsov cikel in dihalno verigo), pri čemer celotno zaključno stopnjo celičnega dihanja predstavljajo kar procesi dihalne verige.[13][64][65]
Dihalna veriga[uredi | uredi kodo]
Dihalna veriga ali elektronska transportna veriga, pa tudi elektronska prenašalna veriga, je definirana kot sosledje prenašalcev elektronov, nahajajočih se v notranji membrani mitohondrija evkariontov.[66] Gre za fazo aerobnega dihanja, v kateri se porablja atmosferski kisik, ki do celice pride posredno preko dihal in obtočil ter zatem difuzijsko prehaja celično membrano. V sklopu elektronske transportne verige poteče zaporedje redoks reakcij, v katerih elektroni, ki izvirajo iz NADH ali FADH2, prehajajo od enega prenašalca do drugega, medtem ko jih na koncu prevzame kisik, ki se reducira in tvori vodno molekulo.[13][63] Prehajanje poteka v smeri močnejših oksidantov[63] (vsak naslednji kompleks ima večjo afiniteto do elektronov[15][43]), kar omogoča nemoten tok.[15] Na dihalni verigi se nahajajo štirje veliki beljakovinski kompleksi, ki prehajajo membrano (so transmembranske beljakovine), in so zadolženi za prenos elektronov. Hkrati pomembno vlogo igrata tudi ubikinon in citokrom c, ki imata podobno funkcijo, le da skrbita za transport elektronov med različnimi beljakovinskimi kompleksi dihalne verige.[66] Za elektronsko transportno verigo je značilna prisotnost protonskih črpalk, ki s svojim delovanjem (črpanjem vodikovih protonov iz matriksa v medmembranski prostor) ustvarjajo protonski gradient, ki je ključen za fosforilacijo, sklopljeno z elektronsko transportno verigo.[13] Delovanje protonskih črpalk omogoča energija, ki se sprosti pri prehajanju elektronov med posameznimi kompleksi elektronske transportne verige in vmesnimi beljakovinami.[63] Dihalna veriga se v več kopijah nahaja na notranji mitohondrijski membrani evkariontov in celični membrani prokariontov, pri čemer slednji včasih ne potrebujejo kisika, ker živijo v anaerobnih življenjskih okoljih.[13]

Kompleks I[uredi | uredi kodo]
Dihalna veriga se začne s kompleksom I (tudi NADH:ubikinon-oksidoreduktaza[15] ali NADH:akceptor oksidoreduktaza[67], krajše NADH-dehidrogenaza[15]), ki ga gradita flavinmononukleotid (FMN) (ali flavinadenidinukleotid, FAD) in beljakovina, ki vsebuje skupek železovih ter žveplovih atomov (Fe-S). Na kompleks preideta dva elektrona, ki ju do tja prenese molekula NADH. Flavinmononukleotid je molekula, ki izvira iz riboflavina (pogosto imenovanega vitamin B2), in deluje kot prostetična skupina ali kofaktor (nebeljakovinska molekula, ki je nujna za delovanje neke beljakovine[68]). Reakcijo na kompleksu I katalizira encim NADH dehidrogenaza, ki je precej velika beljakovina oksidoreduktaza s 45 verigami aminokislin. Hkrati kompleks I poskrbi za črpanje štirih vodikovih protonov preko mitohondrijske membrane iz matriksa v medmembranski prostor, kar ustvari manjši protonski gradient.[13][69]
Kompleks II[uredi | uredi kodo]
Kompleks II ali sukcinat dehidrogenaza[70] (tudi sukcinat:ubikinon-oksidoreduktaza[15]) je edini encim, ki sodeluje tako v Krebsovem ciklu kot tudi dihalni verigi.[71] Kompleks II sprejme elektrone od molekule FADH2, ki ne preide skozi kompleks I in je hkrati slabši reducent kot NADH ter ne pripomore k ustvarjanju protonskega gradienta (ni črpalka, ki bi prenesla protone iz matriksa v medmembranski prostor[72]).[63] Ključna molekula za delovanje prvega in drugega kompleksa je tudi ubikinon (CoQ, koencim Q[73]), ki prva dva kompleksa povezuje s tretjim. Gre za molekulo, ki je v svoji osnovi lipofilna (ter hidrofobna) in zaradi tega zmožna prehajati nepolarno sredico celične membrane. Na ubikinon se vežejo elektroni, ki izvirajo iz kompleksa I (nanj jih je predal NADH) in kompleksa II (nanj jih je predal FADH2). Po končani redukciji (sprejemu elektronov in sočasni pretvorbi v QH2) ubikinon poskrbi za prenos elektronov naslednjemu kompleksu elektronske transportne verige.[13]
Kompleks III[uredi | uredi kodo]
Tretji kompleks dihalne verige (tudi ubikinol:(feri)citokrom c-oksidoreduktaza, krajše citokromc-reduktaza[15]) sestavljajo citokrom b, beljakovina s skupkom žveplovih in železovih atomov in beljakovine citokroma c. Na citokrome je vezana tudi prostetična skupina, hem (podobna hemu v hemoglobinu, a v dihalna verigi skrbi za prenašanje elektronov in ne kisika). Ob sprejemanju in oddajanju elektronov je železov center beljakovine reduciran in oksidiran, zaradi česar se spremeni tudi njegovo oksidacijsko stanje: Fe++ (reducirana oblika) in Fe+++ (oksidirana oblika). Kompleks III poskrbi za črpanje vodikovih protonov skozi mitohondrijsko membrano in prenese vodikove elektrone citokromu c, ki je zadolžen za njihov transport do četrtega kompleksa dihalne verige (citokrom c elektrone prejme na kompleksu III, in sicer od ubikinona, ki je zmožen naenkrat prenašati kar dva elektrona, medtem ko citokrom c sprejme le enega naenkrat).[13]
Kompleks IV[uredi | uredi kodo]

Kompleks IV (tudi (fero)citokrom c: kisik-oksidoreduktaza, krajše citokrom c-oksidaza[15] ali citokrom oksidaza[74]) sestavljajo citokromske beljakovine c, a in a3. Tudi v tem kompleksu se nahajata dve prostetični skupini, dve molekuli hema (vsaka v enem od dveh citokromov a in a3), dodatno lahko na četrtem kompleksu najdemo bakrove ione (par CuA in en CuB v citokromu a3).[13] Ob prenosu elektronov poteče črpanje vodikovih protonov v medmembranski prostor mitohondrija.[63] Med ioni železa in bakra se nahaja kisik, ki se ob prejemu elektronov reducira, nakar iz bližnjega tekočega medija veže dva vodikova protona in tvori molekulo vode (H2O).[13] Ker je molekula kisika, ki prejme elektrone, dvoatomarna (O2), vsak od dveh kisikovih atomov veže dva vodikova protona in v procesu nastaneta dve molekuli vode.[63]
Nastajanje ATP (kemiosmoza)[uredi | uredi kodo]
Bistven del dihalne verige so protonske črpalke (te predstavljajo kompleksi I, III in IV dihalne verige[63]), ki poskrbijo za prenos vodikovih protonov iz matriksa mitohondrija v medmembranski prostor (nahajajoč se med notranjo in zunanjo mitohondrijsko membrano). Črpanje protonov v eni smeri vodi v stvaritev elektrokemičnega gradienta (tako koncentracijskega kot tudi električnega), ki temelji na pozitivnem naboju vodikovih protonov in njihovi večji koncentraciji na eni strani membrane. Če membrane ne bi bilo oziroma bi jo lahko protoni prosto prehajali, bi v skladu z difuzijskim načelom protoni prehajali v smeri mitohondrijskega matriksa (v smeri padajočega koncentracijskega gradienta).[13]
Za nastajanje molekule ATP, ki je ključni produkt celotnega procesa celičnega dihanja, je bistven prav vzpostavljen protonski gradient, ki ga izkoristi kompleks integralnih membranskih beljakovin, kompleks V ali F1F0-ATP-sintaza (poenostavljeno tudi ATP-sintaza ali ATP-sintetaza).[75][21] Beljakovinski kompleks V gradita dve podenoti; kroglasta F1 enota (kjer poteka fosforilacija molekul ADP) in protonski kanal F0 enota (integralna membranska beljakovina, ki je zadolžena za prenašanje protonov).[15][21]
Vodikovi protoni ne morejo prehajati neposredno skozi membrano in na tak način zadostiti svoji težnji po izenačitvi koncentracije na obeh straneh membrane, lahko pa potujejo skozi ATP-sintazo. Ta deluje kot nekakšen miniaturni generator, skozi katerega vodikovi protoni potujejo nazaj v matriks. Prehajanje protonov v skladu s padajočim koncentracijskim gradientom (iz medmembranskega prostora v matriks) generira potencialno energijo, ki omogoči delovanje ATP-sintaze, da ta lahko izvede vezavo fosfatne skupine na ADP (fosforilacija), pri čemer nastane molekula ATP.[13]
Opisan proces, ki se ga pogosto imenuje tudi kemiosmoza, je odgovoren za večino proizvedene kemične energije v procesu celičnega dihanja. Po nekaterih podatkih naj bi zagotovil kar 90 odstotkov molekul ATP, narejenih med aerobnim glukoznim katabolizmom (proces se namreč izvaja tudi v svetlobnih oziroma od svetlobe odvisnih reakcijah fotosinteze, kjer poteka fotofosforilacija).[13]
Energijski izkupiček celičnega dihanja[uredi | uredi kodo]
Pogosto se kot končni energijski izkupiček celičnega dihanja omenjata možnosti 38 molekul ATP in 30 – 32 molekul ATP. Pri vrednosti 38 ATP je mišljeno, da je v nastajanje ATP udeležen vsak vodikov proton, ki so ga kompleksi elektronske transportne verige s pomočjo energije, sproščene ob prehajanju elektronov, prenesli v medmembranski prostor. Vsa energija protonskega gradienta se v tem modelu porabi za poganjanje ATP-sintaze (ne uporablja se v drugih transportnih procesih). Po drugi strani vrednost 30 – 32 ATP predvideva, da se v tipični celici delež energije protonskega gradienta ne porabi za nastajanje ATP. Nekaj te energije se uporabi denimo za prenašanje drugih molekul iz medmembranskega prostora v matriks (in obratno); takšen je na primer ADP, ki mora prispeti v matriks, pa tudi ATP, ki po končanem celičnem dihanju potuje na druge celične predele, kjer poganja delovanje različnih procesov.[63]
Sklici[uredi | uredi kodo]
- ↑ 1,0 1,1 Schmidt-Rohr, K. (2020). "Oxygen Is the High-Energy Molecule Powering Complex Multicellular Life: Fundamental Corrections to Traditional Bioenergetics” ACS Omega 5: 2221-2233. http://dx.doi.org/10.1021/acsomega.9b03352
- ↑ Bailey, Regina. »Cellular Respiration«. Arhivirano iz spletišča dne 5. maja 2012.
- ↑ Schmidt-Rohr, K. (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2", J. Chem. Educ. 92: 2094-2099. http://dx.doi.org/10.1021/acs.jchemed.5b00333
- ↑ 4,0 4,1 »Termania - Slovenski medicinski slovar - cíklus«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ 5,0 5,1 »Termania - Mali leksikon biokemije in molekularne biologije - cikel trikarboksilnih kislin«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ 6,0 6,1 »Botanični terminološki slovar«. Inštitut za slovenski jezik Frana Ramovša. Pridobljeno 16. marca 2021.
- ↑ »Termania - Mali leksikon biokemije in molekularne biologije - dihalna veriga«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ »Termania - Mikrobiološki slovar - ETC«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ Dermastia, Marina etc. (2014). Kjer se življenje začne --- : [biologija celice in genetika za gimnazije]. Ljubljana: Rokus Klett. str. 106. COBISS 271282432. ISBN 978-961-271-382-9.
- ↑ Wolfe, Ernest (5. april 2017). »3 Simple Stages in Cellular Respiration and How They Work«. Medium (v angleščini). Pridobljeno 14. marca 2021.
- ↑ 11,0 11,1 11,2 11,3 »4.3 Cellular Respiration«. www.ck12.org. Pridobljeno 14. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - glikolíza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ 13,00 13,01 13,02 13,03 13,04 13,05 13,06 13,07 13,08 13,09 13,10 13,11 13,12 13,13 13,14 13,15 13,16 13,17 13,18 13,19 13,20 13,21 13,22 13,23 13,24 13,25 13,26 13,27 13,28 13,29 13,30 13,31 13,32 13,33 13,34 13,35 13,36 13,37 13,38 13,39 13,40 13,41 13,42 13,43 13,44 13,45 13,46 13,47 13,48 »Cellular Respiration | Biology for Majors I«. courses.lumenlearning.com. Pridobljeno 14. marca 2021.
- ↑ 14,00 14,01 14,02 14,03 14,04 14,05 14,06 14,07 14,08 14,09 14,10 14,11 14,12 14,13 14,14 14,15 14,16 »Glycolysis | Cellular respiration | Biology (article)«. Khan Academy (v angleščini). Pridobljeno 15. marca 2021.
- ↑ 15,00 15,01 15,02 15,03 15,04 15,05 15,06 15,07 15,08 15,09 15,10 15,11 15,12 15,13 15,14 15,15 15,16 15,17 15,18 15,19 15,20 15,21 15,22 15,23 15,24 15,25 15,26 15,27 15,28 15,29 15,30 15,31 15,32 F., Boyer, Rodney (2005). Temelji biokemije. Študentska založba. ISBN 961-242-041-6. OCLC 448300231.
- ↑ Vander Heiden, Matthew G.; Locasale, Jason W.; Swanson, Kenneth D.; Sharfi, Hadar; Heffron, Greg J.; Amador-Noguez, Daniel; Christofk, Heather R.; Wagner, Gerhard; Rabinowitz, Joshua D. (17. september 2010). »Evidence for an alternative glycolytic pathway in rapidly proliferating cells«. Science (New York, N.Y.). Zv. 329, št. 5998. str. 1492–1499. doi:10.1126/science.1188015. ISSN 1095-9203. PMC 3030121. PMID 20847263.
- ↑ »Termania - Slovenski medicinski slovar - transpórter«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - difuzíja«. www.termania.net. Pridobljeno 31. marca 2021.
- ↑ 19,0 19,1 »Termania - Slovenski medicinski slovar - piruvát«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - NADH«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 R., Pickering, W. (1996). Biologija. Tehniška založba Slovenije. ISBN 978-86-365-0190-0. OCLC 449311679.
- ↑ »Termania - Slovenski medicinski slovar - héksokináza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - izomeráza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ »Isomerase Protein | PDI Antigen | TOP1 | TPI1 | ProSpec«. www.prospecbio.com. Pridobljeno 14. marca 2021.
- ↑ International Union of Biochemistry. Nomenclature Committee; Commission on Biochemical Nomenclature (1979). Enzyme nomenclature, 1978 : recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes. New York: Academic Press. ISBN 978-0-323-14460-5. OCLC 768184190.
- ↑ »Termania - Slovenski medicinski slovar - glukóza-6-fosfát izomeráza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ 27,0 27,1 »Termania - Slovenski medicinski slovar - fósfofruktokináza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ 28,0 28,1 »Termania - Slovenski medicinski slovar - aldoláza«. www.termania.net. Pridobljeno 14. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - prenašálec«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - gliceraldehíd-3-fosfát dehidrogenáza«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - mutáza«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - fósfoglicerát mutáza«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ »Isomerization - an overview | ScienceDirect Topics«. www.sciencedirect.com. Pridobljeno 15. marca 2021.
- ↑ »Enolase - an overview | ScienceDirect Topics«. www.sciencedirect.com. Pridobljeno 15. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - enoláza«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - piruvát kináza«. www.termania.net. Pridobljeno 15. marca 2021.
- ↑ 37,0 37,1 37,2 »Glycolysis | Boundless Biology«. courses.lumenlearning.com. Pridobljeno 15. marca 2021.
- ↑ 38,0 38,1 Daroff, Robert B. (2014). Encyclopedia of the Neurological Sciences (2. izd.). Burlington: Elsevier Science. ISBN 978-0-12-385158-1. OCLC 879946913.
- ↑ »Termania - Rezultati iskanja - koencim A«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ 40,0 40,1 »Pyruvate Oxidation«. oregonstate.edu. Arhivirano iz prvotnega spletišča dne 22. februarja 2020. Pridobljeno 16. marca 2021.
- ↑ 41,0 41,1 »Pyruvate Oxidation | Protocol«. www.jove.com. Pridobljeno 16. marca 2021.
- ↑ 42,0 42,1 42,2 42,3 »1.13: Pyruvate Oxidation and the TCA Cycle«. Biology LibreTexts (v angleščini). 9. februar 2017. Pridobljeno 16. marca 2021.
- ↑ 43,0 43,1 43,2 43,3 43,4 Jezernik, Kristijan; Sterle, Maksimiljan; Omerzel Vujić, Erika; Lampe Kajtna, Mojca (2012). Celična biologija : učbenik za študente Medicinske fakultete (1. izd., 1. natis izd.). Ljubljana: DZS. ISBN 978-961-02-0286-8. OCLC 821110606.
- ↑ »Termania - Slovenski medicinski slovar - piruvát dehidrogenáza«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ Patel, Mulchand S.; Nemeria, Natalia S.; Furey, William; Jordan, Frank (13. junij 2014). »The pyruvate dehydrogenase complexes: structure-based function and regulation«. The Journal of Biological Chemistry. Zv. 289, št. 24. str. 16615–16623. doi:10.1074/jbc.R114.563148. ISSN 1083-351X. PMC 4059105. PMID 24798336.
- ↑ Wiegand, G.; Remington, S. J. (1986). »Citrate synthase: structure, control, and mechanism«. Annual Review of Biophysics and Biophysical Chemistry. Zv. 15. str. 97–117. doi:10.1146/annurev.bb.15.060186.000525. ISSN 0883-9182. PMID 3013232.
- ↑ 47,0 47,1 47,2 47,3 47,4 47,5 47,6 »The citric acid cycle | Cellular respiration (article)«. Khan Academy (v angleščini). Pridobljeno 17. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - akonitáza«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - oksoglutarát«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ »ENZYME - 1.1.1.42 Isocitrate dehydrogenase (NADP(+))«. enzyme.expasy.org. Pridobljeno 16. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - sukciníl-CoA«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - α-kétoglutarát dehidrogenáza«. www.termania.net. Pridobljeno 16. marca 2021.
- ↑ Voet, Donald (2011). Biochemistry (4. izd.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-470-57095-1. OCLC 690489261.
- ↑ Berg, Jeremy M.; Stryer, Lubert; Stryer, Lubert (2002). Biochemistry (5. izd.). New York: W.H. Freeman. ISBN 0-7167-3051-0. OCLC 48055706.
- ↑ »Termania - Slovenski medicinski slovar - sukcinát dehidrogenáza«. www.termania.net. Pridobljeno 17. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - fumarát hidratáza«. www.termania.net. Pridobljeno 17. marca 2021.
- ↑ 57,0 57,1 »Termania - Slovenski medicinski slovar - malát dehidrogenáza«. www.termania.net. Pridobljeno 17. marca 2021.
- ↑ »Krebs cycle«. flexbooks.ck12.org. Pridobljeno 18. marca 2021.
- ↑ »Kreb's Cycle«. Chemistry LibreTexts (v angleščini). 2. oktober 2013. Pridobljeno 18. marca 2021.
- ↑ 60,0 60,1 »Termania - Mali leksikon biokemije in molekularne biologije - oksidativna fosforilacija«. www.termania.net. Pridobljeno 18. marca 2021.
- ↑ 61,0 61,1 »Termania - Slovenski medicinski slovar - fosforilácija«. www.termania.net. Pridobljeno 18. marca 2021.
- ↑ »Oxidative Phosphorylation- CUSABIO«. www.cusabio.com. Pridobljeno 18. marca 2021.
- ↑ 63,0 63,1 63,2 63,3 63,4 63,5 63,6 63,7 63,8 »Oxidative phosphorylation | Biology (article)«. Khan Academy (v angleščini). Pridobljeno 18. marca 2021.
- ↑ »2.26: Cellular Respiration«. Biology LibreTexts (v angleščini). 20. september 2016. Pridobljeno 18. marca 2021.
- ↑ »Cell Respiration Definition and Phases | Online Medical Library«. The Lecturio Online Medical Library (v angleščini). 21. december 2016. Pridobljeno 18. marca 2021.
- ↑ 66,0 66,1 »Termania - Mali leksikon biokemije in molekularne biologije - dihalna veriga«. www.termania.net. Pridobljeno 18. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - NADH-dehidrogenáza«. www.termania.net. Pridobljeno 20. marca 2021.
- ↑ »Cofactor - an overview | ScienceDirect Topics«. www.sciencedirect.com. Pridobljeno 21. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - NADH:akcéptor óksidoreduktáza«. www.termania.net. Pridobljeno 19. marca 2021.
- ↑ »EC 1.3.5.1«. www.qmul.ac.uk. Pridobljeno 19. marca 2021.
- ↑ Oyedotun, Kayode S.; Lemire, Bernard D. (5. marec 2004). »The quaternary structure of the Saccharomyces cerevisiae succinate dehydrogenase. Homology modeling, cofactor docking, and molecular dynamics simulation studies«. The Journal of Biological Chemistry. Zv. 279, št. 10. str. 9424–9431. doi:10.1074/jbc.M311876200. ISSN 0021-9258. PMID 14672929.
- ↑ »ETC (Electron transport chain) Story«. www.unm.edu. Pridobljeno 20. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - ubikinón«. www.termania.net. Pridobljeno 19. marca 2021.
- ↑ »Termania - Mikrobiološki slovar - citokróm oksidáza«. www.termania.net. Pridobljeno 20. marca 2021.
- ↑ »Termania - Slovenski medicinski slovar - ATP-sintáza«. www.termania.net. Pridobljeno 19. marca 2021.