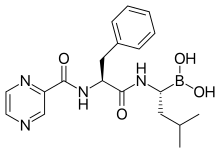
Bortezomib
 | |
 | |
| Klinični podatki | |
|---|---|
| Blagovne znamke | Velcade in druge[1] |
| Sinonimi | PS-341 |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a607007 |
| Licenčni podatki |
|
| Nosečnostna kategorija | |
| Način uporabe | subkutano, intravensko |
| Oznaka ATC | |
| Pravni status | |
| Pravni status | |
| Farmakokinetični podatki | |
| Vezava na beljakovine | 83 % |
| Presnova | jetrna (v veliki meri preko CYP) |
| Razpolovni čas | 9 do 15 h |
| Identifikatorji | |
| |
| Številka CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| PDB ligand | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.125.601 |
| Kemični in fizikalni podatki | |
| Formula | C19H25BN4O4 |
| Mol. masa | 384,24 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
Bortezomib, pod zaščitenim imenom Velcade in drugimi,[1] je protirakavo zdravilo, ki se uporablja za zdravljenje diseminiranega plazmocitoma in limfoma plaščnih celic.[2][3] Pri diseminiranem plazmocitomu se uporablja pri še nezdravljenih bolnikih kot tudi tistih, ki so bili predhodno zdravljeni z drugimi zdravili.[4] Navadno se uporablja v kombinaciji z drugimi zdravili.[4] Uporablja se parenteralno,[3] z injiciranjem.[2]
Med pogoste neželene učinke spadajo driska, slabost, utrujenost, zmanjšano število belih krvničk in/ali krvnih ploščic, vročina, občutek odrevenelosti na koži ali v okončinah, utrujenost, zadihanost, izpuščaj in bolečine v trebuhu.[2] Drugi hudi neželeni učinki, ki jih lahko povzroči bortezomib, so nizek krvni tlak, sindrom tumorske lize, srčno popuščanje in sindrom reverzibilne posteriorne levkoencefalopatije.[2][4] Spada v skupino zaviralcev proteasoma.[2] Zavira delovanje proteasomov, celičnih kompleksov, ki razgrajujejo beljakovine.[4]
Bortezomib so v ZDA odobrili leta 2003, v Evropski uniji pa leta 2004.[2][4] Uvrščen je na seznam osnovnih zdravil Svetovne zdravstvene organizacije, torej med najpomembnejša učinkovita in varna zdravila, potrebna za normalno zagotavljanje zdravstvene oskrbe.[5]
Klinična uporaba
[uredi | uredi kodo]Bortezomib se uporablja:[6]
- samostojno ali v kombinaciji s pegiliranim liposomskim doksorubicinom ali z deksametazonom pri odraslih bolnikih s diseminiranim plazmocitomom, ki so prejeli najmanj eno predhodno vrsto zdravljenja in so jim že presadili krvotvorne matične celice ali za presaditev niso primerni;
- v kombinaciji z melfalanom in prednizonom za zdravljenje odraslih bolnikov, pri katerih diseminirani plazmocitom še ni bil zdravljen in pri katerih pred presaditvijo krvotvornih matičnih celic kemoterapija v velikih odmerkih ni primerna;
- v kombinaciji z deksametazonom ali deksametazonom in talidomidom za indukcijsko zdravljenje odraslih bolnikov, pri katerih diseminirani plazmocitom še ni bil zdravljen in pri katerih je pred presaditvijo krvotvornih matičnih celic mogoča kemoterapija v velikih odmerkih;
- v kombinaciji z rituksimabom, ciklofosfamidom, doksorubicinom in prednizonom indicirano za zdravljenje odraslih bolnikov z limfomom plaščnih celic, ki še niso prejemali zdravljenja in pri katerih presaditev krvotvornih matičnih celic ni mogoča.
Neželeni učinki
[uredi | uredi kodo]Med zdravljenjem z bortezomibom se zelo pogosto pojavijo neželeni učinki na prebavila, kot so slabost, driska, bruhanje in zaprtje. Občasno so poročali tudi o primerih zapore črevesja.[6] Med pogoste neželene učinke spadajo tudi utrujenost, zmanjšano število belih krvničk in/ali krvnih ploščic, vročina, občutek odrevenelosti na koži ali v okončinah, utrujenost, zadihanost, izpuščaj in bolečine v trebuhu.[2]
Drugi hudi neželeni učinki, ki jih lahko povzroči bortezomib, so nizek krvni tlak, sindrom tumorske lize, srčno popuščanje in sindrom reverzibilne posteriorne levkoencefalopatije.[2][4]
Ob uporabi bortezomiba je veliko tveganje za reaktivacijo virusa noric oziroma za pojav pasovca,[7] vendar se z uporabo profilaktičnega protivirusnega zdravljenja (na primer z aciklovirjem) tveganje znatno zmanjša.[8]
Pojavijo se lahko neželeni učinki na očeh, kot sta halazij in hordeol (ječmenček), ki pa so pogostejši pri ženskah.[9] Poročali so tudi o primerih akutnega intersticijskega nefritisa.[10]
Mehanizem delovanja
[uredi | uredi kodo]Bortezomib je bil prvo odobreno zdravilo iz nove skupine učinkovin – zaviralcev proteasoma.[11] Zavira delovanje proteasomov, celičnih kompleksov, ki selektivno razgrajujejo beljakovine,[4] ki uravnavajo celični cikel in prepisovanje genov, zaviralne dejavnike in napačno sestavljene ali poškodovane beljakovine. Proteasomi s tem ključno prispevajo k celični homeostazi in poteku celičnega cikla, njihovo zaviranje pa povzroči spremembo v znotrajceličnih signalnih poteh ter sproži apoptozo.[12]
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 http://www.cbz.si/cbz/bazazdr2.nsf/Search?SearchView&Query=(%5BSEZNAMUCINKNAZIV%5D=_Bortezomib*)&SearchOrder=4&SearchMax=301 Centralna baza zdravil, vpogled: 25. 2. 2022.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 »Bortezomib Monograph for Professionals«. Drugs.com. Pridobljeno 13. oktobra 2019.
- ↑ 3,0 3,1 https://www.termania.net/slovarji/slovenski-medicinski-slovar/5508557/bortezomib?query=Bortezomib&SearchIn=All Slovenski medicinski e-slovar, vpogled: 25. 2. 2022.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 »Velcade«. Evropska agencija za zdravila (EMA). 17. september 2018. Pridobljeno 13. oktobra 2019.
- ↑ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Ženeva: Svetovna zdravstvena organizacija. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ 6,0 6,1 https://www.ema.europa.eu/en/documents/product-information/velcade-epar-product-information_sl.pdf Povzetek glavnih značilnosti zdravila Velcade, vpogled: 25. 2. 2022.
- ↑ Oakervee HE, Popat R, Curry N, Smith P, Morris C, Drake M, in sod. (Junij 2005). »PAD combination therapy (PS-341/bortezomib, doxorubicin and dexamethasone) for previously untreated patients with multiple myeloma«. British Journal of Haematology. 129 (6): 755–762. doi:10.1111/j.1365-2141.2005.05519.x. PMID 15953001. S2CID 34591121.
- ↑ Pour L, Adam Z, Buresova L, Krejci M, Krivanova A, Sandecka V, in sod. (april 2009). »Varicella-zoster virus prophylaxis with low-dose acyclovir in patients with multiple myeloma treated with bortezomib«. Clinical Lymphoma & Myeloma. 9 (2): 151–3. doi:10.3816/CLM.2009.n.036. PMID 19406726.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Dennis M, Maoz A, Hughes D, Sanchorawala V, Sloan JM, Sarosiek S (Marec 2019). »Bortezomib ocular toxicities: Outcomes with ketotifen«. American Journal of Hematology. 94 (3): E80–E82. doi:10.1002/ajh.25382. PMID 30575098.
- ↑ Cheungpasitporn W, Leung N, Rajkumar SV, Cornell LD, Sethi S, Angioi A, Fervenza FC (Julij 2015). »Bortezomib-induced acute interstitial nephritis«. Nephrology, Dialysis, Transplantation. 30 (7): 1225–1229. doi:10.1093/ndt/gfv222. PMID 26109684.
- ↑ Kodre, Veronika, Černelč, Peter (2008). Zdravljenje diseminiranega plazmocitoma z zdravilom bortezomib. Zdravniški vestnik, volume 77, issue 1, str. I-87-I-92.
- ↑ Pajek J. Bortezomib. V: Pajek J., Arnol M., Marn Pernat A., Aleš Rigler A., Mlinšek A., Škoberne A. Imunosupresijska zdravljenja v nefrologiji. Društvo Medicinski razgledi. Ljubljana, 2018: 117–121.
