Raltegravir
 | |
 | |
| Klinični podatki | |
|---|---|
| AHFS/Drugs.com | monograph |
| MedlinePlus | a608004 |
| Licenčni podatki |
|
| Nosečnostna kategorija |
|
| Način uporabe | peroralno |
| Oznaka ATC | |
| Pravni status | |
| Pravni status |
|
| Farmakokinetični podatki | |
| Vezava na beljakovine | 83 % |
| Presnova | jetrna (UGT1A1) |
| Razpolovni čas | 9 ur |
| Izločanje | z blatom in sečem |
| Identifikatorji | |
| |
| Številka CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| NIAID ChemDB | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.124.631 |
| Kemični in fizikalni podatki | |
| Formula | C20H21FN6O5 |
| Mol. masa | 444,42 g/mol |
| 3D model (JSmol) | |
| |
| |
Raltegravir (zaščiteno ime Isentress) je protiretrovirusna učinkovina za zdravljenje okužbe z virusom HIV.[1] Gre za prvo učinkovino iz razreda zdravil zaviralci integraze, ki je pridobila dovoljenje za promet, in sicer je zdravilo odobril ameriški Urad za prehrano in zdravila oktobra 2007.[2][3] V Evropski zvezi je zdravilo pridobilo dovoljenje decembra 2007.[4]
Decembra 2011 je v ZDA zdravilo pridobilo tudi dovoljenje za uporabo pri otrocih in mladostnikih, starih 2 do 18 let. Zdravilo se daje dvakrat dnevno v kombinaciji s še dvema protiretrovirusnima zdraviloma; tritirna kombinacija je značilna za večino protiretrovirusnih zdravil za zdravljenje HIV-a. Za otroke do 11 leta starosti je na voljo tudi zdravilo v obliki žvečljive tablete.[5]
Mehanizem delovanja
[uredi | uredi kodo]Raltegravir deluje na encim integrazo, ki omogoča virusu HIV, da se virusni dedni material vgradi v kromosome človeškega genoma, kar je pomemben korak v patogenezi okžbe s HIV-om. Učinkovina se presnovi tako, da poteče glukuronidacija.[6]
Odmerjanje
[uredi | uredi kodo]
Raltegravir se daje dvakrat dnevno.[3] V študijah so ovrednotili odmerke 200, 400 in 600 mg.
Za odrasle je priporočeni odmerek zdravila 400 mg dvakrat na dan.[7]
Indikacije
[uredi | uredi kodo]Raltegravir je bil sprva namenjen le za bolnike z okužbo z virusom HIV, pri katerih je prišlo do odpornosti proti drugim protiretrovirusnim zdravilom.[3] Kasneje je dobilo zdravilo dovoljenje za uporabo pri vseh bolnikih.[8]
Učinkovitost
[uredi | uredi kodo]V študiji je raltegravir v kombinaciji z drugimi protiretrovirusnimi učinkovinami izkazal močno in trajno protiretrovirusno učinkovitost, podobno kot efavirenz, s tem da je prišlo do znižanja virusnega bremena pod mejo zaznavnosti hitreje pri raltegravirju. Po 24 in 48 tednih raltegravir ni povzročil povišanih vrednosti celokupnega holesterola, LDL-holesterola ali trigliceridov.[9][10]
Prenašanje
[uredi | uredi kodo]Raltegravir so bolniki v študiji načeloma dobro prenašali.[11] Med pogostimi neželenimi učinki se pojavljajo zmanjšanje teka, težave s spanjem, nenormalne sanje, nočne more, omotica, glavobol, vrtoglavica, napenjanje, bolečine v trebuhu, driska, nabiranje plinov v želodcu ali črevesu, siljenje na bruhanje, bruhanje, izpuščaj (pogosteje pri jemanju skupaj z darunavirjem), utrujenost, neobičajna izčrpanost ali oslabelost, zvišana telesna temperatura, zvišane vrednosti jetrnih testov v krvi, nenormalne bele krvne celice, zvišana koncentracija maščob v krvi, zvišane vrednosti encimov iz žlez slinavk ali trebušne slinavke.[7]
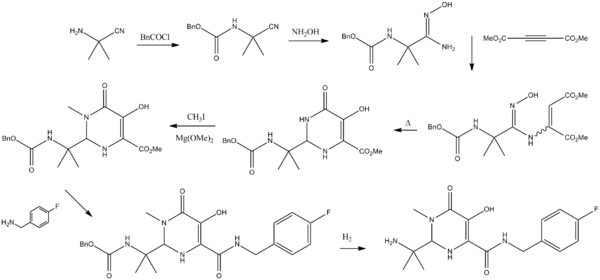
Sinteza
[uredi | uredi kodo]Viri
[uredi | uredi kodo]- ↑ Savarino A (2006). »A historical sketch of the discovery and development of HIV-1 integrase inhibitors«. Expert Opin Investig Drugs. 15 (12): 1507–1522. doi:10.1517/13543784.15.12.1507. PMID 17107277.
- ↑ »FDA approval of Isentress (raltegravir)«. Urad za prehrano in zdravila (FDA). 25. junij 2009. Pridobljeno 15. novembra 2009.
- ↑ 3,0 3,1 3,2 »Isentress Drug Approval Package«. Urad za prehrano in zdravila (FDA). 22. februar 2008. Pridobljeno 15. novembra 2009.
- ↑ http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000860/human_med_000859.jsp&mid=WC0b01ac058001d124 Arhivirano 2014-04-23 na Wayback Machine., vpogled: 2. 5. 2012.
- ↑ http://www.everydayhealth.com/hiv-aids/1222/fda-okays-raltegravir-for-kids-teens-with-hiv.aspx?xid=aol_eh-hiv_6_20111219_&aolcat=HLT&icid=maing-grid7%7Cmain5%7Cdl10%7Csec3_lnk2%26pLid%3D122480
- ↑ HIV Antiretroviral Agents in Development
- ↑ 7,0 7,1 http://www.ema.europa.eu/docs/sl_SI/document_library/EPAR_-_Product_Information/human/000860/WC500037405.pdf Arhivirano 2012-05-17 na Wayback Machine., Povzetek glavnih značilnosti zdravila Isentress, vpogled: 2. 5. 2012.
- ↑ »UPDATE 2-FDA OKs widened use of Merck's Isentress HIV drug«. Reuters. 10. julij 2009.
- ↑ Markowitz M; Nguyen BY; Gotuzzo E; in sod. (2007). »Rapid and durable antiretroviral effect of the HIV-1 Integrase inhibitor raltegravir as part of combination therapy in treatment-naive patients with HIV-1 infection: results of a 48-week controlled study«. J. Acquir. Immune Defic. Syndr. 46 (2): 125–133. doi:10.1097/QAI.0b013e318157131c. PMID 17721395. Arhivirano iz prvotnega spletišča dne 9. februarja 2012. Pridobljeno 2. maja 2012.
- ↑ Stephenson J (2007). »Researchers buoyed by novel HIV drugs: will expand drug arsenal against resistant virus«. JAMA. 297 (14): 1535–1536. doi:10.1001/jama.297.14.1535. PMID 17426263.
- ↑ Croxtall JD; Keam SJ. (2009). »Raltegravir«. Drugs. 69 (8): 1059. doi:10.2165/00003495-200969080-00007. PMID 19496631. Arhivirano iz prvotnega spletišča dne 8. oktobra 2011. Pridobljeno 2. maja 2012.
- ↑ Belyk, K. M.; Morrison, H. G.; Jones, P.; Summa, V.; 2007, WO 2006060730