Svinčev(IV) oksid
Svinčev(IV) oksid ali svinčev dioksid je anorganska spojina s formulo PbO2.[1] Je temno rjav do črn prah, netopen v vodi.[2] Ima dve kristalni obliki in več pomembnih aplikacij v elektrokemiji, zlasti kot pozitivna plošča kislega svinčevega akumulatorja.
Lastnosti[uredi | uredi kodo]
Fizikalne lastnosti[uredi | uredi kodo]

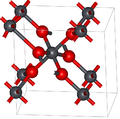
Svinčev(IV) oksid ima dva glavna polimorfa, α- in β-, ki se v naravi pojavljata v redkih mineralih skrutinitu oziroma platneritu. Platnerit so prepoznali že leta 1845,[3] skrutinit pa šele leta 1946. V naravi so ga našli leta 1988.[4]
α- oblika ima ortorombsko simetrijo, prostorsko skupino Pbcn (No. 60),Pearsonov simbol oP12 in mrežne konstante a = 0,497 nm, b = 0,596 nm, c = 0,544 nm, Z = 4 (štiri molekule v osnovni celici).[4] Svinčevi atomi imajo koordinacijo 6.
β- oblika tvori tetragonalne kristale s prostorsko skupino P42/mnm (No. 136), Pearsonovim simbolom tP6, mrežnima konstantama a = 0,491 nm, c = 0,3385 nm in Z = 2.[5] Struktura je sorodna strukturi rutila, v kateri si stebrički oktaedrov delijo nasprotne robove in so na vogalih povezani z drugimi verigami. V α- obliki so oktaedri povezani s sosednjimi robovi, da nastanejo cik-cak verige.[4]
Kemijske lastnosti[uredi | uredi kodo]
Svinčev(IV) oksid med segrevanjem na zraku razpade:
- 24 PbO2 → 2 Pb12O19 + 5 O2
- Pb12O19 → Pb12O17 + O2
- 2 Pb12O17 → 8 Pb3O4 + O2
- 2 Pb3O4 → 6 PbO + O2
Stehiometrijo končnega produkta se lahko nadzira s temperaturo:
- PbO2 Pb12O19 Pb12O17 Pb3O4 PbO
Termični razpad svinčevega(IV) oksida je običajen postopek za proizvodnjo različnih svinčevih oksidov.[6]
Svinčev(IV) oksid je amfoteren s prevladujočimi kislimi lastnostmi. Raztaplja se v močnih bazah in tvori hidroksiplumbatni ion [Pb(OH)6]2−:[2]
- PbO2 + 2 NaOH + 2 H2O → Na2[Pb(OH)6]
Reagira tudi z raztaljenimi bazičnimi oksidi in tvori ortoplumbate M4[PbO4].
Zaradi nestabilnosti Pb4+ kationa reagira z vročimi kislinami in prehaja v bolj stabilni Pb2+ kation, pri čemer se sprošča kisik:[6]
- 2 PbO2 + 2 H2SO4 → 2 PbSO4 + 2 H2O + O2
- 2 PbO2 + 4 HNO3 → 2 Pb(NO3)2 + 2 H2O + O2
- PbO2 + 4 HCl → PbCl2 + 2 H2O + Cl2
Reakcije so počasne.
Svinčev(IV) oksid je dober oksidant, na primer v naslednjih reakcijah:[7]
- 2 MnSO4 + 5 PbO2 + 6 HNO3 → 2 HMnO4 + 2 PbSO4 + 3 Pb(NO3)2 + 2 H2O
- 2 Cr(OH)3 + 10 KOH + 3 PbO2 → 2 K2CrO4 + 3 K2PbO2 + 8 H2O
Elektrokemijske lastnosti[uredi | uredi kodo]
Uradna kemijska formula svinčevega(IV) oksida je PbO2, dejanska pa PbO1,9-1,98 in je odvisna od načina priprave. Primanjkljaj kisika (ali prebitek svinca) se kaže v njegovi značilni kovinski električni prevodnosti oziroma specifični upornosti 10−4 Ω•cm, ki se izkorišča v več elektrokemijskih aplikacijah. Podobno kot kovine ima tudi svinčev dioksid značilen elektrodni potencial in se v elektrolitu lahko anodno ali katodno polarizira. Elektrode iz svinčevega dioksida imajo dvojno delovanje, se pravi da so v elektrokemijskih reakcijah udelženi svinčevi in kisikovi ioni.[8]
Proizvodnja[uredi | uredi kodo]
Kemični procesi[uredi | uredi kodo]
Svinčev dioksid se industrijsko proizvaja po več postopkih, ki vključujejo oksidacijo rdečega svinca (Pb3O4) v alkalnem rdečem blatu v klorovi atmosferi[6] in reakcijo svinčevega(II) acetata s "klorovim apnom" (kalcijev hipoklorit).[9][10]
PbO2 nastane tudi v reakciji Pb3O4 z dušikovo kislino:
- Pb3O4 + 4 HNO3 → PbO2 + 2 Pb(NO3)2 + 2 H2O
PbO2 reagira z natrijevim hidroksidom in tvori heksahidroksoplumbatne(IV) ione [Pb(OH)6]2−, topne v vodi.
Elektroliza[uredi | uredi kodo]
Alternativni postopek za sintezo svinčevega(IV) oksida je elektroliza: PbO2 nastaja na elektrodi iz čistega svinca, če je anodno polarizirana na elektrodni potencial okoli 1,5 V pri sobni temperaturi. Postopek se uporablja za masovno industrijsko proizvodno PbO2 anod. Svinčena in bakrena elektroda se potopita v raztopino H2SO4 s pretokom 5-10 L/min in za približno 30 minut izpostavita električnemu toku z gostoto okoli 100 A/m2. Pomanjkljivost svinčene elektrode je njena mehkost, predvsem v primerjavi s trdim in krhkim PbO2, ki ima Mohsovo trdoto 5,5.[11] Posledica različnih mehanskih lastnosti je luščenje obloge PbO2. Problem je rešljiv z uporabo tršega nosilca za odlaganje PbO2, na primer titana, niobija, tantala ali grafita v stoječi ali tekoči dušikovi kislini. Nosilec se pred uporabo običajno peska, s čimer se s površine odstranijo oksidi, površina pa postane bolj groba in bolj oprijemljiva za prevleko.[12]
Uporaba[uredi | uredi kodo]
Svinčev dioksid se uporablja za proizvodnjo vžigalic, pirotehničnih izdelkov, barvil in utrjevanju sulfidnih polimerov. Uporablja se tudi za proizvodnjo visokonapetostnih odvodnikov strele.[6]
V elektrokemiji se uporablja za izdelavoi anod. Za ta namen je bolj uporaben β-PbO2, ker ima relativno nizko električno upornost, dobro odpornost proti koroziji tudi v medijih z nizkim pH in visoko prenapetost za razvoj kisika v elektrolitih na osnovi žveplove in dušikove kisline. Svinčev dioksid prenese tudi razvijanje klora v klorovodikovi kislini. Anode iz svinčevega dioksida so poceni in so se nekoč uporabljale namesto običajnih elektrod iz platine in grafita za regeneracijo kalijevega dikromata. Uporabljali so jih tudi kot kisikove anode za galvanizacijo bakra in cinka v sulfatnih kopelih. V organskih sintezah so se anode iz svinčevega dioksida uporabljale za proizvodnjo glioksilne kisline iz oksalne kisline v elektrolitu iz žveplove kisline.[12]
Najpomembnejša raba svinčevega dioksida so katode svinčevega akumulatorja. Njegova uporabnost izhaja iz anomalne kovinske prevodnosti PbO2. Svinčav akumulator shranjuje in sprošča električno energijo s premikanjem ravnotežja (komproporcionacija) med kovinskim svincem, svinčevim dioksidom in svinčevimi(II) solmi v žveplovi kislini:
- Pb + PbO2 + 2 HSO4− + 2 H+ → 2 PbSO4 + 2 H2O; E° = +2,05 V
Varnost[uredi | uredi kodo]
Svinčeve spojine so strupene.[13]
Sklici[uredi | uredi kodo]
- ↑ Meek, Terry L.; Garner, Leah D. (1. februar 2005). "Electronegativity and the Bond Triangle". Journal of Chemical Education. 82 (2): 325. doi: 10.1021/ed082p325. ISSN 0021-9584.
- ↑ 2,0 2,1 Eagleson, Mary (1994). Concise Encyclopedia of Chemistry. Walter de Gruyter. str. 590. ISBN 978-3-11-011451-5.
- ↑ Haidinger, W. (1845). Zweite Klasse: Geogenide. II. Ordnung. Baryte VII. Bleibaryt. Plattnerit. Handbuch der Bestimmenden Mineralogie (PDF) (nemščina). Vienna: Braumüller & Seidel. str. 500.
- ↑ 4,0 4,1 4,2 Taggard, J.E., Jr.; et al. (1988). "Scrutinyite, natural occurrence of α-PbO2 from Bingham, New Mexico, U.S.A., and Mapimi, Mexico" (PDF). Canadian Mineralogist. 26: 905.
- ↑ Harada, H.; Sasa, Y.; Uda, M. (1981). "Crystal data for β-PbO2" (PDF). Journal of Applied Crystallography. 14 (2): 141. doi: 10.1107/S0021889881008959.
- ↑ 6,0 6,1 6,2 6,3 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. str. 386. ISBN 978-0-08-037941-8.
- ↑ Kumar De, Anil (2007). A Textbook of Inorganic Chemistry. New Age International. st. 387. ISBN 978-81-224-1384-7.
- ↑ Barak, M. (1980). Electrochemical power sources: primary and secondary batteries. IET. str. 184 ff. ISBN 978-0-906048-26-9.
- ↑ M. Baulder (1963). "Lead(IV) Oxide". V G. Brauer (ur.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. 1. NY,NY: Academic Press. str. 758.
- ↑ Wiberg, Nils (2007). Lehrbuch der Anorganischen Chemie (nemško). Berlin: de Gruyter. str. 919. ISBN 978-3-11-017770-1.
- ↑ "Plattnerite: Plattnerite mineral information and data". www.mindat.org. Pridobljeno 12. aprila 2018.
- ↑ 12,0 12,1 François Cardarelli (2008). Materials Handbook: A Concise Desktop Reference. Springer. str. 574. ISBN 978-1-84628-668-1.
- ↑ "Lead Dioxide". hazard.com. Pridobljeno 12. aprika 2018.



![{\displaystyle {\ce {->[{\text{293 °C}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d41a6e5e7456402468f8e3f0cb5d423456507594)
![{\displaystyle {\ce {->[{\text{351 °C}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a73b41efe81b44a230f520ba9cdaf70fc0a67352)
![{\displaystyle {\ce {->[{\text{374 °C}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5327ecbdb3c6cb878fe168b9116a7ed8a8a1545f)
![{\displaystyle {\ce {->[{\text{605 °C}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9cf9a466b21692b5cb9711e564158aa970a6bc4a)