Kalijev sulfat
 Arkanit
| |
| |
| Imena | |
|---|---|
| Druga imena
arkanit (mineral)
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.029.013 |
| Število E | E515(i) (sredstva za uravnavanje Ph, ...) |
| KEGG | |
PubChem CID
|
|
| RTECS število |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| K2SO4 | |
| Molska masa | 174,259 g/mol |
| Videz | bela trdnina |
| Vonj | brez vonja |
| Gostota | 2,66 g/cm3[1] |
| Tališče | 1.069 °C (1.956 °F; 1.342 K) |
| Vrelišče | 1.689 °C (3.072 °F; 1.962 K) |
| 111 g/L (20 °C) 120 g/L (25 °C) 240 g/L (100 °C) | |
| Topnost | rahlo topen v glicerolu, netopen v acetonu, etanolu, CS2 |
| Magnetna občutljivost | -67.0·10−6 cm3/mol |
| Lomni količnik (nD) | 1,495 |
| Struktura | |
| Kristalna struktura | ortorombska |
| Nevarnosti | |
| Glavne nevarnosti | dražilen |
| Varnostni list | External MSDS |
| R-stavki (zastarelo) | R22 |
| S-stavki (zastarelo) | S36 |
| Plamenišče | ni vnetljiv |
| Smrtni odmerek ali koncentracija (LD, LC): | |
LD50 (srednji odmerek)
|
6600 mg/kg (oralno, podgana)[2] |
| Sorodne snovi | |
| Drugi anioni | kalijev selenat kalijev telurat |
| Drugi kationi | litijev sulfat natrijev sulfat rubidijev sulfat cezijev sulfat |
| Sorodne snovi | kalijev hidrogen sulfat kalijev sulfit kalijev bisulfit kalijev persulfat |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Kalijev sulfat je anorganska spojina s kemijsko formulo K2SO4. Je bela, v vodi topna trdnina. Uporablja se kot mineralno gnojilo, ki vsebuje kalij in žveplo.
Zgodovina
[uredi | uredi kodo]Kalijev sulfat je znan od zgodnjega 14. stoletja. Preučevali so ga Glauber, Boyle in Tahenius. V 17. stoletju so ga imenovali arcanuni ali sal duplicatum (dvojna sol), ker je bil spojina kisle in alkalne soli. Znan je bil tudi kot vitriolski tartar in Glaserjeva sol (sal polychrestum Glaseri) po farmacevtskem kemiku Christopherju Glaserju, ki ga je pripravil in uporabljal v medicini.[3][4]
V predmoderni medicini je bil znan kot arcanum duplicatum ali panacea duplicata. Pripravljel se je iz preostanka (caput mortuum) pri pripravi aqua fortis (dušikova kislina). Preostanek se je raztopil v vroči vodi, prefiltriral, delno izparil in pustil, da je skristaliziral. Uporabljal se je kot diuretik in sredstvo za znojenje.[5]
Po Chambers's Cyclopedia je recept za petsto tolarjev kupil Charles Frederick, vojvoda Holstein-Gottorpski. Vojvodov osebni zdravnik Schröder je opisal njegovo čudežno učinkovitost v hipohondričnih primerih, stalnih in občasnih vročicah, kamnih, skorbutu in drugih težavah.[5]
Naravni viri
[uredi | uredi kodo]Mineralna oblika kalijevega sulfata, arkanit, je relativno redka. Naravni vir kalijevega sulfata so minerali, ki so v obilju pristni v Stassfurtovi soli. V soli so sokristalizirani kalijev, magnezijev, kalcijev in natrijev sulfat.
Pomembni minerali so:
- kainit, MgSO4•KCl•H2O
- schönit (zdaj znan kot pikromerit), K2SO4•MgSO4•6H2O
- leonit, K2SO4•MgSO4•4H2O
- langbeinit, K2Mg2(SO4)3
- aftitalit (v preteklosti znan kot glaserit), K3Na(SO4)2
- polihalit, K2SO4•MgSO4•2CaSO4•2H2O
Kalijev sulfat se lahko izloči iz nekaterih omenjenih mineralov, na primer kainita, ker je ustrezna sol manj topna v vodi.
kalijev sulfat se lahko proizvede z reakcijo kizerita (MgSO4•H2O) s kalijevim kloridom (KCl).
Proizvodnja
[uredi | uredi kodo]Svetovna proizvodnja kalijevega sulfata je leta 2018 znašala okoli 1,5 milijona ton, [6] večinoma iz kalijevega klorida in žveplove kisline. Proces je analogen mannheimskemu postopku za proizvodnjo natrijevega sulfata.[7] V procesu nastane najprej kalijev hidrogensulfat (KHSO4). Reakcija je eksotermna in poteka pri sobni temperaturi:
- KCl + H2SO4 → HCl + KHSO4
Druga stopnja procesa je endotermna in zahteva dovajanje energije:
- KCl + KHSO4 → HCl + K2SO4
Struktura in lastnosti
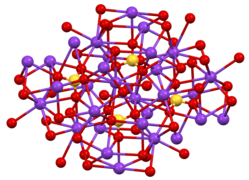
[uredi | uredi kodo]Znani sta dve kristalni obliki kalijevega sulfata. Najpogostejši je ortorombski β-K2SO4, ki pri temperaturah nad 583 °C preide v α-K2SO4.[7] Struktura je zapletena, čeprav ima sulfat značilno tetraedrično geometrijo.[8]
-
Struktura β-K2SO4.
-
Koordinacijska sfera enega od dveh tipov mesta K+
-
Sfera SO4 v β-K2SO4
Kalijev sulfat za razliko od natrijevega sulfata ne tvori hidrata. Sol kristalizira v obliki dvojnih šeststranih piramid, klasificiranih kot rombske. Sol je prozorna, zelo trda in grenkega slanega okusa. Topna je v vodi, netopna pa v raztopinah kalijevega hidroksida (KOH) in absolutnem etanolu.
Raba
[uredi | uredi kodo]Največ kalijevega sulfata se porabi kot mineralno gnojilo. Gnojilo ne vsebuje klorida, ki je lahko škodljiv za nekatere kulture. Uporablja se predvsem za gnojenje tobaka in nekaterih vrst sadnega drevja in zelenjave. Kalijev sulfat potrebujejo za optimalno rast tudi manj občutljive kulture, če zemlja akumulira kloride iz vode za namakanje.[9]
Včasih se uporablja kot nadomestek za kuhinjsko sol.[10]
Tehnični kalijev sulfat se včasih uporablja tudi v proizvodnji stekla in sredstvo za zmanjševanje bliska v eksplozivih za topovske granate. Dodatek zmanjša plamen iz ustja cevi in bleščanje in preprečuje prevelik eksplozijski tlak.
Včasih se uporablja za peskanje, ker je trši od natrijevega karbonata in natrijevega bikarbonata in podobno topen v vodi.[11]
Kalijev sulfat vijolično obarva plamen.
Reakcije
[uredi | uredi kodo]Reakcija z žveplovo kislino
[uredi | uredi kodo]Kalijev sulfat v reakciji z žveplovo kislino tvori kalijev hidrogensulfat (KHSO4). Produkt tvori rombske piramide s tališčem 197 °C. V raztopinah se obnaša kot raztopina reaktantov, iz katerih je nastal (K2SO4 in H2SO4,). V prebitku etanola se obarja kot sulfat z nekaj hidrogen sulfata, kislina pa ostane v razopini.
Podobno se obnaša brezvodna tudi sol, ki se segreje na nekaj sto stopinj. S silikati, titanati itd. deluje enako kot žveplova kislina, segreta nad temperaturo vrelišča. Zaradi te lastnosti se v analitični kemiji uporablja kot sredstvo za razklop.
Sklici
[uredi | uredi kodo]- ↑ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ↑ Chambers, Michael. »ChemIDplus - 7778-80-5 - OTYBMLCTZGSZBG-UHFFFAOYSA-L - Potassium sulfate [USAN:JAN] - Similar structures search, synonyms, formulas, resource links, and other chemical information«. chem.sis.nlm.nih.gov.
- ↑ De Milt, Clara (1942). "Christopher Glaser". Journal of Chemical Education. 19 (2): 53. doi: 10.1021/ed019p53.
- ↑ Klooster, van (1959). "Three centuries of Rochelle salt". Journal of Chemical Education. 36 (7): 314. doi: 10.1021/ed036p314.
- ↑ 5,0 5,1 Chambers, Ephraim, ur. (1728). Arcanum duplicatum. Cyclopædia, or an Universal Dictionary of Arts and Sciences. 1 (1. izdaja). James and John Knapton, in drugi. str. *125.
- ↑ Potassium sulphate, production (tonnes) - for all countries Arhivirano 2019-03-26 na Wayback Machine.. Pridobljeno 26. marca 2019.
- ↑ 7,0 7,1 H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). Potassium Compounds. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi: 10.1002/14356007.a22_039.
- ↑ Gaultier, M.; Pannetier, G. "Structure cristalline de la forme 'basse temperature' du sulfate de potassium K2SO4-beta". Bulletin de la Societe Chimique de France 1 (1968): 105-112.
- ↑ United Nations industrial development, UNIDO, International Fertilizer Development Center, IFDC (1998). Fertilizer manual (3rd ed.). Dordrecht: Kluwer academic publ. str. 615. ISBN 978-0-7923-5032-3.
- ↑ Compound Summary for CID 24507 - Potassium Sulfate. PubChem.
- ↑ Super K (Potassium Sulphate) Arhivirano 2019-03-27 na Wayback Machine.. Pridobljeno 7. decembra 2014.