Natrijev oksid
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
natrijev oksid
| |||
| Druga imena
dinatrijev oksid
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ECHA InfoCard | 100.013.827 | ||
| EC število |
| ||
PubChem CID
|
|||
| UN število | 1825 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| Na2O | |||
| Molska masa | 61,98 g·mol−1 | ||
| Videz | bela trdnina | ||
| Gostota | 2,27 g/cm3 | ||
| Tališče | 1.132 °C (2.070 °F; 1.405 K) | ||
| Vrelišče | 1.950 °C (3.540 °F; 2.220 K) | ||
| Sublimacijske okoliščine | sublimira pri 1275 °C | ||
| burno reagira in tvori NaOH | |||
| Topnost | reagira z etanolom | ||
| Struktura | |||
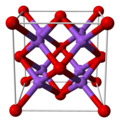
| Kristalna struktura | kubična (antifluoritna), ploskovno centrirana kocka, Pearsonov simbol: cF12 | ||
| Prostorska skupina | Fm3m, No. 225 | ||
| Koordinacijska geometrija |
tetraedrična (Na+); kubična (O2−) | ||
| Termokemija | |||
| Specifična toplota, C | 72,95 J/mol·K | ||
| Standardna molarna entropija S |
73 J/mol·K[1] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
-416 kJ/mol[1] | ||
Gibbsova prosta energija (ΔfG˚)
|
-377,1 kJ/mol | ||
| Nevarnosti | |||
| Glavne nevarnosti | jedek, burno reagira z vodo | ||
| GHS piktogrami |  [2] [2]
| ||
| H314[2] | |||
| P280[2] | |||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | ni vnetljiv | ||
| Sorodne snovi | |||
| Drugi anioni | natrijev sulfid natrijev selenid natrijev telurid | ||
| Drugi kationi | litijev oksid kalijev oksid rubidijev oksid cezijev oksid | ||
| Sorodno natrijevi oksidi | natrijev peroksid natrijev superoksid | ||
| Sorodne snovi | natrijev hidroksid | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Natrijev oksid ali dinatrijev oksid je kemijska spojina s formulo Na2O. Uporablja se v industriji stekla in keramike, vendar ne kot tak. Spojina je bazični anhidrid natrijevega hidroksida, zato pri raztapljanju v vodi tvori natrijev hidroksid:
- Na2O + H2O → 2 NaOH
Alkalni kovinski oksidi s splošno formulo M2O, v katerih je M lahko litij, natrij, kalij ali rubidij, imajo antifluoritno kristalno strukturo. To pomeni, da so položaji anionov in kationov v primerjavi s CaF2 (fluorit) zamenjani: natrijev kation je tetraedrično koordiniran s štirimi kisikovimi anioni, kisik pa kubično koordiniran z osmimi natrijevimi ioni.[3][4]
Sinteza
[uredi | uredi kodo]Natrijev oksid se pripravlja z reakcijami natrija z natrijevim hidroksidom, natrijevim peroksidom ali natrijevim nitritom:[5]
- 2 NaOH + 2 Na → 2 Na2O + H2
- Na2O2 + 2 Na → 2 Na2O
- 2 NaNO2 + 6 Na → 4 Na2O + N2
Reakcije so redukcije natrijevih spojin z natrijem.
Med zgorevanjem natrija na zraku nastane Na2O s približno 20 % Na2O2:
- 6 Na + 2 O2 → 2 Na2O + Na2O2
Na2O nastaja tudi med segrevanjem natrijevega karbonata (Na2CO3) pri 851 °C:
- Na2CO3 → Na2O + CO2
Natrijev askorbat pri 208 °C razpade na derivate furana in natrijev oksid: [6]
Uporaba
[uredi | uredi kodo]Proizvodnja stekla
[uredi | uredi kodo]
Natrijev oksid je pomembna komponenta natrijevega (okenskega) stekla, v katero se dodaja kot soda (natrijev karbonat). Natrijev oksid v steklu ni prisoten kot tak, ker je steklo kompleksen zamrežen polimer. Tipična natrijeva stekla vsebujejo približno 15 % Na2O, 70 % kremena (silicijev dioksid, SiO2) in 9 % kalcijevega oksida (CaO). Soda služi kot talilo, ki znižuje temperaturo tališča silicijevega dioksida. Natrijevo steklo ima mnogo nižje tališče od čistega silicijevega dioksida in nekoliko večjo elastičnost. Tališče se zniža zaradi reakcije sode s kremenom, v kateri nastanejo natrijevi silikati s splošno formulo Na2[SiO2]x[SiO3]:
- Na2CO3 → Na2O + CO2
- Na2O + SiO2 → Na2SiO3
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 Zumdahl, Steven S. (2009). Chemical Principles, 6. izdaja. Houghton Mifflin Company. str. A23. ISBN 0-618-94690-X.
- ↑ 2,0 2,1 2,2 Sigma-Aldrich Co., Sodium oxide. Pridobljeno 2014-05-25.
- ↑ E. Zintl, A. Harder, B. Dauth (1934). Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums. Z. Elektrochem. Angew. Phys. Chem. 40: 588–593.
- ↑ A.F. Wells (1984). Structural Inorganic Chemistry (5 izd.). Oxford: Clarendon Press. COBISS 621359. ISBN 0-19-855370-6.
- ↑ N.N. Greenwood, A. Earnshaw (1997). Chemistry of the Elements (2. izdaja). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Sodium L-ascorbate. Pridobljeno 11. maja 2015.