Zaviralec kinaze tarče rapamicina pri sesalcih

Zaviralci kinaze tarče rapamicina pri sesalcih, zaviralci mTOR ali zaviralci mTOR-kinaze[1] so skupina učinkovin, ki zavirajo kinazo mTOR (kinazo tarče rapamicina pri sesalcih) − gre za serin/treonin kinazo, ki spada v družino tako imenovanih PI3K sorodnih kinaz. Kinaza mTOR uravnava celično presnovo, rast in proliferacijo. Najbolj znani predstavniki zaviralcev mTOR so rapalogi (rapamicin oziroma sirolimus in njegovi analogi, na primer everolimus, temsirolimus[1]), ki so v kliničnih raziskavah izkazali protitumorsko delovanje pri različnih vrstah raka.[2]
Zgodovina
[uredi | uredi kodo]Kinazo mTOR so odkrili leta 1994, kot rezultat raziskovanja mehanizma delovanja rapamicina (sirolimusa).[3][4] Rapamicin so odkrili leta 1975 v prsti z Velikonočnega otoka v južnem Tihem oceanu. Velikonočni otok se imenuje tudi Rapa Nui, iz česar je izpeljano ime rapamicin.[5] Rapamicin je makrolid, ki ga proizvaja mikroorganizem Streptomyces hygroscopicus ter izkazuje protiglivno delovanje. Kmalu po njegovem odkritju so ugotovili, da deluje tudi imunosupresivno (zavira delovanje imunskega sistema) in kasneje so ga začeli klinično uporabljati kot zaviralca imunskega sistema. V 80-ih letih dvajsetega stoletja so ugotovili, da deluje tudi proti rakavim celicam, vendar mehanizem protirakavega delovanja je nekaj časa ostal nepojasnjen.[3][6][7]
V 90-ih letih je prišlo zaradi preučevanja njegovega mehanizma delovanja in odkritja biološke tarče (kinaze mTOR) do znatnega premika v razumevanje tega področja.[5] Ugotovili so, da rapamicin zavira celično proliferacijo in napredovanja celičnega cikla. Raziskovanje zaviranja kinaze mTOR je pridobilo znaten pomen v znanosti ter obrodilo obetavne rezultate.[8]
Razvoj zaviralcev mTOR
[uredi | uredi kodo]Od odkritja kinaze mTOR je bilo v to področje usmerjenih veliko raziskav z namenom preučitve bioloških učinkov rapamicina in njegovih analogov.[9][10] Vendar pa so bili rezultati kliničnih raziskav bolj presenetljivi, kot so pričakovali, kar je vplivalo na potek razvoja.[9]
Rapamicin so sprva razvili kot protiglivno učnikovino proti okužbam z glivnimi mikroorganizmi Candida albicans, Aspergillus fumigatus in Cryptococcus neoformans.[6] Čez nekaj let so ugotovili, da rapamicin deluje imunosupresivno in v ta namen so ga začeli uporabljati za preprečevanje zavrnitvenih reakcij po presaditvah organov. Na osnovi izsledkov kliničnih raziskav je rapamicin poleg ciklosporina A postal glavno zdravilo na področju preprečevanja zavrnitev presajenih organov.[3] Sočasna uporaba rapamicina in ciklosporina A je omogočila, da so uporabljeni odmerki slednjega manjši, s čimer so se zmanjšali tudi njegovi neželeni učinki.[6]
V 80-ih letih prejšnjega stoletja so sledile ugotovitve, da ima rapamicin protirakavo delovanje, in sicer da njegovo delovanje ni citotoksično, vendar da deluje citostatično na več vrst raka pri človeku.[6] Razvoj zaviralcev mTOR v zdravljenju raka so v tistih časih omejevale neugodne farmakokinetične lastnosti rapamicina.[4] Kasneje so ugotovili, da je rapamicin učinkovit tudi pri preprečevanju ponovitve stenoze venčnih arterij ter pri zdravljenju nevrodegenerativnih bolezni.[6]
Zaviralci mTOR prve generacije
[uredi | uredi kodo]Razvoj rapamicina kot protirakavega zdravila je ponovno dobil zagon v 90-ih letih dvajsetega stoletja z odkritjem temsirolimusa, novega topnega derivata rapamicina, ki je v poskusih na živalih izkazal ugoden varnostni profil. Kasneje so razvili še več protirakavih učinkovin na osnovi rapamicina.[6] Med kasnejše derivate rapamicina, ki so jih preučili kot protirakava zdravila v kliničnih preskušanjih, spadajo temsirolimus (CCI-779), everolimus (RAD001) in ridaforolimus (AP-23573).[11] Analogi rapamicina imajo podoben terapevtski učinek kot sam rapamicin, vendar imajo izboljšane hidrofilne lastnosti ter se lahko uporabljajo tako peroralno kot intravensko.[5]
Rapalogi, zaviralci mTOR prve generacije, so v številnih predkliničnih modelih izkazali učinkovitost, vendar pa je njihova klinična uporabnost potrjena s kliničnimi preskušanji le pri nekaj vrstah raka.[12] Raziskave na živalih in klinična preskušanja kažejo, da rapalogi primarno delujejo citostatično in so zato učinkoviti kot zdravila za stabiliziranje bolezni in manj pri doseganju regresije.[13] Stopnje odziva na zdravljenje z rapalogi pri čvrstih tumorjih, kadar se uporabljajo samostojno brez drugih zdravil, so skromne. Za doseganje obsežnejšega protirakavega učinka uporaba rapalogov kot monoterapije ni zadostna.[11][12][14]
Drugi razlog omejene učinkovitosti zaviralcev mTOR je obstoj negativne povratne zanke v nekaterih tumorskih celicah; zaviranje kompleksa mTORC1 z rapalogi ne zavre negativne povratne zanke, ki povzroči fosforilacijo in aktivacijo AKT.[10][15] Te omejitve so vodile v razvoj zaviralcev mTOR druge generacije.[8]
Rapamicin in rapalogi
[uredi | uredi kodo]Rapamicin in rapalogi (derivati rapamicina) so male molekule[16] s protirakavim delovanjem. Rapalogi imajo ugodnejši farmakokinetični profil v primerjavi s samim rapamicinom,[4] vežejo se pa na enaka vezavna mesta na mTOR in FKBP12.[6]

Sirolimus
[uredi | uredi kodo]Sirolimus (ali rapamicin), bakterijski naravni produkt,[7] s citostatičnim delovanjem, se v kombinaciji s kortikosteroidi in ciklosporinom uporablja pri bolnikih po presaditvi ledvice za preprečevanje zavrnitve presajenega organa.[17] [18] Leta 2012 je ameriški Urad za hrano in zdravila odobril uporabo žilnih opornic, ki sproščajo sirolimus in ki se uporabljajo pri bolnikih z zoženimi (aterosklerotičnimi) venčnimi arterijami.[19]
Sirolimus je izkazal učinkovitost tudi pri zaviranju rasti rakavih celic v poskusih na miških celičnih linijah in v kliničnih preskušanjih na ljudeh.[6]
Sirolimus je izhodiščni zaviralec mTOR, med kasneje razvite učinkovine iz te skupine pa spadajo deforolimus (AP23573), everolimus (RAD001) in temsirolimus (CCI-779).[3]
Temsirolimus
[uredi | uredi kodo]Rapamicinski analog temsirolimus (CCI-779)[3] je prav tako necitotoksična učinkovina, ki zavira proliferacijo tumorskih celic.
Temsirolimus je predzdravilo rapamicina oziroma sirolimusa. Ameriški Urad za hrano in zdravila (FDA)[17] ter Evropska agencija za zdravila (EMA)[20] sta ga odobrila za zdravljenje raka ledvičnih celic. Temsirolimus je bolj vodotopen in se aplicira v obliki intravenskih injekcij.[4][7]
Everolimus
[uredi | uredi kodo]
Everolimus je drugi rapamicinski analog.[3] V primerjavi z izhodiščno učinkovino, rapamicinom, je bolj selektiven za delovanje na beljakovinski kompleks mTORC1 in ima manjši učinek na kompleks mTORC2.[21] Everolimus preko zaviranja mTORC1 izkazuje učinek na prekrvljenost tumorjev, poveča število tumor infiltrirajočih limfocitov in izboljša učinkovitost adoptivne celične terapije.[22]
Everolimus je leta 2011 odobril ameriški Urad za hrano in zdravila za zdravljenje napredovalega raka ledvičnih celic pri bolnikih, pri katerih zdravljenje sunitinibom ali sorafenibom ni več uspešno, subependimskega gigantocelularnega astrocitoma (SEGA), povezanega s tuberozno sklerozo (TS), in progresivnih nevroendokrinih tumorjev pankreatičnega izvora.[23] Leta 2012 so odobrili še nadaljnji dve indikaciji, in sicer zdravljenje napredovalega hormonsko pozitivnega, HER2-negativnega raka dojke in zdravljenje SEGA v kombinaciji z eksemestanom pri otrocih in odraslih.[23] Med letoma 2009 in 2011 je prejel everolimus tudi odobritve Evropske agencije za zdravila za zdravljenje napredovalega raka dojke, pankreatičnih nevroendokrinih tumorjev, napredovalega raka ledvičnih celic[24] in SEGA pri bolnikih s tuberozno sklerozo.[25]
Ridaforolimus
[uredi | uredi kodo]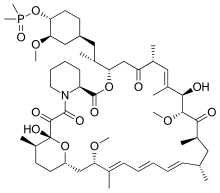
Ridaforolimus (AP23573, MK-8669) ali deforolimus je rapamicinski analog, ki ni predzdravilo sirolimusa.[3] Kot temsirolimus se uporablja intravensko. V zdravljenju sarkoma so preučevali peroralno obliko (tablete),[4] vendar je prozvajalec v Evropski uniji umaknil vlogo za dodelitev dovoljenja za promet, ker je Evropska agencija za zdravila ocenila, da predloženi podatki ne dokazujejo pozitivnega razmerja med koristmi in tveganji.[26]
Umirolimus
[uredi | uredi kodo]Umirolimus je imunosupresivno zdravilo, ki se uporablja za preprečevanje restenoze žil in se vgrajuje v žilne opornice, ki sproščajo učinkovino.[27]
Zotarolimus
[uredi | uredi kodo]Zotarolimus je prav tako imunosupresivna učinkovina, ki se uporablja v žilnih opornicah, ki sproščajo učinkovino.[28][29]
Zaviralci mTOR druge generacije
[uredi | uredi kodo]
Zaviralce mTOR druge generacije imenujejo tudi ATP-kompetitivni zaviralci mTOR.[8][30] Dvojne zaviralce mTORC1/mTORC2, kot so torin-1, torin-2 in vistusertib, so razvili, da z ATP tekmujejo za vezavo na katalitično vezavno mesto na kinazi mTOR. Zavirajo vse od kinaze odvisne funkcije mTORC1 in mTORC2 ter blokirajo povratno aktivacijo signalne poti PI3K/AKT; po tem se razlikujejo od rapalogov, ki ciljajo le mTORC1.[8][10] Predstavniki učinkovin iz te skupine so že prešli v fazo kliničnega preskušanja, vendar so razvoj nekaterih, na primer vistusertiba, ustavili.[30] Kot rapalogi tudi zaviralci mTOR druge generacije zavirajo v rakavih celicah pri številnih vrstah raka prevajanje beljakovin, napredovanje celičnega cikla ter angiogenezo. Njihov učinek je pa močnejši.[8]
Teoretično je poglavitna prednost ATP-kompetitivnih zaviralcev mTOR znatno zmanjšanje fosforilacije AKT in s tem boljše zaviranje mTORC1.[9] Obstajajo pa tudi pomanjkljivosti. Njihova učinkovitost pri tumorjih, ki imajo mutacije gena KRAS, je omejena, kar verjetno pomeni, da bi pri zdravljenju teh tumorjev bila potrebna kombinirana terapija. Nadalje izkazujejo tudi potencialno toksičnost.[8]
Pomembne interakcije med signalnima potema mTOR in PI3K so osnova za razvoj dvojnih zaviralcev mTOR/PI3K.[8] Sicer obstajajo učinkovine, ki zavirajo bodisi mTORC1 bodisi PI3K, dvojni zaviralci mTOR/PI3K pa hkrati zavirajo mTORC1, mTORC2in vse katalitične izoforme PI3K. S hkratnim zaviranjem obeh kinaz se zmanjša zvišanje ravni izražanja PI3K, do katerega značilno pride pri zaviranju mTORC1.[9] Vendar pa dvojni zaviralci PI3K/mTOR izkazujejo tudi večjo toksičnost.[8]
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 https://www.termania.net/slovarji/slovenski-medicinski-slovar/5544860/zaviralec?query=Mtor&SearchIn=My, Slovenski medicinski e-slovar, vpogled: 27. 10. 2023.
- ↑ Pópulo H, Lopes JM, Soares P (2012). »The mTOR signalling pathway in human cancer«. International Journal of Molecular Sciences. 13 (2): 1886–1918. doi:10.3390/ijms13021886. PMC 3291999. PMID 22408430.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Strimpakos AS, Karapanagiotou EM, Saif MW, Syrigos KN (april 2009). »The role of mTOR in the management of solid tumors: an overview«. Cancer Treatment Reviews. 35 (2): 148–159. doi:10.1016/j.ctrv.2008.09.006. PMID 19013721.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ 4,0 4,1 4,2 4,3 4,4 Yuan R, Kay A, Berg WJ, Lebwohl D (Oktober 2009). »Targeting tumorigenesis: development and use of mTOR inhibitors in cancer therapy«. Journal of Hematology & Oncology. 2: 45. doi:10.1186/1756-8722-2-45. PMC 2775749. PMID 19860903.
- ↑ 5,0 5,1 5,2 Tsang CK, Qi H, Liu LF, Zheng XF (Februar 2007). »Targeting mammalian target of rapamycin (mTOR) for health and diseases«. Drug Discovery Today. 12 (3–4): 112–124. doi:10.1016/j.drudis.2006.12.008. PMID 17275731.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Faivre S, Kroemer G, Raymond E (Avgust 2006). »Current development of mTOR inhibitors as anticancer agents«. Nature Reviews. Drug Discovery. 5 (8): 671–688. doi:10.1038/nrd2062. PMID 16883305. S2CID 27952376.
- ↑ 7,0 7,1 7,2 Vignot S, Faivre S, Aguirre D, Raymond E (april 2005). »mTOR-targeted therapy of cancer with rapamycin derivatives«. Annals of Oncology. 16 (4): 525–537. doi:10.1093/annonc/mdi113. PMID 15728109.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 Zaytseva YY, Valentino JD, Gulhati P, Evers BM (Junij 2012). »mTOR inhibitors in cancer therapy«. Cancer Letters. 319 (1): 1–7. doi:10.1016/j.canlet.2012.01.005. PMID 22261336.
- ↑ 9,0 9,1 9,2 9,3 Vilar E, Perez-Garcia J, Tabernero J (Marec 2011). »Pushing the envelope in the mTOR pathway: the second generation of inhibitors«. Molecular Cancer Therapeutics. 10 (3): 395–403. doi:10.1158/1535-7163.MCT-10-0905. PMC 3413411. PMID 21216931.
- ↑ 10,0 10,1 10,2 Ballou LM, Lin RZ (november 2008). »Rapamycin and mTOR kinase inhibitors«. Journal of Chemical Biology. 1 (1–4): 27–36. doi:10.1007/s12154-008-0003-5. PMC 2698317. PMID 19568796.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ 11,0 11,1 Brachmann S, Fritsch C, Maira SM, García-Echeverría C (april 2009). »PI3K and mTOR inhibitors: a new generation of targeted anticancer agents«. Current Opinion in Cell Biology. 21 (2): 194–198. doi:10.1016/j.ceb.2008.12.011. PMID 19201591.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ 12,0 12,1 Zhang YJ, Duan Y, Zheng XF (april 2011). »Targeting the mTOR kinase domain: the second generation of mTOR inhibitors«. Drug Discovery Today. 16 (7–8): 325–331. doi:10.1016/j.drudis.2011.02.008. PMC 3073023. PMID 21333749.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Wander SA, Hennessy BT, Slingerland JM (april 2011). »Next-generation mTOR inhibitors in clinical oncology: how pathway complexity informs therapeutic strategy«. The Journal of Clinical Investigation. 121 (4): 1231–1241. doi:10.1172/JCI44145. PMC 3069769. PMID 21490404.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Tanneeru K, Guruprasad L (april 2012). »Ligand-based 3-D pharmacophore generation and molecular docking of mTOR kinase inhibitors«. Journal of Molecular Modeling. 18 (4): 1611–1624. doi:10.1007/s00894-011-1184-3. PMID 21805127. S2CID 19207283.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Sutherlin DP, Bao L, Berry M, Castanedo G, Chuckowree I, Dotson J, in sod. (november 2011). »Discovery of a potent, selective, and orally available class I phosphatidylinositol 3-kinase (PI3K)/mammalian target of rapamycin (mTOR) kinase inhibitor (GDC-0980) for the treatment of cancer«. Journal of Medicinal Chemistry. 54 (21): 7579–7587. doi:10.1021/jm2009327. PMID 21981714.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Simamora P, Alvarez JM, Yalkowsky SH (Februar 2001). »Solubilization of rapamycin«. International Journal of Pharmaceutics. 213 (1–2): 25–29. doi:10.1016/s0378-5173(00)00617-7. PMID 11165091.
- ↑ 17,0 17,1 »Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations«. Food and Drug Administration. Pridobljeno 25. septembra 2012.
- ↑ »Rapamune«. European Medicines Agency. Arhivirano iz prvotnega spletišča dne 6. aprila 2013. Pridobljeno 25. septembra 2012.
- ↑ »CYPHER Sirolimus-eluting Coronary Stent - P020026«. Urad za hrano in zdravila. Pridobljeno 25. septembra 2012.
- ↑ »Torisel«. Evropska agencija za zdravila. Arhivirano iz prvotnega spletišča dne 18. januarja 2013. Pridobljeno 25. septembra 2012.
- ↑ Arriola Apelo SI, Neuman JC, Baar EL, Syed FA, Cummings NE, Brar HK, in sod. (Februar 2016). »Alternative rapamycin treatment regimens mitigate the impact of rapamycin on glucose homeostasis and the immune system«. Aging Cell. 15 (1): 28–38. doi:10.1111/acel.12405. PMC 4717280. PMID 26463117.
- ↑ Wang S, Raybuck A, Shiuan E, Cho SH, Wang Q, Brantley-Sieders DM, in sod. (Avgust 2020). »Selective inhibition of mTORC1 in tumor vessels increases antitumor immunity«. JCI Insight. 5 (15): e139237. doi:10.1172/jci.insight.139237. PMC 7455083. PMID 32759497.
- ↑ 23,0 23,1 »FDA approval for Everolimus«. National Cancer Institute. 21. april 2009. Arhivirano iz prvotnega spletišča dne 6. aprila 2015. Pridobljeno 20. septembra 2012.
- ↑ »Afinitor«. Evropska agencija za zdravila. Arhivirano iz prvotnega spletišča dne 19. decembra 2013. Pridobljeno 25. septembra 2012.
- ↑ »Votubia«. European Medicines Agency. Arhivirano iz prvotnega spletišča dne 19. oktobra 2012. Pridobljeno 25. septembra 2012.
- ↑ »Umik vloge za pridobitev dovoljenja za promet z zdravilom Jenzyl (ridaforolimus)« (PDF). Evropska agencija za zdravila. 14. december 2012. Pridobljeno 1. novembra 2023.
- ↑ Piccolo R, Nicolino A, Danzi GB (Maj 2014). »The Nobori biolimus-eluting stent: update of available evidence«. Expert Review of Medical Devices. 11 (3): 275–282. doi:10.1586/17434440.2014.894458. PMID 24579987. S2CID 7202232.
- ↑ Blum M, Cao D, Mehran R (april 2020). »Device profile of the Resolute Onyx Zotarolimus eluting coronary stent system for the treatment of coronary artery disease: overview of its safety and efficacy«. Expert Review of Medical Devices. 17 (4): 257–265. doi:10.1080/17434440.2020.1736037. PMID 32154750. S2CID 212652625.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Kranjec I. Zdravljenje koronarne bolezni s perkutanimi intervencijami. Zdrav Vestn. 2021;90(7–8):365–8. DOI: https:// doi.org /10.6016/ZdravVestn.3246.
- ↑ 30,0 30,1 Chen Y, Zhou X (december 2020). »Research progress of mTOR inhibitors«. European Journal of Medicinal Chemistry. 208: 112820. doi:10.1016/j.ejmech.2020.112820. PMID 32966896. S2CID 221887814.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava)
