Ksantin oksidaza
| Ksantin oksigenaza/dehidrogenaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kristalografksa zgradba monomera goveje ksantin oksigenaze[1] Prikazani se: vezani FAD (rdeče), gruča FeS (oranžno), molibdopterinski kofaktor z molibdenom (rumeno) in salicilat (modro). | |||||||||
| Identifikatorji | |||||||||
| Številka EC | 1.17.3.2 | ||||||||
| Številka CAS | 9002-17-9 | ||||||||
| Podatkovne baze | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB strukture | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / QuickGO | ||||||||
| |||||||||
Ksantin oksigenaza/dehidrogenaza
| |
| Identifikatorji | |
| Simbol | XDH |
| Entrez | 7498 |
| HUGO | 12805 |
| OMIM | 607633 |
| PDB | 1FIQ |
| RefSeq | NM_000379 |
| UniProt | P47989 |
| Drugi podatki | |
| EC-številka | 1.17.3.2 |
| Lokus | Kr. 2 p23,1 |
Ksantin oksidaza ali ksantinska oksidaza je FAD vsebujoči encim v poti razgradnje purinskih baz, ki katalizira oksidacijo ksantina v sečno kislino in vodikov peroksid, pa tudi oksidacijo hipoksantina v ksantin. Inhibira ga, na primer, alopurinol.[2]
Pojavlja se lahko v dveh oblikah, kot oksidaza ali kot dehidrogenaza: ksantin oksidaza nastane s povratno sulfhidrilno oksidacijo iz ksantin dehidrogenaze.[2][3]
Reakcija[uredi | uredi kodo]
Ksantin oksidaza katalizira naslednji reakciji::
- hipoksantin + H2O + O2 ksantin + H2O2
- ksantin + H2O + O2 sečna kislina + H2O2
-
Hipoksantin (en kisikov atom)
-
Ksantin (dva kisikova atoma)
-
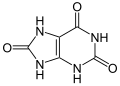
Sečna kislina (trije kisikovi atomi)
Zgradba beljakovine[uredi | uredi kodo]
Gre za veliko molekulo z molekulsko maso 270.000. Ena encimska enota vsebuje 2 flavinski molekuli (vezani v obliki FAD-a), 2 atoma molibdena in 8 železovih atomov. Atomi molibdena se nahajajo v molibdopterinskem kofaktorju in predstavljajo aktivno mesto encima. Železovi atomi so sestavni del [2Fe-2S] feredoksinskih gruč, ki vsebujejo železo in žveplo in sodelujejo pri prenosu elektronov.
Mehanizem delovanja[uredi | uredi kodo]
Aktivno mesto encima je molibdopterinska enota z atomom molibdena ter terminalnima ketonsko in hidroksilno skupino.[4] Pri pretvorbi ksantina v sečno kislino se kisikov atom prenese iz molibdena na ksantin; reakcija poteka preko več intermediatov.[5] Molibdenski center encima se obnovi z vezavo vode. Tudi za druge poznane oksidoreduktaze, ki vsebujejo molibden, je značilno, da se kisikov atom po navadi veže iz vode in ne iz O2.
Klinični pomen[uredi | uredi kodo]
Pri ljudeh se ksantin oksidaza nahaja v jetrih in ne prosto v krvi. Pri hudi poškodbi jeter se lahko sprosti v kri in zato se preskus na ksantin oksidazo v krvi uporablja za ugotavljanje jetrne poškodbe.
Ker ksantin oksidaza sodeluje v presnovni poti sečne kisline, je pomembna pri razvoju protina in zaviralci ksantin oksidaze (npr. alopurinol) se uporabljajo za zdravljnje te bolezni. Ker je ksantin oksidaza udeležena tudi v presnovo 6-merkaptopurina, je potrebna pozornost pri hkratnem dajanju alopurinola in 6-merkaptopurina (ali njegovega predzdravila azatioprina).
Redka dedna motnja ksantinurija je posledica pomanjkanja ksantinske oksidaze in posledično se v krvi nahajajo visoke koncentracije ksantina, kar lahko vodi do ledvične odpovedi. Za to bolezen ne obstaja specifično zdravilo; bolniki se morajo izogibati hrani, bogati s purini, ter uživati dovolj tekočine.
Zaviranje ksantinske oksidaze naj bi tudi pomagalo pri zdravljenju srčno-žilnih bolezni.[6]
Oba encima, ksantinska oksidaza in oksidoreduktaza, sta prisotna tudi v epiteliju in endoteliju roženice in naj bi sodelovala pri oksidativnih očesnih poškodbah.[7]
Zaviralci[uredi | uredi kodo]
Zaviralci ksantinske oksidaze so alopurinol,[8] oksipurinol,[9] in fitična kislina.[10]
Sklici[uredi | uredi kodo]
- ↑ PDB: 1FIQ; Enroth C; Eger BT; Okamoto K; Nishino T; Nishino T; Pai EF (2000). »Crystal structures of bovine milk xanthine dehydrogenase and xanthine oxidase: structure-based mechanism of conversion«. Proc. Natl. Acad. Sci. U.S.A. 97 (20): 10723–8. doi:10.1073/pnas.97.20.10723. PMC 27090. PMID 11005854. Arhivirano iz prvotnega spletišča dne 13. decembra 2019. Pridobljeno 2. marca 2011.
- ↑ 2,0 2,1 <http://lsm1.amebis.si/lsmeds/novPogoj.aspx?pPogoj=ksantin-oksidaza[mrtva povezava] Slovenski medicinski e-sovar; vpogled: 2. 3. 2011.
- ↑ »Entrez Gene: XDH xanthine dehydrogenase«.
- ↑ Hille R. (2006). »Structure and Function of Xanthine Oxidoreductase«. European Journal of Inorganic Chemistry. 2006 (10): 1905–2095. doi:10.1002/ejic.200600087.
- ↑ Metz S; Thiel W. (2009). »A Combined QM/MM Study on the Reductive Half-Reaction of Xanthine Oxidase: Substrate Orientation and Mechanism«. Journal of the American Chemical Society. 131 (41): 14885–158902. doi:10.1021/ja9045394. PMID 19788181.
- ↑ Dawson J; Walters M (2006). »Uric acid and xanthine oxidase: future therapeutic targets in the prevention of cardiovascular disease?«. British journal of clinical pharmacology. 62: 633. doi:10.1111/j.1365-2125.2006.02785.x. PMC 1885190. PMID 17052251.
- ↑ Cejková J; Ardan T; Filipec M; Midelfart A (2002). »Xanthine oxidoreductase and xanthine oxidase in human cornea«. Histol. Histopathol. 17 (3): 755–60. PMID 12168784.
- ↑ Pacher P; Nivorozhkin A; Szabó C (2006). »Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol«. Pharmacol. Rev. 58 (1): 87–114. doi:10.1124/pr.58.1.6. PMC 2233605. PMID 16507884.
- ↑ Spector T (1988). »Oxypurinol as an inhibitor of xanthine oxidase-catalyzed production of superoxide radical«. Biochem. Pharmacol. 37 (2): 349–352. doi:10.1016/0006-2952(88)90739-3. PMID 2829916.
- ↑ Muraoka S; Miura T (2004). »Inhibition of xanthine oxidase by phytic acid and its antioxidative action«. Life Sci. 74 (13): 1691–700. doi:10.1016/j.lfs.2003.09.040. PMID 14738912.