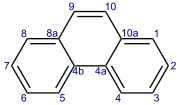
Fenantren
| |

| |

| |
| Imena | |
|---|---|
| IUPAC imes
fenantren,
triciklo[8.4.0.02,7]tetradeka-1,3,5,7,9,11,13-heptaene | |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.001.437 |
| EC število |
|
| KEGG | |
| MeSH | C031181 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C14H10 | |
| Molska masa | 178,23 g·mol−1 |
| Videz | brezbarvna trdnina |
| Gostota | 1,18 g/cm3[1] |
| Tališče | 101 °C (214 °F; 374 K) |
| Vrelišče | 332 °C (630 °F; 605 K) |
| 1,6 mg/L[1] | |
| Nevarnosti | |
EU klasifikacija (DSD) (zastarelo)
|
|
| NFPA 704 (diamant ognja) | |
| Plamenišče | 171 °C (340 °F; 444 K) |
| Struktura | |
| C2v[2] | |
| Dipolni moment | 0 D |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Fenantren je policiklični aromatski ogljikovodik, sestavljen iz treh zlitih benzenovih obročev. Je bel prah z modro fluorescenco. Njegovo ime je sestavljeno iz imen fenil in antracen. V čisti obliki je v cigaretnem dimu. Znan je po tem, da draži kožo in jo naredi občutljivo na sončno svetlobo. Fenantren je bel prah z modro fluorescenco.
Spojina s fenantrenovim ogrodjem in dušikom na položajih 4 in 5 je fenantrolin.
Fenatren tvori tudi ogrodje morfinana, ki je osnova velikega števila psihoaktivnih kemikalij, vključno z antitusiki, opioidnimi analgetiki in disociativnimi halucinogeni.[3]
Lastnosti
[uredi | uredi kodo]Fenantren ni topen v vodi ampak v večini nizko polarnih organskih topil kot so toluen, ogljikov tetraklorid, eter, kloroform, ocetna kislina in benzen.
Sinteza
[uredi | uredi kodo]Klasična metoda za njegovo sintezo je Bardhan-Senguptova sinteza fenentrena:
Prvi korak je elektrofilna aromatska substitucijska reakcija, v kateri difosforjev pentoksid odcepi alkoholno –OH skupino in vodikov atom v obliki vode. V tem koraku ne nastane izven aromatskega obroča nobena nova dvojna vez. V drugem koraku se 9,10-dihidrofenantren dehidrogenira z elementarnim selenom. Mehanizem aromatizacije nasičenega šestčlenskega obroča s pomočjo selena ni znana, vendar v njej nastane vodikov selenid H2Se.
Fenantren se lahko tvori tudi fotokemično iz nekaterih diariletenov.
Reakcije
[uredi | uredi kodo]Med reakcije, ki običajno potekajo na 9. in 10. ogljikovem atomu, spadajo:
- oksidacija s kromovo kislino v fenantrenkinon,
- redukcija z vodikom in raney nikljem v 9,10-dihidrofenantren,
- elektrofilno halogeniranje z bromom v 9-bromofenantren,
- aromatska sulfonacija v 2- in 3-fenantrensulfonsko kislino in
- ozonoliza v difenilaldehid.
Stabilnost
[uredi | uredi kodo]Fenentren je bolj stabilen kot njegov linearni izomer antracen. Klasična in dobro pojasnjena razlaga njegove stabilnosti temelji na Clarovem pravilu. Novejša teorija se sklicuje na tako imenovano stabilizacijo vezi vodik-vodik med atomoma C4 in C5.
Nahajališča
[uredi | uredi kodo]Antracen se v naravi pojavlja kot mineral ravatit,[4] ki spada v majhno skupino organskih mineralov. Ravalit se v majhnih količina pojavlja v skladih gorečega premoga.
Februarja 2014 je NASA objavila zelo posodobljeno bazo podatkov za odkrivanje policikličnih aromatskih ogljikovodikov (PAHs) v vesolju, med katerimi je tudi fenantren. Po mnenju znanstvenikov bi lahko bilo več kot 20 % ogljika v vesolju vezanega v PAHs. Ti ogljikovodiki bi lahko bili osnova za nastanek življenja. Zgleda, da so se PAHs začeli tvoriti nekaj milijard let po prapoku in se začeli širiti po vesolju. Povezani so tudi z nastajajočimi zvezdami in zunajosončnimi planeti.[5]
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 1,2 1,3 1,4 GESTIS Substance Database. Napaka pri navajanju: Neveljavna oznaka
<ref>; sklici, poimenovaniGESTIS, so definirani večkrat z različno vsebino (glej stran pomoči). - ↑ Peter Atkins, J. D. P., Atkins' Physical Chemistry. Oxford: 2010. Pg.443
- ↑ W. Zhang, J.S. Hong, H.C. Kim, W. Zhang, M.L. Block (2004). Morphinan neuroprotection: new insight into the therapy of neurodegeneration. Critical Reviews in Neurobiology 16 (4): 271–302. PMID 15862109. Pridobljeno 6. maja 2011.
- ↑ Ravatite. Mineral Data.
- ↑ R. Hoover (2014). Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That Arhivirano 2020-05-10 na Wayback Machine.. NASA. Pridobljeno 22. februarja 2014.


