Uporabnik:Luka11235/Tkivni inženiring
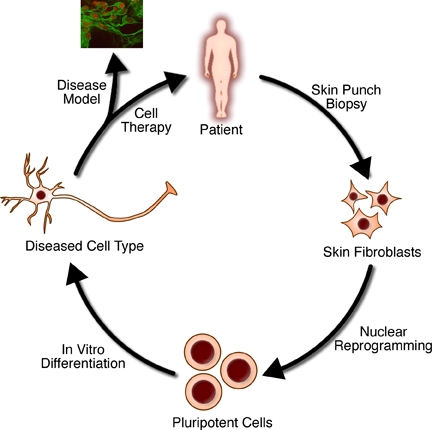
Pod pojmom tkivno inženirstvo razumemo metode, ki z uporabo kombinacije celic, inženirstva in materialov ter primernih biokemijskih in fizikalno kemijskih dejavnikov izboljšajo ali zamenjajo biološko tkivo. Tkivni nosilci se uporabljajo za tvorbo novega viabilnega tkiva z nekim medicinskim namenom. Včasih so ga uvrščali pod študij biomaterialov, do danes pa se je v pomenu in razsežnosti toliko povečalo, da ga smatramo za samostojno področje raziskovanja.
Medtem ko večina definicij tkivnega inženirstva pokriva širok spekter uporabnosti, je izraz v praksi tesno povezan z apliciranjem, ki popravi ali zamenja del ali kar celotno tkivo (npr. kost, hrustanec,[1] krvne žile, mehur, koža, mišica, itd.). Pogosto potrebujejo uporabljena tkiva določene mehanske in strukturne lastnosti za pravilno delovanje. Izraz je bil uporabljen tudi za prizadevanja k razvoja sistemov, ki opravljajo specifične biokemijske funkcije z uporabo celic znotraj umetno ustvarjenega podpornega sistema (npr. umetna trebušna slinavka, jetra). Tkivni inženirstvo je včasih sinonim za regeneratino medicino, čeprav se le-ta osredotoča na uporabo matičnih in progenitornih celic za proizvodnjo tkiva.
Pregled[uredi | uredi kodo]

Pogosto uporabljena definicija tkivnega inženiringa, kot sta jo formulirala Langer[2] in Vacanti,[3] pravi, da je "interdisciplinarno področje, ki uporablja načela inženiringa in znanosti o življenju z namenom razvoja bioloških nadomestkov, ki obnovijo, ohranjajo ali izboljšajo funkcijo bioloških tkiv ali celega organa".[4] Definirano je tudi kot "razumevanje načel rasti tkiv in uporabo tega znanja za proizvajajo funkcionalnega nadomestnega tkiva za klinično uporabo".[5] Nadaljnji opis pravi, da je "globlja domneva tkivnega inženiringa to, da bo uporaba naravne biologije sistema omogočala večjo uspešnost pri razvoju terapevtskih strategij, usmerjenih v zamenjavo, vzdrževanje ali izboljšanje tkivne funkcije".
Pomembna dognanja in razvoj na interdisciplinarnem področju tkivnega inženiringa so privedla do novih tkivnih nadomestnih delov in strategij implementacije. Znanstveni napredek pri biomaterialih, matičnih celicah, rasti in diferenciacijskih faktorjih ter biomimetskih okoljih je ustvaril edinstvene priložnosti za proizvodnjo tkiva v laboratoriju iz kombinacije inženirsko osnovanih zunajceličnih matrik (ti. nosilcev), celic in biološko aktivnih molekul. Med večjimi izzivi za prihodnost tkivnega inženirstva je potreba po bolj kompleksni funkcionalnosti, funkcionalni in biomehanski stabilnosti ter ožiljanju laboratorijsko vzgojenih tkiv, namenjenih za presaditev. Nadaljnji uspeh tkivnega inženiringa in končen razvoj pravih človeških nadomestnih delov bo vzklil iz združitve inženiringa in osnovnih raziskovalnih napredkov v biologiji tkiv, matrik, rastnih dejavnikov, matičnih celic in razvojni biologiji, pa tudi v znanosti materialov in bioinformatiki.
Leta 2003 je ameriška agencija NSF (Narodni znanstveni sklad) izdala poročilo "Pojav tkivnega inženiringa kot raziskovalnega področja", ki podrobno opiše zgodovinski razvoj področja. [6]
Primeri[uredi | uredi kodo]
- Bioumetni sapnik: prvi postopek regenerativne medicine z vsaditvijo "bioumetnega" organa.
- In vitro meso: užitno umetno živalsko mišično tkivo, vzgojeno in vitro.
- Bioumetna jetrna naprava: več raziskovalnih prizadevanj je privedlo do razvoja jetrnih podpornih naprav z viabilnimi hepatociti.
- Umetna trebušna slinavka: raziskave vključujejo uporabo celic Langerhansovih otočkov za proizvodnjo in regulacijo inzulina, zlasti v primerih sladkorne bolezni.
- Umetni mehur: Anthony Atala[7] (Univerza Wake Forest) je tekom dolgoročnega poskusa uspešno vsadil umetno vzgojene mehurje v sedem od približno 20 testnih osebkov.[8]
- Hrustanec: laboratorijsko vzgojeno tkivo za uspešno popravilo kolenskega hrustanca.[9]
- Hrustanec brez nosilca: hrustanec, ki se tvori brez uporabe zunanjega nosilnega materiala. V tej metodologiji je ves material celičen ali pa nekaj, kar celice proizvajajo same.[10]
- Srce v kozarcu Doris Taylor
- Tkivno snovane dihalne poti
[11] - Tkivno snovane žile[12]
- Umetna koža, ustvarjena iz človeških kožnih celic, vsidranih v hidrogelu, kot so bionatisnjene strukture za obnovitev kože po opeklinah.[13]
- Umetni kostni mozeg.[14]
- Umetna kost
- Laboratorijsko vzgojen penis[15]
- Inženiring tkiva ustne sluznice
- Prepucij[16][17]
Celice kot gradniki[uredi | uredi kodo]

Tkivni inženiring uporablja žive celice kot inženirski material. Primer tega je uporaba fibroblastov pri zamenjavi ali popravilu kože, popravilu hrustanca z živimi hondrociti ali drugih tipov celic na druge načine.
Celice so postale uporabne kot gradbeni material leta 1998, ko so znanstveniki odkrili način, kako podaljšati telomere, s čimer so izdelali nesmrtne celične linije.[18][navedi vir] Pred tem so šle laboratorijske kulture zdravih, nerakavih sesalskih celic samo preko omejeno število delitev (Hayflickova meja), preden so umrle.
Pridobivanje celic[uredi | uredi kodo]
Iz tekočih tkiv, kot je kri, se celice pridobiva z grobimi metodami, navadno s centrifugiranjem ali aferezo. Iz trdnih tkiv je pridobivanje bolj težavno. Tkivo se običajno zmelje, nato pa z encimom tripsinom ali kolagenazo odstrani zunajcelično matriko, ki drži celice skupaj. Po tem so celice prosto plavajoče. Pridobivamo jih s centrifugiranjem ali afetezo. Razgradnja s tripsinom je zelo odvisna od temperature. Pri višjih temperaturah se matrika razgradi hitreje, a je poškodb več. Kolagenaza je manj odvisna od temperature, poškoduje manj celic, a je počasnejša in dražja.
Vrste celic[uredi | uredi kodo]

Celice pogosto razvrščamo glede na njihov izvor.
Avtologne celice se pridobijo iz osebka, ki bo tudi prejemnik reimplantata. Težav z zavračanjem in prenosom patogenov je najmanjše, v nekaterih primerih pa vseeno ni izvedljiva metoda (genetske bolezni, zelo bolani ali ostareli ljudje, hude opekline), saj je avtolognih celic za vzpostavitev delujoče celične linije premalo. Pri tej kategoriji celic je potreben kirurški poseg za pridobitev celic, kar poveča tveganje za okužbe ali kronično bolečino. Celične linije je potrebno kultivirati iz vzorca, kar lahko traja precej časa. Zdaj se trend obrača proti uporabi mezenhimskih matičnih celic iz maščevja ali kostnega mozga. Te celice se lahko diferenciirajo v kostno tkivo, hrustanec, maščobne celice in živce. Iz maščevja se lahko enostavno in hitro pridobi veliko število celic, kar odpira potencial hitremu pridobivanju velike količine celic.
Alogenske celice prihajajo iz telesa darovalca iste vrste organizma. Pri uporabi človeških celic za in vitro študije obstajajo določene etične omejitve, uporaba kožnih fibroblastov pa se je vseeno izkazala za imunološko varno in posledično možno izbiro pri tkivnem inženiringu kože.
Ksenogenske celice so izolirane iz organizma druge vrste. Predvsem živalske celice se precej pogosto uporabljajo pri poskusih izdelave srčnožilnih vsadkov.
Singenske ali izogenske celice izoliramo iz genetsko identičnih organizmov, kot so dvojčki, kloni ali visoko sokrvni raziskovalni živalski modeli.
Primarne celice so iz organizma.
Sekundarne celice so iz celične banke.
Matične celice so nediferenciirane celice s sposobnostjo delitve v kulturi, iz njih pa izhajajo različne oblike specializiranih celic. Glede na svoj izvor se matične celice delijo na "odrasle" in "embrionske". Prve so multipotentne, slednje pa pluripotentne; nekatere celice iz zgodnjega embria tudi totipotentne. Čeprav je o etičnosti uporabe embrionskih matičnih celic še vedno velika razprava, bi bil lahko alternativen vir - inducirane matične celice - uporaben za popravilo obolelih ali poškodovanih tkiv in za rast novih organov.
Nosilci[uredi | uredi kodo]
Nosilci so materiali, osnovani da povzročajo željene celične interakcije, ki prispevajo k tvorbi novega funkcionalnega tkiva za medicinske namene. Celice pogosto "zasadijo" v te strukture, ki lahko podpirajo tridimenzionalno tvorbo tkiva. Nosilci oponašajo zunajcelično matriko prvotnega tkiva, povzemajo in vivo okolico in omogočajo, da celice vplivajo na lastno mikrookolje. Navadno služijo enemu od sledečih namenovː omogočajo pritrjevanje in migracijo celic, dostavijo in zadržujejo celice in biokemijske dejavnike, omogočajo difuzijo pomembnih hranil in izraženih celičnih produktov, izražajo določene mehanske in biološke vplive za prilagajanje obnašanja celične faze.
Leta 2009 je interdisciplinarna ekipa pod vodstvom prsnega kirurga Thorstena Wallesa vsadila prvi bioumetni vsadek, ki zagotavlja vgrajen žilni sistem za popresaditveno oskrbo vsadka, v bolnika, ki čaka na rekonstrukcijo sapnika.[19]

Da bi dosegli cilj obnove tkiva morajo nosilci dosegati specifične zahteve. Visoka poroznost in ustrezna velikost por sta pomembni, saj pripomoreta k zasaditvi celic in difuziji tako celic kot hranil preko celotne strukture. Biorazgradljivost je pogosto ključen dejavnik, saj bi se morali nosilci absorbirati v okoliško tkivo brez potrebe po kirurški odstranitvi. Hitrost razgradnje se mora čim bolj ujemati s hitrostjo rasti tkiva: to pomeni, da se mora zunajcelična matrika oblikovati dovolj hitro, da lahko zagotovi strukturno integriteto in prevzame mehanska bremena izginjajočega nosilca. Možnost injeciranja je tudi pomembna za klinični uporabo. Iz nedavnih raziskav tiskanja organov je razvidno, da je dober nadzor nad 3D okoljem ključen za doseganje obnovljivosti poskusov in boljših rezultatov.
Materiali[uredi | uredi kodo]
Raziskovali so veliko različnih materialov (naravnih in sintetičnih, biorazgradljivih in stalnih). Večina teh materialov je bilo že znanih na področju medicine, saj so jih uporabljali za kirurške šive, ki jih telo resorbira. Primeri teh materialov so kolagen in nekateri poliestri.
Zasnovali so tudi nove materiale s specifičnimi prilagoditvamiː sposobnost injeciranja, sintetična izdelava, biokompatibilnost, neimunogenost, prosojnost, nano vlakna, nižanje koncentracije, hitrost resorpcije, itn. PuraMatrix je družina novih biomimetskih nosilcev, ki je že komercializirana in vpliva na tkivni inženiring.
Pogosto uporabljen sintetični material je poliester polimlečna kislina (PLA), ki se v telesu razgradi v mlečno kislino, ki se v telesu naravno pojavlja in jo telo zlahka odstranjuje. Podobna materiala sta poliglikolna kislina (PGA) in polikaprolakton (PCL); njuna razgradnja je podobna, za PGA hitrejša, za PCL pa počasnejša od polimlečne kisline. Čeprav te materiali imajo mehansko trdnost in strukturno integriteto, izkazujejo hidrofobne lastnosti, ki inhibirajo biokompatibilnost, zaradi tega pa so manj učinkoviti za uporain vivo kot nosilci tkiva.[21] Da bi odpravili pomanjkanje biokompatibilnost, so jih kombinirali s hidrofilnimi in bolj biokompatibilnimi hidrogeli, a je trdnost materiala zmanjšana. S kombiniranjem dveh tipov materialov želijo ustvariti sinergijo, ki vodi v višjo kompatibilnost nosilcev.[22] Nosilce se lahko konstruira tudi iz naravnih materialov, kot so derivati zunajcelične matrike, proteinskih materialov (kolagena ali fibrina) in polisaharidov (hitosan)[23] ali glikozaminoglikanov (GAG), ki so se izkazali za ustrezne v smislu celične kompatibilnosti, a so nekateri potencialno imunogeni. Med GAG-i je hialuronska kislina s premreženjem iz npr. glutaraldehida ali vodotopnega glutardiimida eden od možnih materialov za nosilce. Funkcionalne skupine na nosilcu so tudi možen dostavni sistem za majhne molekule (zdravila) do specifičnih tkiv. Druga vrsta nosilcev, ki se trenutno raziskujejo, je ekstrakt tkiva, iz katerega so odstranjene celice, preostala matrika pa služi kot nosilec. Pojavile so se tudi biomateriali, kjer so nanomateriali vključeni v polimerno matriko za snovanje bioaktivnih nosilcev.[24]
Študija iz leta 2009 se je usmerila v izboljšanje in vivu podobnih pogojev v 3D tkivih z "zlaganjem in razlaganjem plasti papirja, impregniranega s suspenzijo celic v hidrogelu izvencelične matrike, s čimer se lahko nadzoruje gradient kisika in hranil v 3D ter analizira molekularni in genetski odziv".[25] Mogoče je tudi manipulirati gradient topnih molekul in bolj učinkovito (kot v konvencionalnih 3D hidrogelnih kulturah, celičnih sferoidih ali 3D perfuzijskih reaktorjih) kategorizirati celice v teh kompleksnih gradientih.[26] Različna debelina papirja in vrsta medija lahko podpira raznolika eksperimentalna okolja. Po dekonstrukciji so te sloji papirja uporabni v visokoprepustnem screeningu, ki temelji na celicah, in odkrivanju zdravilnih učinkovin.
Sinteza[uredi | uredi kodo]


Literatura opisuje raznolike metode za pripravo poroznih struktur, ki se uporabljajo kot nosilci v tkivnem inženiringu. Vsaka metoda ima svoje prednosti, nobena pa ni brez pomanjkljivosti.
Nanofiber samo-montažo[uredi | uredi kodo]
Molekularna samo-montažo je ena redkih metod za ustvarjanje biomateriali z lastnostmi, ki so podobne, v obsegu in kemije, ki je naravno in vivo zunajcelične matrike (ECM), ključni korak v smeri inženiringa tkiv kompleksnih tkiv.[27] Poleg tega so ti hydrogel odrov so pokazale premoč v in vivo toksikologija in biokompatibilnost v primerjavi s tradicionalnimi macroscaffolds in živali, pridobljenih materialov.
Tekstilne tehnologije[uredi | uredi kodo]
Te tehnike vključujejo vse pristope, ki so bili uspešno zaposlenih za pripravo non-woven očes različnih polimerov. Zlasti, non-woven polyglycolide strukture, ki so bile testirane za tkivno inženirstvo aplikacije: take vlaknaste strukture, ki so koristna za gojenje različnih vrst celic. Glavne slabosti so povezane s težavami pri pridobivanju visoke poroznosti in redno velikost por.
Topila litje in trdnih izpiranja[uredi | uredi kodo]
Topila litje in trdnih izpiranja (SCPL) omogoča pripravo strukture z redno poroznosti, a z omejeno debelino. Prvi, polimer se raztopi v primeren organskih topil (npr. polylactic acid bi se lahko raztopi v diklorometan), potem je rešitev se odda v kalup, ki je napolnjena z porogen delcev. Tako porogen lahko anorganske soli, kot so natrijev klorid, kristali saccharose, želatina krogle ali parafina z njimi. Velikost porogen delce, ki bodo vplivali na velikost odra pore, medtem ko polimer, da porogen razmerje je neposredno povezana s količino poroznosti končne strukture. Po polimer rešitev je bilo oddanih topila je dovoljeno, da v celoti izhlapi, nato kompozitne strukture v plesni potopljen v kopel tekočine, primerna za raztapljanje porogen: voda, v primeru, natrijev klorid, saccharose in želatina ali alifatskih topila, kot hexane za uporabo s parafinskim. Ko porogen je bil popolnoma raztopi, porozne strukture je pridobljen. Razen majhne debeline območju, ki jih lahko pridobi, druga pomanjkljivost SCPL leži v njegove uporabe organskih topil, ki jih je treba v celoti odstraniti, da se preprečijo možne poškodbe celic, zasajeno na oder.
Plin penjenje[uredi | uredi kodo]
Premagati je treba za uporabo organskih topil in trdno porogens, tehniko, z uporabo plina kot porogen je bil razvit. Prvi, disk-oblikovane strukture, izdelana iz želeno polimer, ki so pripravljeni s pomočjo stiskanje modeliranje z ogrevano plesni. Diski so nato postavi v komori, v kateri so izpostavljena visokim pritiskom CO2 za več dni. Tlak v notranjosti komore je postopoma obnovljena, da atmosferski ravni. Med tem postopkom so pore tvorijo ogljikov dioksid molekule, ki zavračajo polimer, ki nastane v goba-kot struktura. Glavne težave, ki izhajajo iz take tehnike, ki jih povzročajo čezmerno toploto, ki se uporabljajo med stiskanje modeliranje (ki prepoveduje vključitev vseh temperature labile materiala v polimerni matrici) in z dejstvom, da se pore ne tvorijo medsebojno povezane strukture.
Emulsification liofilizacija[uredi | uredi kodo]
Ta tehnika ne zahteva uporabe trdnih porogen kot SCPL. Najprej je sintetični polimer je raztopljene v ustreznem topilu (npr. polylactic acid v diklorometan) vode se doda polimernih rešitev in dve tekočine, ki se mešajo, da bi dobili emulzija. Preden dveh faz, ki se lahko ločeno, emulzije se odda v kalup in hitro zamrznjenih s pomočjo poglabljanja v tekoči dušik. Zamrznjeno emulzija naknadno, z zamrzovanjem sušene , da odstranite razpršeno vodo in topila, s čimer dobimo strjenih, poroznih polimernih strukturo. Medtem ko emulsification in liofilizacija omogočajo hitrejšo pripravo ko v primerjavi z SCPL (ker ne zahteva časa izpiranja korak), to še vedno zahteva uporabo topil. Poleg tega je velikost por je relativno majhna in poroznosti je pogosto nepravilno. Liofilizacija sama po sebi je tudi pogosto delajo tehnika za izdelavo odrov. V primeru, da se uporablja za pripravo kolagena spužve: kolagena, ki se raztopi v kislih raztopin ocetni kislini ali solna kislina , ki se odda v kalup, zamrznjene s tekočim dušikom in nato lyophilized.
Toplotno povzroča faza ločitve[uredi | uredi kodo]
Podobno kot v prejšnjih tehnike, NASVETI faza ločitve postopek zahteva uporabo topil z nizkim tališčem, ki je enostaven za vzvišen. Na primer, dioxane lahko uporabljajo za raztapljanje polylactic acid, nato faza ločitev, ki je povzročeno z dodatkom majhne količine vode: polimer-bogata in polimer-slaba fazi so oblikovali. Naslednje hlajenje pod topila tališče in nekaj dni vakuumsko sušenje, da vzvišen topila, porozni gradbeni oder je pridobljen. Tekoče-tekoče faze ločitve predstavlja enak slabosti emulsification/liofilizacija.[28]
Electrospinning[uredi | uredi kodo]
Electrospinning je zelo vsestranski tehnika, ki se lahko uporabijo za izdelavo neprekinjeno vlakna od submicrometer, da nanometrov premera. V tipični electrospinning set-up, rešitev, ki se dovaja skozi spinneret in visoke napetosti, ki se uporablja za nasvet. Kopičenje elektrostatičnega odbijanja v zaračuna rešitev, povzroča ga želite odstraniti tanko vlaknenih tok. A nameščen zbiralnik ploščo ali palico z nasprotno ali ozemljen, ima naboj, ki črpa iz neprekinjenih vlaken, ki prispejo v obliki izredno porozno omrežja. Glavni prednosti te tehnike so njegova preprostost in enostavnost variacije. Na laboratorijski ravni, značilni electrospinning set-up zahteva samo visoke napetosti napajanja (do 30 kV), brizga, ploščato konico igle in vodenje kolektorja. Zaradi teh razlogov, electrospinning je postalo pogost način odra proizvodnji v številnih laboratorijih. S spremembo spremenljivk, kot so oddaljenost sprejemnika, obseg uporablja napetost, ali rešitev pretok—raziskovalci lahko drastično spremeni celotno odra arhitekture.
V preteklosti so raziskave na electrospun vlaknenih odrov sega vsaj v poznih 1980-ih, ko Simon je pokazala, da electrospinning bi lahko uporabili za proizvedeno nano - in submicron obsega vlaknenih odrov iz polimerov rešitve, ki so posebej namenjeni za uporabo kot in vitro celice in tkiva podlage. To zgodnje uporabe electrospun lattices za celične kulture in tkivno inženirstvo je pokazala, da različne celične vrste, ki bi spoštovati in se razmnoževali na polikarbonatnih vlaken. Ugotovljeno je bilo, da v nasprotju z sploščene morfologijo običajno videl v 2D kulture, celice, ki raste na electrospun vlakna razstavljene bolj zaokrožene 3-dimenzionalni morfologijo na splošno opaziti tkiv in vivo.[29]
CAD/CAM tehnologije[uredi | uredi kodo]
Zato, ker je večina zgoraj tehnike so omejena, ko gre za nadzor poroznosti in velikost por, računalniško podprto oblikovanje in proizvodne tehnike, ki so bili uvedeni, da tkivno inženirstvo. Prvič, tridimenzionalno strukturo, ki je oblikovan s pomočjo CAD programske opreme. V poroznosti je lahko prilagojena uporabi algoritmov v programski opremi.[30] Na oder je nato realizirana z uporabo ink-jet tisk, polimerov v prahu ali s pomočjo Nanašanja Prevlek Modeliranje polimera taline.[31]
V letu 2011 je študij po El-Ayoubi et al. raziskovali "3D-izris tehnika za proizvodnjo (biokompatibilno in biorazgradljivi) poli-L-Lactide macroporous odrov z dveh različnih velikosti por" preko trdnih prosti obliki za izdelavo (SSF), z računalniško podprto načrtovanje (CAD), da razišče terapevtske sklepnega hrustanca zamenjava kot "alternativa za konvencionalne tkiva popravilo".[32] študija Je pokazala, manjša velikost por seznanjene s mehanske obremenitve v bioreactor (za indukcijo in vivo-kot pogoji), višje celice preživetja v potencialne terapevtske funkcionalnost preko zmanjšuje čas okrevanja in povečanje presajanje uspešnosti.
Laser-assisted bioprinting[uredi | uredi kodo]
V letu 2012 študija,[33] Koch et al. osredotočila na to, ali Laser-assisted BioPrinting (LaBP) se lahko uporabijo za izgradnjo multicellular 3D vzorce v naravnih matriko, in ali je ustvarjen konstrukt delovanje in tvorijo tkiva. LaBP organizira majhnih količinah živih celic opustitve v določeni visoki ločljivosti vzorcev. preiskava Je bila uspešna, raziskovalci predvidevajo, da "ustvari tkiva gradi se lahko uporablja za in vivo testiranje za vsaditev, ki jih v živalskih modelih" (14). Kot te študije, samo človeško kožo tkiva je bil sintetizira, čeprav raziskovalci projekt, ki "z vključitvijo dodatne vrste celic (npr. melanocitih, Schwann celice, celice lasnega mešička) v tiskani celice gradnje, delovanja teh celic v 3D in vitro microenvironment podobni svojih naravnih eno, lahko analiziramo", uporaben za drug discovery in toksikoloških študij.
Opombe[uredi | uredi kodo]
- ↑ Whitney G. A.; Jayaraman K.; Dennis J. E.; Mansour J. M. (2014). »Scaffold-free cartilage subjected to frictional shear stress demonstrates damage by cracking and surface peeling«. J Tissue Eng Regen Med. doi:10.1002/term.1925.
- ↑ »Langer Lab: Professor Robert Langer«.
- ↑ »The Laboratory for Tissue Engineering and Organ Fabrication - Massachusetts General Hospital, Boston, MA«.
- ↑ Langer R; Vacanti JP (Maj 1993). »Tissue engineering«. Science. 260 (5110): 920–6. Bibcode:1993Sci...260..920L. doi:10.1126/science.8493529. PMID 8493529.
- ↑ MacArthur BD; Oreffo RO (Januar 2005). »Bridging the gap«. Nature. 433 (7021): 19. Bibcode:2005Natur.433...19M. doi:10.1038/433019a. PMID 15635390.
- ↑ »NSF: Abt Report on "The Emergence of Tissue Engineering as a Research Field"«.
- ↑ »Anthony J. Atala, MD, Urology«.
- ↑ Doctors grow organs from patients' own cells, CNN, 3 April 2006
- ↑ Lab-grown cartilage fixes damaged knees - health - 5 July 2006 - New Scientist Space
- ↑ Whitney GA (Avgust 2012). »Methods for Producing Scaffold-Free Engineered Cartilage Sheets from Auricular and Articular Chondrocyte Cell Sources and Attachment to Porous Tantalum«. BioResearch Open Access. 1 (4): 157–165. doi:10.1089/biores.2012.0231.
- ↑ Macchiarini P; Jungebluth P; Go T; in sod. (december 2008). »Clinical transplantation of a tissue-engineered airway«. Lancet. 372 (9655): 2023–30. doi:10.1016/S0140-6736(08)61598-6. PMID 19022496.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Zilla, Peter; Howard Greisler (1999). Tissue Engineering Of Vascular Prosthetic Grafts. R.G. Landes Company. ISBN 1-57059-549-6.
- ↑ »Tissue Engineering«.
- ↑ »Creating artificial bone marrow«. The Economist. 7. januar 2009.
- ↑ »Artificial Penis Tissue Proves Promising in Lab Tests«.
- ↑ »Epistem.co.uk can create foreskin«. Arhivirano iz prvotnega spletišča dne 22. oktobra 2013.
{{navedi splet}}: Prezrt neznani parameter|dead-url=(predlagano je|url-status=) (pomoč) - ↑ »Foregen.org«.
- ↑ Bodnar, A. G.; Ouellette, M.; Frolkis, M.; Holt, S. E.; Chiu, C. P.; Morin, G. B.; Harley, C. B.; Shay, J. W.; Lichtsteiner, S. (16. januar 1998). »Extension of life-span by introduction of telomerase into normal human cells«. Science. 279 (5349): 349–352. doi:10.1126/science.279.5349.349. ISSN 0036-8075. PMID 9454332.
- ↑ Mertsching H, Schanz J, Steger V, Schandar M, Schenk M, Hansmann J, Dally I, Friedel G, Walles T. Generation and transplantation of an autologous vascularized bioartificial human tissue. Transplantation. 2009; 88: 203-10.
- ↑ Newman, Peter; Minett, Andrew; Ellis-Behnke, Rutledge; Zreiqat, Hala (november 2013). »Carbon nanotubes: their potential and pitfalls for bone tissue regeneration and engineering«. Nanomedicine: Nanotechnology, Biology and Medicine. Zv. 9, št. 8. str. 1139–1158. doi:10.1016/j.nano.2013.06.001. Pridobljeno 18. februarja 2015.
{{navedi revijo}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Wang, J; Wang, K; Gu, X; and Luo, Y. Polymerization of Hydrogel Network on Microfiber Surface: Synthesis of Hybrid Water-Absorbing Matrices for Biomedical Applications ACS Biomater. Sci. Eng. 2016
- ↑ Bosworth, L. A.; Turner, L. A.; Cartmell, S. H. State of the art composites comprising electrospun fibres coupled with hydrogels: a review. Nanomedicine 2013, 9, 322−335.
- ↑ Hwa Park Jung; Schwartz Zvi; Olivares-Navarrete Rene; Boyan Barbara D.; Tannenbaum Rina (2011). »Enhancement of surface wettability via the modification of microstructured titanium implant surfaces with polyelectrolytes«. Langmuir. Zv. 27. str. 5976–5985. doi:10.1021/la2000415.
- ↑ Gaharwar, AK; Peppas, NA; Khademhosseini, A (Marec 2014). »Nanocomposite hydrogels for biomedical applications«. Biotechnology and Bioengineering. Zv. 111, št. 3. str. 441–53. doi:10.1002/bit.25160. PMC 3924876. PMID 24264728.
- ↑ Ratmir D.; in sod. (2009). »Paper-Supported 3D Cell Culture for Tissue-Based Bioassays«. Proceedings of the National Academy of Sciences of the United States of America. Zv. 106, št. 44. str. 18457–18462. doi:10.1073/pnas.0910666106. PMC 2773961. PMID 19846768.
- ↑ Prestwich GD (2008). »Evaluating drug efficacy and toxicology in three dimensions: using synthetic extracellular matrices in drug discovery«. Acc Chem Res. 41 (1): 139–148. doi:10.1021/ar7000827. PMID 17655274.
- ↑ Cassidy JW (2014). »Nanotechnology in the regeneration of complex tissues«. Bone and Tissue Regeneration Insights. Zv. 5. str. 25–35. doi:10.4137/BTRI.S12331.
- ↑ Nam, Yoon Sung; Park, Tae Gwan (1999). »Biodegradable polymeric microcellular foams by modified thermally induced phase separation method«. Biomaterials. Zv. 20, št. 19. str. 1783–1790. doi:10.1016/S0142-9612(99)00073-3. Pridobljeno 23. marca 2015.
- ↑ Simon, Eric M. (1988). »NIH PHASE I FINAL REPORT: FIBROUS SUBSTRATES FOR CELL CULTURE (R3RR03544A) (PDF Download Available)«. ResearchGate (v angleščini). Pridobljeno 22. maja 2017.
- ↑ »CAD/CAM-assisted breast reconstruction«. Biofabrication. Zv. 3. september 2011. str. 034114. doi:10.1088/1758-5082/3/3/034114. PMID 21900731.
{{navedi revijo}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Jennifer Elisseeff; Peter X. Ma (2005). Scaffolding In Tissue Engineering. Boca Raton: CRC. ISBN 1-57444-521-9.
- ↑ Lee Genee; Kenny Paraic A; Lee Eva H; Bissell Mina J (2007). »Three-dimensional culture models of normal and malignant breast epithelial cells«. Nature Methods. Zv. 4. str. 359–365. doi:10.1038/nmeth1015.
- ↑ Lai Y, Asthana A, Kisaalita WS (april 2011). »Biomarkers for simplifying HTS 3D cell culture platforms for drug discovery: the case for cytokines«. Drug Discov Today. 16: 293–7. doi:10.1016/j.drudis.2011.01.009. PMID 21277382.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava)
