Kiralnost (kemija)


Királnost je geometrijska lastnost nekaterih molekul in ionov. Kiralna molekula ali kiralni ion ni identična svoji zrcalni sliki. Prisotnost asimetričnega ogljikovega centra je ena od več strukturnih značilnosti, ki povzročajo kiralnost organskih in anorganskih molekul.[1][2][3][4] Izraz kiralnost izhaja iz starogrške besede za roko – starogrško χειρ: kheir.
Zrcalne slike kiralnih molekul/ionov se imenujejo enantiomeri ali optični izomeri. Posamezni enantiomeri so pogosto imenovani bodisi kot »desni« bodisi kot »levi«. Kiralnost je pomemben dejavnik pri obravnavi stereokemije v organski in anorganski kemiji. Koncept ima velik praktični pomen, saj je večina biomolekul in zdravilnih učinkovin kiralnih.
Kiralne molekule in ione se opisujejo na različne načine, s katerimi se opredeljuje njihovo absolutno konfiguracijo, ki kodificira geometrijo neke spojine ali njeno sposobnost sukanja planarno polarizirane svetlobe, kar je pogosta metoda pri preučevanju kiralnosti.
Definicija[uredi | uredi kodo]
Kiralnost temelji na elementih molekularne simetrije. Kiralna spojina lahko na primer ne vsebuje nobene nelastne osi vrtenja (Sn), ki vključuje ravnine simetrije in inverzni center. Kiralne molekule so vedno dissimetrične (brez Sn), vendar ne vedno asimetrične (brez vseh elementov simetrije razen trivialne identitete). Asimetrične molekule so vedno kiralne.[5]
| os vrtenja (Cn) | nelastni elementi vrtenja (Sn) | ||
|---|---|---|---|
| kiralen brez Sn |
akiralen zrcalna ravnina S1 = σ |
akiralen center inverzije S2 = i | |
| C1 | 
|

|

|
| C2 | 
|

|

|
Stereogeni centri[uredi | uredi kodo]
Na splošno imajo kiralne molekule točkovno kiralnost na enem stereogenem atomu, ki ima štiri različne substituente. Reče se, da imata enantiomera take spojine na tem centru različno absolutno konfiguracijo. Ta center je torej stereogen (tj. vzrok stereoizomerije). Stereogeni atom je običajno ogljikov, zlasti v mnogih bioloških molekulah. Vendar pa kiralnost lahko obstaja na vsakem atomu, vključno s kovinskimi (kot v mnogih kiralnih koordinacijskih spojinah), fosforjevimi ali žveplovimi. Stereogeni dušik je prav tako možen, vendar pa lahko učinki inverzije dušika bistveno otežijo oziroma onemogočijo izolacijo takih spojin.
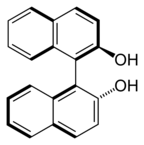
Čeprav prisotnost stereogenega centra pojasnjuje veliko večino primerov, obstaja mnogo variacij in izjem. Kiralna snov na primer ne vsebuje nujno stereogeni atom. Zgledi: 1-bromo-3-kloro-5-fluoroadamantan, metiletilfeniltetraedran, nekateri kaliksareni in fulereni, ki so inherentno kiralni. C2-simetrični zvrsti 1,1'-bi-2-nafthol (BINOL) in 1,3-dikloro-alen sta osno kiralni. (E)-ciklookten in mnogo ferocenov je planarno kiralnih.
Ko je optična rotacija enantiomra prenizka za praktično merjenje, zvrst izkazuje kriptokiralnost.
Pri preučevanju kiralnosti je treba upoštevati tudi razlike med izotopi. Nazoren zgled je derivat benzil alkohola PhCHDOH, ki je kiralen. Za S-enantiomer velja [α]D = +0.715°.[6]
V biokemiji[uredi | uredi kodo]
Številne biološko aktivne molekule so kiralne, vključno z naravnimi aminokislinami (gradniki beljakovin) in sladkorji. V bioloških sistemih je večina teh spojin enake kiralnosti: večina aminokislin je levosučnih (L), večina sladkorjev pa desnosučnih (D). D-aminokisline so v naravi zelo redke in so do sedaj bile odkrite le v majhnih peptidih, pritrjenih na celično steno bakterij.
Izvor te homokiralnosti v biologiji je predmet mnogih razprav.[7] Večina znanstvenikov verjame, da je bila »izbira« kiralnosti povsem naključna in da če še kje v vesolju obstaja življenje, osnovano na ogljiku, je njegova kiralnost lahko nasprotna naši. Vendar pa obstaja nekaj domnev, ki pravi, da naj bi zgodnje aminokisline nastale iz kometnega prahu. V tem primeru naj bi krožno polarizirano sevanje (ki sestavlja 17 % zvezdnega sevanja) povzročilo selektivno uničenje ene kiralnosti aminokislin, kar bi lahko povzročilo pristransko selekcijo in homokiralnost.[8][9]
Kiralni encimi pogosto razlikujejo med dvema enantiomeroma istega kiralnega substrata. Lahko se predstavlja, da ima encim rokavici podobno vezavno mesto, na katerega veže substrat. Če je ta rokavica desničarska, se bo en enantiomer prilegal vanjo, medtem ko se drugi ne bo in bo njegova vezava zelo malo verjetna.
L-aminokisline so po navadi brez okusa, medtem ko imajo D-aminokisline običajno sladek okus. Listi zelene mete vsebujejo L-enantiomer karvona ali R-(–)-karvon in kuminina semena vsebujejo D-enantiomer ali S-(+)-karvona.[10] Večini ljudi ta dva enantiomera dišita drugače, saj so človekovi vohalni receptorji kiralni.
Kiralnost je pomembna tudi v kontekstu urejenih faz. Dodatek majhne količine optično aktivne molekule nematski fazi (fazi, ki ima daljnosežno vrsto molekul) slednjo spremeni v kiralno nematsko fazo (ali holestrsko). Tovrstna kiralnost je bila raziskana tudi v okviru polimernih tekočin.[11]
V anorganski kemiji[uredi | uredi kodo]
Kiralnost je simetrijska lastnost, ne pa značilnost določenega dela periodnega sistema. Mnogo anorganskih materialov, molekul in ionov je torej kiralnih. Kremen je zled iz rudninskega sveta. Taki brezcentrski materiali so zanimivi za nelinearno optiko.
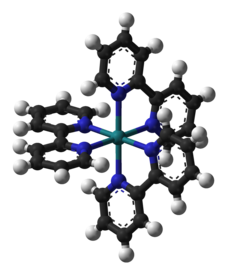
Na področju koordinacijske kemije in organokovinske kemije je kiralnost prodornega in praktičnega pomena. Znan zled je kompleks tris(bipiridin)rutenij(II), v katerem se trije bipiridinski ligandi razporedijo v obliki kiralnega propelerja.[12] Enantiomera kompleksov, kot je [Ru(2,2'-bipiridin)3]2+, se lahko imenuje Λ (velika grška črka lambda, grški »L«) za levosučni propeler iz ligandov in Δ (velika grška črka delta, grški »D«) za desnosučnega (na sliki).
Kiralni ligandi lahko kovinskemu kompleksu dodelijo kiralnost, kot je razvidno iz kovinsko-aminokislinskih kompleksov. Če kovina izkazuje katalitske lastnosti, je njegova kombinacija s kiralnim ligandom osnova asimetrične katalize.[13]
Metode in prakse[uredi | uredi kodo]
Izraz optična aktivnost izhaja iz interakcije kiralnih materialov s polarizirano svetlobo. Levosučna ali (−)-oblika nekega optičnega izomera v raztopini suka ravnino žarka linearno polarizirane svetlobe v nasprotni smeri urnega kazalca. Desnosučna ali (+)-oblika nekega optičnega izomera pa nasprotno. Rotacija svetlobe se meri s pomočjo polarimetra in je izražena kot optična rotacija.
Razna nomenklatura[uredi | uredi kodo]
- Vsaka neracemska kiralna snov se imenuje skalemična. Skalemični materiali so lahko enantiočisti ali enantioobogateni.[14]
- Kiralna snov je enantiočista, ko je le eden od dveh možnih enantiomerov prisoten, tako da imajo vsi delci v vzorcu enako kiralnost. Uporaba izraza homokiralen kot sopomenka se močno odsvetuje.[15]
- Kiralna snov je enantioobogatena ali heterokiralna, ko je njeno enantiomerno razmerje večje od 50 : 50, vendar manjše od 100 : 0.[16]
- Enantiomerni presežek ali ee (angl. enantiomeric excess) je razlika med tem, koliko enega enantiomera je prisotnega v primerjavi z drugim. Na primer vzorec s 40 % ee R vsebuje 70 % R in 30 % S (70 % − 30 % = 40 %).[17]
Zgodovina[uredi | uredi kodo]
Sukanje planarno polarizirane svetlobi s strani kiralnih snovi je leta 1815 prvi opazoval Jean-Baptiste Biot,[18] pozneje je to sukanje pridobilo veliko pomembnost v sladkorni industriji, analizni kemiji in farmacevtskih izdelkih. Louis Pasteur je leta 1848 sklepal, da ima ta pojav molekularne osnove.[19][20] Sam izraz kiralnost je leta 1894 skoval lord Kelvin.[21] Različni enantiomeri ali diastereomeri neke spojine so bili najprej imenovani optični izomeri zaradi svojih različnih optičnih lastnosti.[22] Na neki točki je bila kiralnost povezana zgolj z organsko kemijo, vendar je to zmotno prepričanje ovrgel Alfred Werner z dognanji o popolnoma anorganski spojini heksolu.
Glej tudi[uredi | uredi kodo]
- kiralnost (matematika)
- kiralnost (fizika)
- enantiočista učinkovina
- enantioselektivna sinteza
- Pfeifferjev efekt
- stereokemija
- stereoizomerija
- supramolekularna kiralnost
Sklici[uredi | uredi kodo]
- ↑ Organic Chemistry (4th Edition) Paula Y. Bruice. Pearson Educational Books. ISBN 9780131407480
- ↑ Organic Chemistry (3rd Edition) Marye Anne Fox, James K. Whitesell Jones & Bartlett Publishers (2004) ISBN 0763721972
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Chirality".
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Superposability".
- ↑ Cotton, F. A., "Chemical Applications of Group Theory," John Wiley & Sons: New York, 1990.
- ↑ ^ Streitwieser, A. Jr.; Wolfe, J.R. Jr.; Schaeffer, W.D. (1959). »Stereochemistry of the Primary Carbon. X. Stereochemical Configurations of Some Optically Active Deuterium Compounds«. Tetrahedron. Zv. 6, št. 4. str. 338–344. doi:10.1016/0040-4020(59)80014-4.
- ↑ Meierhenrich, Uwe J. (2008). Amino acids and the Asymmetry of Life. Berlin, GER: Springer. ISBN 3540768858.
- ↑ McKee, Maggie (24. avgust 2005). »Space radiation may select amino acids for life«. New Scientist. Pridobljeno 5. februarja 2016.
- ↑ Meierhenrich, Uwe J.; Nahon, Laurent; Alcaraz, Christian; Bredehöft, Jan Hendrik; Hoffmann, Søren V.; Barbier, Bernard; Brack, André (2005). »Asymmetric Vacuum UV photolysis of the Amino Acid Leucine in the Solid State«. Angew. Chem. Int. Ed. Zv. 44. str. 5630–5634. doi:10.1002/anie.200501311.
- ↑ Theodore J., Leitereg; Dante G., Guadagni; Harris, Jean; Mon, Thomas R.; Teranishi, Roy (1971). »Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones«. J. Agric. Food Chem. Zv. 19, št. 4. str. 785–787. doi:10.1021/jf60176a035.
- ↑ Srinivasarao, M. (1999). »Chirality and Polymers«. Current Opinion in Colloid and Interface Science. Zv. 4, št. 5. str. 369–376. Predloga:Full citation needed
- ↑ von Zelewsky, A. (1995). Stereochemistry of Coordination Compounds. Chichester: John Wiley.. ISBN 047195599X.
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 189138953X
- ↑ Eliel, E.L. (1997). »Infelicitous Stereochemical Nomenclatures«. Chirality. Zv. 9. str. 428–430. doi:10.1002/(sici)1520-636x(1997)9:5/6<428::aid-chir5>3.3.co;2-e. Arhivirano iz prvotnega spletišča dne 3. marca 2016. Pridobljeno 5. februarja 2016.
- ↑ IUPAC, Compendium of Chemical Terminology, 2. izd. (the "Gold Book") (1997). Spletna izdaja: (2006–) "asymmetric synthesis". DOI: 10.1351/goldbook.E02072
- ↑ IUPAC, Compendium of Chemical Terminology, 2. izd. (the "Gold Book") (1997). Spletna izdaja: (2006–) "enantiomerically enriched (enantioenriched)". DOI: 10.1351/goldbook.E02071
- ↑ IUPAC, Compendium of Chemical Terminology, 2. izd. (the "Gold Book") (1997). Spletna izdaja: (2006–) "enantiomer excess (enantiomeric excess)". DOI: 10.1351/goldbook.E02070
- ↑ Akhlesh Lakhtakia (1990). Selected papers on natural optical activity. Bellingham, Washington, USA : SPIE Optical Engineering Press. ISBN 9780819404350.
- ↑ Pasteur, L. (1848). »Researches on the molecular asymmetry of natural organic products, English translation of French original, published by Alembic Club Reprints (Vol. 14, pp. 1–46) in 1905, facsimile reproduction by SPIE in a 1990 book«.
{{navedi revijo}}: Sklic magazine potrebuje|magazine=(pomoč) - ↑ Eliel, Ernest L.; Wilen, Samuel H.; Mander, Lewis N. (1994). »Chirality in Molecules Devoid of Chiral Centers (Chapter 14)«. Stereochemistry of Organic Compounds (1. izd.). New York, NY, USA: Wiley & Sons. ISBN 0471016705. Pridobljeno 2. februarja 2016.
- ↑ Bentley, Ronald (1995). »From Optical Activity in Quartz to Chiral Drugs: Molecular Handedness in Biology and Medicine«. Perspect. Biol. Med. Zv. 38, št. 2. str. 188–229. doi:10.1353/pbm.1995.0069. PMID 7899056.
- ↑ IUPAC, Compendium of Chemical Terminology, 2. izd. (the "Gold Book") (1997). Spletna izdaja: (2006–) "Optical isomers". DOI: 10.1351/goldbook.O04308
Nadaljnje branje[uredi | uredi kodo]
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic Chemistry (2. izd.). Oxford, UK: Oxford University Press. str. 319f, 432, 604np, 653, 746int, 803ketals, 839, 846f. ISBN 0199270295. Pridobljeno 2. februarja 2016.
- Eliel, Ernest L.; Wilen, Samuel H.; Mander, Lewis N. (1994). »Chirality in Molecules Devoid of Chiral Centers«. Stereochemistry of Organic Compounds (1. izd.). New York, NY, USA: Wiley & Son. doi:10.1002/(SICI)1520-636X(1997)9:5/6<428::AID-CHIR5>3.0.CO;2-1. ISBN 0471016705.
- Eliel, E.L. (1997). »Infelicitous Stereochemical Nomenclatures«. chirality. Zv. 9. str. 428–430. doi:10.1002/(SICI)1520-636X(1997)9:5/6<428::AID-CHIR5>3.0.CO;2-1. Arhivirano iz prvotnega spletišča dne 3. marca 2016. Pridobljeno 5. februarja 2016.
- Gal, Joseph (2013). »Molecular Chirality: Language, History, and Significance«. Differentiation of Enantiomers I. Chirality. Topics in Current Chemistry. Zv. 340. str. 1–20. Pridobljeno 5. februarja 2016.
Zunanje povezave[uredi | uredi kodo]
- 21st International Symposium on Chirality
- STEREOISOMERISM - OPTICAL ISOMERISM
- Symposium highlights-Session 5: New technologies for small molecule synthesis
- IUPAC nomenclature for amino acid configurations.
- Michigan State University's explanation of R/S nomenclature Arhivirano 2016-05-21 at the Portuguese Web Archive
- Chirality & Odour Perception at leffingwell.com
- Chirality & Bioactivity I.: Pharmacology
- Chirality and the Search for Extraterrestrial Life
- The Handedness of the Universe by Roger A Hegstrom and Dilip K Kondepudi http://quantummechanics.ucsd.edu/ph87/ScientificAmerican/Sciam/Hegstrom_The_Handedness_of_the_universe.pdf
