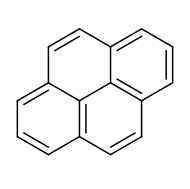
Piren
| |

| |
| Imena | |
|---|---|
| IUPAC ime
piren
| |
| Druga imena
benzo[def]fenantren
| |
| Identifikatorji | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.004.481 |
| KEGG | |
PubChem CID
|
|
| RTECS število |
|
CompTox Dashboard (EPA)
|
|
| |
| Lastnosti | |
| C16H10 | |
| Molska masa | 202,25 g/mol |
| Videz | brezbarvna trdna snov
(v veliko vzorcih se nahajajo rumene nečistoče v sledovih) |
| Gostota | 1,271 g/ml |
| Tališče | 145-148 °C (418-421 K) |
| Vrelišče | 404 °C (677 K) |
| 0,135 mg/l | |
| Nevarnosti | |
| Glavne nevarnosti | dražilen |
| R-stavki (zastarelo) | 36/37/38-45-53 |
| S-stavki (zastarelo) | 24/25-26-36 |
| NFPA 704 (diamant ognja) | |
| Plamenišče | nevnetljiv |
| Sorodne snovi | |
| Sorodno (PAO) | benzopiren |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |

Piren je policiklični aromatski ogljikovodik (PAO), sestavljen iz štirih spojenih benzenovih obročev, kar se kaže v ravninski obliki aromatske molekule. Kemična formula je C16H10. Ta brezbarvna trdna snov je najmanjši peri-spojeni PAO (molekula, kjer so obroči spojeni z več kot eno stranjo). Piren nastaja pri nepopolnem zgorevanju organskih snovi.
Pojavljanje in reaktivnost[uredi | uredi kodo]
Piren je bil prvič izoliran iz premogovega katrana, kjer se pojavi v do 2 % teže. Kot peri-spojeni PAO je piren veliko bolj resonančno stabilen kot njegov 5-obročni izomer fluoroanten. Torej se ga da ustvariti v velikem spektru pogojev za zgorevanje. Na primer, avtomobili ga proizvedejo okrog 1 mikrogram/km. Oksidacija s kromatom poteka prek perinaftenona do naftalen–1,4,5,8–tetrakarboksilne kisline. Dovzeten je za mnogo reakcij hidrogeniranja (spajanja z vodikom) in je občutljiv na halogeniranje, Diels-Alderjeve adicije in nitriranje, pri vseh z visoko stopnjo selektivnosti.[1]
Uporaba[uredi | uredi kodo]
Piren in njegovi derivati se komercialno uporabljajo za pridobivanje barvil, na primer piranina in naftalen-1,4,5,8-tetrakarboksilne kisline. Njegovi derivati so prav tako dragocene molekularne sonde za fluorescenčno spektroskopijo, ker imajo visoko kvantno vrednost in življenjsko dobo (0,65 in 410 nanosekund, v etanolu pri 293 K). Njegov spekter emisivne fluorescenčne svetlobe je zelo občutljiv na vpliv polarnosti topila, zato se uporablja kot sonda za zaznavanje okolja pri raztapljanju. To mu omogoča dejstvo, da je njegova molekula v vzbujenem stanju neplanarne (neravninske) oblike, za razliko od molekule v osnovnem stanju, ki je planarna. Določeni emisijski traki so nespremenljivi, drugi pa se spreminjajo v intenzivnosti glede na moč interakcije s topilom.
Varnost[uredi | uredi kodo]
Čeprav ni tako problematičen kot benzopiren, so raziskave na živalih pokazale, da je škodljiv za ledvice in jetra.
Glej tudi[uredi | uredi kodo]
Zunanje povezave[uredi | uredi kodo]
Viri[uredi | uredi kodo]
- ↑ Selim Senkan and Marco Castaldi "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, 2003 Wiley-VCH, Weinheim. Datum objave na spletu: 15. 3. 2003.
- Birks, J. B. (1969). Photophysics of Aromatic Molecules. London: Wiley.
- Valeur, B. (2002). Molecular Fluorescence: Principles and Applications. New York: Wiley-VCH.
- Birks, J.B. (1975). Eximers. london: Reports on Progress in Physics.
- Fetzer, J. C. (2000). The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley.

