Tirno kvantno število
Orbitalno kvantno število (tudi azimutno kvantno število ali drugo kvantno število) je eno izmed kvantnih števil, ki se uporabljajo v kvantni mehaniki za opis kvantnih stanj elektrona v atomu. Orbitalno kvantno število označujemo z . Za vsak lahko zavzame samo števila med 0 in -1
- ali
Z orbitalnim kvantnim številom se določa vrtilno količino in s tem tudi oblika tirnice elektrona oziroma elektronskega oblaka v atomu. Določa podlupine v okviru posameznih lupin z danim glavnim kvantnim številom.
Ostala kvantna števila elektrona v atomu so še (glavno kvantno število ali n), (magnetno kvantno število ali m) in (spinsko kvantno število ali s). Vsa kvantna števila enolično določajo kvantno stanje posameznega elektrona v atomu. Dva elektrona v istem atomu ne moreta imeti istih vseh štirih kvantnih števil (glej Paulijevo izključitveno načelo). Štiri kvantna števila enolično določajo kvantno stanje posameznega elektrona v atomu ali njegovo valovno funkcijo ali orbitale. Schrödingerjeva enačba se lahko napiše v obliki treh enačb, ki vodijo do prvih treh kvantnih števil. Orbitalno kvantno število dobimo iz rešitve polarnega dela valovne enačbe.
Vrtilna količina je povezana z orbitalnim kvantnim številom na naslednji način
Kjer je operator vrtilne količine, je valovna funkcija in je Planckova konstanta deljena z 2. (reducirana Planckova konstanta).
Podlupine označujemo tudi s črkovnimi oznakami:
| vrednost | oznaka | angleško ime |
maksimalno število elektronov |
oblika elektronskega oblaka |
|---|---|---|---|---|
| 0 | s | sharp | 2 | krogla |
| 1 | p | principal | 6 | 2 ročki (glej spodaj) |
| 2 | d | diffuse | 10 | 4 ročke |
| 3 | f | fundamental | 14 | 8 ročk |
| 4 | g | 18 | ||
| 5 | h | 22 | ||
| 6 | i | 26 |
Oblike orbital oziroma valovnih funkcij za posamezna kvantna števila n, l, m so naslednje:
| s (l=0) | p (l=1) | d (l=2) | f (l=3) | |
|---|---|---|---|---|
| n=1 | 
|
|||
| n=2 | 
|

|
||
| n=3 | 
|

|

|
|
| n=4 | 
|
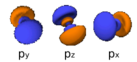
|

|

|
| n=5 | 
|

|

|
. . . |
| n=6 | 
|

|
. . . | . . . |
| n=7 | 
|
. . . | . . . | . . . |











