Karbokation



Karbokation je ion s pozitivno nabitim ogljikovim atomom.
Med najbolj enostavne karbokatione spadajo metenij CH+
3, metanij CH+
5 in etanij C
2H+
7. Nekateri karbokationi imajo tudi dva ali več potitivnih nabojev na enem ali več ogljikovih atomih. Takšen je na primer etilen dikation C
2H2+
4.[1]
Do 1970. let so se vsi karbokationi imenovali karbonijevi ioni.[2] Po sedanji definiciji so karbokationi vsi pozitivno nabiti ogljikovi atomi, ki so razdeljeni v dve glavni kategoriji, odvisno od valence nabitega ogljikovega atoma. Atomi z valenco 3 so karbenijevi ioni (protonirani karbeni), z valenco 5 ali 6 pa karbonijevi ioni (protonirani alkani, imenovani analogno z amonijevin ionom). Takšno poimenovanje je predlagal madžarski in ameriški kemik George Andrew Olah.[3]
Terminologija
[uredi | uredi kodo]Nekateri univerzitetni učbeniki obravnavajo vse karbokatione kot karbenijeve ione[4] ali pa jih obravnavajo bežno in skladno s starejšo terminologijo.[5][6] Nekateri učbeniki so za karbenijeve ione obdržali stara imena in za metanij CH+
5 uporabljajo naziv hipervalentni karbenijev ion.[7]
Zgodovina
[uredi | uredi kodo]Zgodovina karbokationov se je začela leta 1891, ko je G. Merling[8] objavil, da je tropilidenu (cikloheptatrien) dodal brom in ga segreval, pri čemer je nastal vodotopen kristaliničen produkt. O njegovi strukturi ni poročal, Doering in Knox[9] pa sta dokazala, da je pridobil tropilij (cikloheptatrienil)bromid C7H7Br. Ion je po Hücklovem pravilu aromatski.
Leta 1902 sta Norris in Kehrman neodvisno eden od drugega odkrila, da tvori brezbarvni trifenilmetanol v koncentrirani žveplovi kislini intenzivno rumene raztopine. Na podoben način tvori trifenilmetilni ion z aluminijevim in kositrovim kloridom oranžne komplekse. Istega leta je Adolf von Baeyer odkril, da imajo produkti značilnosti soli.

Karbokationi so reaktivni vmesni produkti v mnogih organskih reakcijah. To idejo je prvi objavil Julius Stieglitz leta 1899.[10] Dodelal jo je Hans Meerwein v svoji študiji Wagner-Meerweinove premestitev leta 1922.[11][12] Za karbokatione so ugotovili, da so vključeni tudi v nukleofilne substiticije (SN1) in eliminacije (E1), kar je takratna uradna kemija nerada sprejela. Journal of the American Chemical Society je celo zavračal članke, v katerih so bili omenjeni.
Prvi jedrski magnetni resonančni spekter (JMR) stabilnega karbokationa v raztopini je objavil Doering s sodelavci leta 1958.[13] To je bil heptametilbenzenijev ion, ki so ga dobili z obdelavo heksametilbenzena z metil kloridom in aluminijevim kloridom. Story in sodelavci so leta 1960 iz norbornadienil korida in srebrovega tetrafluoroborata v žveplovem dioksidu pri −80 °C pripravili stabilen 7-norbornadienilni kation.[14] JMR spekter je pokazal, da gre za prvi stabilen neklasičen ion.
Leta 1962 je Olah z JMR neposredno opazoval stabilen terc-butilni karbokation, ki ga je dobil z raztapljajem terc-butil floorida v magični kislini. O JMR spektru norbonilnega kationa je prvi poročal Schleyer s sodelavci leta 1964.[15]
Zgradba in lastnosti
[uredi | uredi kodo]Električno nabiti ogljikov atom v karbokationu ima na zunanji (valenčni) orbitali samo šest elektronov (sekstet) namesto idealnih osmih (oktet), ki bi mu dali maksimalno stabilnost (pravilo okteta). Karbokationi so zaradi tendence, da bi zapolnili valenčno orbitalo in dosegli nevtralen naboj, pogosto reaktivni. Upravičeno bi pričakovali, da ima karbokation hibridizacijo sp3 s prazno orbitalo sp3, ki bi mu dala pozitiven naboj. Njegova reaktivnost v nasprotju s pričakovanji kaže, da je bolj podobna hibridizaciji sp2 s trikotno plosko molekularno geometrijo. Takšen primer je metilni kation CH+
3.
Karbokationi so pogosta tarča nukleofilnih napadov nukleofilov, na primer hidroksidnih ionov (OH-) ali ionov halogenov.

Za karbokatione so značilne premestitve oziroma preureditve manj stabilnih struktur v enako ali bolj stabilne strukture. Konstante reakcijskih hitrosti lahko presežejo vrednosti 109/s, kar pogosto zakomplicira sintezne poti številnih spojin. Primer: če 3-pentanol segrevamo z vodno HCl, najprej nastane 3-pentilni karbokation, ki se preuredi v statistično zmes 3-pentila in 2-pentila. Ti karbokationi, ki v naslednjem koraku reagirajo s kloridnimi ioni, proizvedejo približno 1/3 3-kloropentana in približno 2/3 2-kloropentana.
Karbokation se lahko stabilizira z resonanco dvojne vezi ogljik-ogljik ob ioniziranem ogljikovem atomu. Takšni kationi, na primer alilni kation CH2=CH–CH+
2 in benzilni kation C6H5–CH+
2, so bolj stabilni kot večina drugih karbokationov. Molekule, ki lahko tvorijo alilne ali benzilne katione, so še posebej reaktivne. Karbokationi, v katerih je C+ ob ogljikovem atomu z dvojno ali celo trojno vezjo, so izredno stabilni zaradi prekrivanja prazne p orbitale karbokationa s p orbitalami π vezi. Prekrivanje orbital omogoči delitev naboja med več atomov, se pravi delokalizacijo naboja, kar karbokation stabilizira.
Neklasični ioni
[uredi | uredi kodo]Nekateri karbokationi, na primer norbonil, imajo tri bolj ali manj simetrične vezne centre. Tovrstni kationi se prištevajo k neklasičnim ionom. Razlika energij med klasičnimi karbokationi in neklasičnimi izomeri je pogosto zelo majhna in na splošno majhna. Primer: neklasična oblika 2-butil karbokationa je v bistvu 2-buten s protonom točno nad središčem tistega, kar naj bi bila dvojna vez ogljik-ogljik. Neklasični karbokationi so bili dolgo časa predmet velikih prerekanj, ki jih je v največji meri odpravil Nobelov nagrajenec za kemijo (1994) George Olah.[16]
Specifični karbokationi
[uredi | uredi kodo]Ciklopropilkarbinilni kationi se lahko preučujejo z JMR.[17][18]
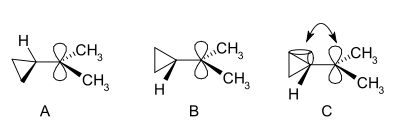
V JMR spektru dimetil derivata so za dve metilni skupini odkrili dva neekvivalentna signala, kar kaže, da molekularna konformacija tega kationa ni pravokotna (kot v A), ampak je razpolovljena (kot v B) s prazno s prazno p orbitalo in ciklopropilnim obročnim sistemom v isti ravnini:
Z vidika teorije upognjene vezi se to preferenco lahko pojasni z bolj ugodnim prekrivanjem orbiral med zapolnjenimi ukrivljenimi vezmi ciklopropana in prazno p orbitalo.[19]
Sklici
[uredi | uredi kodo]- ↑ H. Grützmacher, C.M. Marchand (1997), Heteroatom stabilized carbenium ions. Coordination Chemistry Reviews 163: 287-344. doi: 10.1016/S0010-8545(97)00043-X.
- ↑ Carbonium ion. IUPAC Gold Book.
- ↑ G.A. Olah (1972). Stable carbocations. Journal of the American Chemical Society 94 (3): 808–820. doi: 10.1021/ja00758a020.
- ↑ J. McMurry. Organic chemistry (5. izdaja). ISBN 0-534-37617-7.
- ↑ P.Y. Bruice. Organic Chemistry (4. izdaja). ISBN 0-13-140748-1.
- ↑ J. Clayden, N. Greeves, S. Warren, P. Wothers (2001). Organic Chemistry (1. izdaja). Oxford University Press. ISBN 978-0-19-850346-0.
- ↑ M.A. Fox, J.K. Whitesell. Organic Chemistry. ISBN 0-7637-0413-X.
- ↑ Chem. Ber. 24 , 3 (1891).
- ↑ W.E. von Doering, L.H. Knox (1954). The Cycloheptatrienylium (Tropylium) Ion. J. Am. Chem. Soc. 76 (12): 3203 - 3206; doi: 10.1021/ja01641a027.
- ↑ On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives. Am. Chem. J. 21: 101. ISSN: 0096-4085.
- ↑ H. Meerwein, K. van Emster (1922). Berichte 55: 2500.
- ↑ H.S. Rzepa, C.S.M. Allan (2010). Racemization of Isobornyl Chloride via Carbocations: A Nonclassical Look at a Classic Mechanism. Journal of Chemical Education 87 (2): 221. Bibcode: 2010JChEd..87..221R. doi: 10.1021/ed800058c.
- ↑ W.E. von Doering, M. Saunders, H.G. Boyton, H.W. Earhart, E. F. Wadley, W.R. Edwards (1958). The 1,1,2,3,4,5,6-heptamethylbenzenonium ion. Tetrahedron 4 (1-2): 178-185. doi: 10.1016/0040-4020(58)88016-3.
- ↑ P.R. Story, M. Saunders (1960). The 7-norbornadienyl carbonium ion. J. Am. Chem. Soc. 82 (23): 6199 – 6199. doi: 10.1021/ja01508a058.
- ↑ P.R. von Schleyer, W.E. Watts, R.C. Fort, M.B. Comisarow, G.A. Olah (1964). Stable Carbonium Ions. X.1 Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation. J. Am. Chem. Soc. 86 (24): 5679 – 5680. doi: 10.1021/ja01078a056.
- ↑ G.A. Olah. My Search for Carbocations and Their Role in Chemistry. Predavanje ob podelitvi Nobelove nagrade. 8. december 1994.
- ↑ D.S. Kabakoff, E. Namanworth (1970). Nuclear magnetic double resonance studies of the dimethylcyclopropylcarbinyl cation. Measurement of the rotation barrier. J. Am. Chem. Soc. 92 (10): 3234–3235. doi: 10.1021/ja00713a080.
- ↑ C.U. Pittman ml., G.A. Olah (1965). Stable Carbonium Ions. XVII.1a Cyclopropyl Carbonium Ions and Protonated Cyclopropyl Ketones. J. Am. Chem. Soc. 87 (22): 5123–5132. doi: 10.1021/ja00950a026.
- ↑ F.A. Carey, R.J. Sundberg. Advanced Organic Chemistry. Part A. Druga izdaja.