Freon
| Članek potrebuje lekturo pravopisa, vrstnega reda besed, tona ali sloga. (mesec ni naveden) |
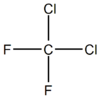
Freon je zbirno ime za več vrst plinov, ki se uporabljajo v hladilnih strojih.
Freoni so fluorovi in klorovi derivati metana in etana, plinov iz skupine halogen alkanov, ki so se uporabljali v hladilnih tehnikah kot hladila. Kratice za najpomembnejše tipe freonov so CFC ali HCFC.
Najbolj poznana freona sta R-12 in R-22, ki sta najpomembnejša v proizvodnji hladilnih sistemov. Freoni so v vodi netopni, vendar prodirajo visoko v stratosfero (plast Zemljinega ozračja v višini med 15 in 50 km nad zemeljsko površino), ker so inertni v kemičnih reakcijah.
Čeprav je napačno, se je to ime začelo uporabljati za skoraj vse vrste hladilnih medijev, ne glede na njihovo kemično sestavo. Zaradi tega je prišlo do prav absurdnih situacij, da se freonom imenujejo tudi plini, kot so metan, etan, propan in podobno.
Značilnosti
[uredi | uredi kodo]Freon je nevnetljiv plin brez barve, vonja, okusa in ni strupen. To je dokazal Thomas Midgley z vdihavanjem tega plina in izpihavanjem v odprt plamen sveče. Za svoje namene je plin izpolnil vsa pričakovanja, a namembnost ni potreboval iskati, saj je namembnost našla njega. Do leta 1935, pet let od odkritja Freona, je bilo prodanih čez 8 milijonov hladilnikov. Nekaj desetletij po odkritju freona so odkrili njegovo škodljivost za celotno življenje na Zemlji, čeprav je za to njegov izumitelj Thomas Midgley vedel že od samega začetka. Osvinčen bencin, enega največjih onesnaževalcev atmosfere, je odkril isti izumitelj.
Škodljivost
[uredi | uredi kodo]Ozon je altropska modifikacija kisika, ki je od le-tega lažji. Nahaja se 15–20 km nad zemeljsko površino in ustvarja sloj, ki nas ščiti pred UV žarki. Brez njega bi izumrlo celotno življenje na zemlji. Freon je prav tako kot ozon lažji od zraka, kar pomeni da se bo v atmosfero povzpel do ozona, kjer bo ostal in reagiral. Ko se ena molekula freona CCl3F(g) povzpne do ozonskega sloja, bo izpostavljena UV žarkom, kar bo privedlo do razpadanja molekule na CCl2F(g) + Cl(g). Dalje bojo te razpadle molekule reagirale direktno z ozonom Cl(g) + O3(g) --> ClO(g) + O2(g) , ClO(g) + O(g) --> O2(g) + Cl(g) Iz tega lahko zaključimo, da ena molekula freona lahko uniči veliko molekul ozona. Z merjenjem je ugotovljeno, da ena molekula freona v atmosferi ostaja 50 do 100 let, kar nas prevede do zaključka, da bomo zaradi posledic uporabe freona trpeli še dolgo. Edina dolgoročna rešitev problema je izpodrivanje freona iz uporabe, oz. iskanje ali koriščenje obstoječih alternativ.
Zgodovina
[uredi | uredi kodo]Za hladilnike, ki so obstajali v tridesetih let dvajsetega stoletja,so za hladilno sredstvo uporabljali strupene pline: amonijak (NH3), klorometan ali metilni klorid (CH3Cl ali R-40 ali HCC 40) in žveplov dioksid (SO2). Po velikih nezgodah, ki jih je povzročilo curljanje iz hladilnikov, so se jih ljudje počasi znebili. Tako so tri znane svetovne tovarne vidle možnost za inovacijo in dobiček, zato so združile moč in se osredotočile na manj nevarne hladilne metode. Ta podjetja so se imenovala Frigidaire, DuPont i General Motors.
Leta 1928 je Thomas Midgley Ml., pomočnik Charlesa Franklina Ketteringa izumil 'čarobno mešanico' sestavljeno iz nekaj različnih fluorokloroalkanov (CFC) ki jo je imenoval Freon.
Vrste
[uredi | uredi kodo]Odvisno od namembnosti, se koristijo različne vrste freona:
Freon 12
[uredi | uredi kodo]
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
Diklordifluormetan
| |||
| Druga imena
Karbon diklorid difluorid, Dikloro-difluor-metan, Diklordifluormetan
, Freon 12, R-12, CFC-12, P-12, Propellant 12, Halon 122, Arcton 6, Arcton 12, E940
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| EC število |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
| UN število | 1028 | ||
| |||
| |||
| Lastnosti | |||
| CCl2F2 | |||
| Molska masa | 120.91 g/mol | ||
| Videz | Brezbarvni plin z vonjem po etru | ||
| Gostota | 1.486 g/cm³ (−29.8 °C) | ||
| Tališče | −157.7 °C (115.5 K) | ||
| Vrelišče | −29.8 °C (243.3 K) | ||
| 0.286 g/l at 20 °C | |||
| log P | 2.16 | ||
| Parni tlak | 568 kPa (20 °C) | ||
| kH | 0.0025 mol kg-1 bar-1 | ||
| Nevarnosti | |||
| Glavne nevarnosti | Tanjšanje ozonskega plašča | ||
| Plamenišče | Negorljiv | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Freon 12 ali R-12 (Diklordifluormetan), kemijske oznake je najpogosteje uporabljen plin CFC tipa, in nekoč je bil osnovni plin v hladilnih sistemih, uporabljali so ga tudi kot sredstvo za čiščenje, pogonsko sredstvo v steklenicah pod tlakom (razni spreji). Uporaba freona 12 se je prepovedala leta 1987 po protokolu iz Montreala zaradi velikega vpliva na ozonski plašč. Freon se je uporabljal od leta 1930.
Fizikalne lastnosti
[uredi | uredi kodo]| Gostota | Vrednost |
|---|---|
| Gostota (ρ) pri -29.8 °C (gas) | 6.25 kg.m−3 |
| Gostota (ρ) pri 15 °C (gas) | 5.11 kg.m−3 |
| Trojne temperaturne točke temperature (Tt) | -157 °C (116 K) |
| Trojne točke pritiska (pt) | 10 Pa (0.00010 bar) |
| Kritična temperatura (Tc) | 112 °C (385 K) |
| Kritični tlak (pc) | 4.170 MPa (41.15 bar) |
| Kritična gostota (ρc) | 4.789 mol.l−1 |
| Latentno izparevanje ob vročini (lv) | 166.95 kJ.kg−1 |
| Specifična vročinska kapaciteta ob (Cp) ob konstantnem tlaku 30 °C | 74 J.mol−1.K−1 |
| Specifična vročinska kapacitetaob konstantnem volumnu (Cv) at 30 °C | 65 J.mol−1.K−1 |
| Razmerje toplotne kapacitete (κ) pri 30 °C | 1.138889 |
| Parni tlak (η) pri -20 °C | 151 kPa |
| Parni tlak (η) pri 0 °C | 300 kPa |
| Parni tlak (η) pri 16 °C | 500 kPa |
| Parni tlak (η)pri 20 °C | 567 kPa |
| Parni tlak (η) pri 40 °C | 960 kPa |
| Faktor stisljivosti (Z) pri 21 °C | 0.995 |
| Viskoznost (μ) pri 0 °C | 11.68 μPa.s (0.01168 cP) |
| Toplotna prevodnost (k)pri 0 °C | 9.46 mW.m−1.K−1 |
| Sposobnost tanjšanja ozonskega plašča (ODP) | 1.0 (CFC3F = 1) |
| Potencialnost globalnega segrevanja (GS) | 8100 (CO2 = 1) |
Freon 22
[uredi | uredi kodo]
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
Klorodifluorometan
| |||
| Druga imena
Difluoromonochlorometan, Monoklorodifluorometan, HCFC-22, R-22, Genetron 22, Freon 22, Arcton 4, Arcton 22, UN 1018
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| EC število |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| |||
| |||
| Lastnosti | |||
| CHClF2 | |||
| Molska masa | 86.47 g/mol | ||
| Videz | Brezbarvni plin | ||
| Gostota | 3.66 kg/m3 at 15 °C, gas | ||
| Tališče | -175.42 °C (97.73 K) | ||
| Vrelišče | -40.7 C (232.45 K) | ||
| 0.7799 vol/vol at 25 °C; 3.628 g/l | |||
| log P | 1.08 | ||
| Parni tlak | 908 kPa at 20 °C | ||
| kH | 0.033 mol.kg-1.bar-1 | ||
| Struktura | |||
| Oblika molekule | Tetrahedral | ||
| Nevarnosti | |||
| Glavne nevarnosti | Nevaren za oklolje(N), Centralni živčni sistem | ||
| R-stavki (zastarelo) | Predloga:R59 | ||
| S-stavki (zastarelo) | (S23), S24, S25, R59 | ||
| NFPA 704 (diamant ognja) | |||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Freon 22 ali R-22 (Klordifluormetan) kemične oznake je podoben R-12, ampak namesto enega atoma klora ima atom vodika. Uporabljal se je zelo pogosto, bil pa je tudi prva primerna zamenjava za R-12 ker je njegov vpliv na plašč samo 10% vpliva R-12. Freon 22 je danes izključen iz uporabe.
Fizikalne in kemične lastnosti
[uredi | uredi kodo]
Vrelišče:-40,8 °C
Tališče:-160 °C
Gostota: (0 oC, p=1,013 bar): 1,194 kg/l (tekočina)
Parni tlak pri 20 °C: 1043,9 kPa
Topnost v vodi: 3,0 g/l
Izgled: Brezbarvna tekočina. Pri sobni temperaturi brezbarven plin.
Vonj: po etru
Temperatura samovžiga: ni vnetljiv
Meje eksplozivnosti (vol.% v zraku): ni eksploziven
pH vrednost (pri g/l H2O): nevtralna
Viskoznost: 0,000127 mPa.s (tekočina)
Obstojnost in reaktivnost
[uredi | uredi kodo]
Stabilnost: Ni razkrajanja pri namenski uporabi.
Materiali, katerim se je treba izogibati: alkalijske kovine, zemeljske alkalijske kovine, praškaste kovinske soli,
praškasti Al, Zn, Be, itd.
Nevarni produkti razpada: halogen-vodik, sledovi karbonil-halogenidov
Toksični podatki
[uredi | uredi kodo]
Akutna toksičnost: LC50/inhalativen/4h/podgana = 220 ml/l.
Lokalni učinki: Koncentracije bistveno nad eksplozijsko mejno vrednostjo lahko delujejo
narkotično. Vdihavanje razkrojnih produktov v visokih koncentracijah lahko povzroči
kratko sapo (pljučni edem).
Dolgoročna toksičnost: Pri poskusih na živalih se ni pokazal kancerozni učinek, učinek sprememb dedne
zasnove; neg. vpliv na plodnost.
Specifični učinki:
Hitro izparevanje tekočine lahko povzroči ozebline.
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
1,1,1,2-Tetrafluoroetan
| |||
| Druga imena
Genetron 134a
HFA-134a HFC-134a R-134a Suva 134a Norflurane | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| EC število |
| ||
| RTECS število |
| ||
| UNII | |||
| |||
| |||
| Lastnosti | |||
| C2H2F4 | |||
| Molska masa | 102.03 g/mol | ||
| Videz | Brezbarven plin | ||
| Gostota | 0.00425 g/cm³, 4.25 Kg/m³, gas | ||
| Tališče | -103.3 °C (169.85 K) | ||
| Vrelišče | -26.3 °C (246.85 K) | ||
| 0.15 wt% | |||
| Nevarnosti | |||
| Glavne nevarnosti | Asphyxiant | ||
| S-stavki (zastarelo) | (S2), (S23), Predloga:S24/25, Predloga:S51 | ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 250 °C (482 °F) | ||
| Sorodne snovi | |||
| Sorodno refrigerants | Difluorometan Pentafluoroetan | ||
| Sorodne snovi | 1,1,2,2,2-pentafluoroetan 2-Kloro- 1,1,1,2-tetrafluoroetan 1,1,1-Trikloroetan | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Tetranflouretan
[uredi | uredi kodo]Splošno o Tetranflouretan
[uredi | uredi kodo]1,1,1,2 - Tetranflouretan ali R-134a (Genetron 134a, Freon 134a ali HFC-134a), je haloalkansko hladilno sredstvo, ki nima tako velikega vpliva na ozonski plašč kot prva dva primerka. Ker so mu termodinamične lastnosti podobne R-12, od 1990 se vse več uporablja v hladilnih krogih. R-134a spada v skupino Haloalkanov ki nimajo klora v svoji sestavi, vendar je klor kompletno zamenjan atomima vodika. Formula je CH2FCF3, in vrelišče od −26.3 °C (−15.34 °F) pri atmosferskem tlaku. Zadjih 10 let se je koncentracija R-134a znatno povečala v zemeljski atmosferi, ravno tako se predvideva da se bo še naprej večala koncentracija r_134a. Čeprav nima vpliva na uničevanje ozonskog plašča, ima znaten vpliv na globalno segrevanje, kot tudi vpliva na pojav kislega dežja.
Zadnje čase se tudi R-134a menja s hladilnimi sredstvi s slabšimi hladilnimi lastnosti, ampak bez kakršnih negativnih vplivov na okolje. To je R-744 ali navadni ogljikov dioksid.
Neka predvidevanja govorijo da bojo v naslednjih 10 letih ozonske luknje največje. Tako naj bi bil leta 2070 ozon enak kot 1980., po tem letu naj bi bila ozonska lukjna vse manjša. No, to je vse zelo vprašljivo, ker se pravzaprav ne ve, ali je mogoča obnova ozonskoga sloja zaradi spremembe klime, ki se pa že dogaja.
Uporaba
[uredi | uredi kodo]1,1,1,2- Tetranflouretan je interni plin, ki se uporablja predvsem kot "visoko- temperaturno" hladilno sredstvo za domače hlajenje in za klimatske naprave v avtomobilih. Te naprave so začeli uporabljati v letu 1990 , kot zamenjavo za R-12. Začeli so ga uporabljati za pihanje plastičnih pen, kot čistilno topilo in kot pogonsko gorivo za zdravila - inhalatorje, zrak v pločevinkah (uporabna npr. za čiščenje elektronski in drugih občutljivih naprav) imenovani Gas duster , ter kot odstranjevalci vlage , sušilci in podobno. 1,1,1,2- Tetranflouretan so uporabljali tudi za hlajenje računalnikov . Prav tako so ga uporabljali za pogonsko gorivo pri replikah orožja (znane igre kot paintball - airsoft , vojaške simulacije).

Tetrafluoroetan je v notranjosti pločevinke v obliki čiste tekočine, ki zavre na sobni temperaturi. Pločevinko z obračanjem med uporabo aktiviramo, oz. deaktiviramo .
V zadnjem času se uporaba tetrafluoretnana omejuje zaradi svojega vpliva k podnebnim spremembam . V EU bo prepovedana uporaba od leta 2011 v vseh novih avtomobilih. SAE Društvo avtomobilskih inženirjev sae je predlagalo, da se 1,1,1,2- tetrafluoretnan (HFC - 134a9, najbolje da nadomestiti z novim flourokemičnim hladilom 2,3,3,3-Tetrafluoropropene ali HFO-1234yf (CF3CF=CH2) v avtomobilskih klimatskih sistemih. Kalifornija lahko prepove prodajo v pločevinkah 1,1,1,2 - tetraflouretana posameznikom, da preprečijo neprofesionalno polnjenje klimatskih naprav. Prepoved je bila v veljavi v Wisconsinu od oktobra leta 1994 na podlagi ATCP 136 , kjer so uvedli prepoved prodaje tretaflouretana v posodah, ki imajo velikost manjšo kot 15 lbs| in v omejitev velja le, če kemikalijo mislijo predelati v hladilno sredstvo. EPA.gov .
Zgodovina 1,1,1,2-tetrafluoroetana
[uredi | uredi kodo]1,1,1,2-tetrafluoroetan se je prvič pojavil leta 1990 leta, kot nadomestek R - 12, diklordifluormetan, ki je imel škodljive lastnosti na ozonski plašč. Raziskave kažejo, da se je v zadnjih 10- ih letih koncentracija 1,1,1,2-tetrafluoroeta močno povečala v Zemeljski atmosferi [1], nedavne raziskave pa so razkrile podvojitev koncentracije v ozračju letih od 2001- 2004 ima pa nepomemben vpliv na tanjšanje ozonskega plašča (ozonski plašč) in na kisli dež, pomemben vpliv pa ima na globalno segrevanje.
Varnost
[uredi | uredi kodo]Če ima 1,1,1,2-tetrafluoroetan kontakt z vročimi plameni, ali vročimi površinami , ki presegajo več kot 250 °C (482°F), to povzroči razgradnjo hlapov in emisije strupenih plinov, vključno z flurovodikom karbonilnim halogenidi. 1,1,1,2 tretaflouretan sam ima smrtno dozo - LD LD50, je smrtna koncentracija že 50% za osebo, pri podganah 1,500 g/m³, zaradi tega je relativno nestrupen. Kakorkoli,ker je v plinastem stanju gostejši od zraka, zato nadomesti zrak v pljučih. To pa lahko povzroči zadušitev, če se ga preveč nabere v pljučih. Zato je zloraba inhalatorjev tako nevarna, ker se nabere preveč plina, kar pa privede do smrtnih primerov.
Pločevinke, ki vsebujejo 1,1,1,2-tetrafluoroetan delujejo tako, da se obrnjen sprej ohladi.1,1,1,2-tetrafluoroetam je pod pritiskom in je stisnjen v tekočino, ki pa pri izhlapevanju absorbira znatno količino toplotne energije iz okolja. V stiku s predmetom mu znatno zniža temperaturo, kar pa privede do izhlapevanja. Pri nepravilni uporabi privede do ozeblin kože, ali pa slepote če pride do kontakta z očmi.
Viri
[uredi | uredi kodo]- inhaltor cfc Arhivirano 2010-07-06 na Wayback Machine.
- Society of atomotive engineers
- kalifornijski zakon[mrtva povezava]
- ozonski plašč
Posebne povezave
[uredi | uredi kodo]- Predloga:ICSC
- Information about HFCs Arhivirano 2011-11-02 na Wayback Machine., European Fluorocarbons Technical Committee (EFCTC)
- MSDS at Oxford University Arhivirano 2002-07-06 na Wayback Machine.
- Concise International Chemical Assessment Document 11, at inchem.org
- Pressure temperature calculator
- The Coexisting Curve of the Refrigerant HFC 134a: Some Scaling Models Arhivirano 2006-09-29 na Wayback Machine.
- R134a 2 phase computer cooling Arhivirano 2008-06-18 na Wayback Machine.