Sandmeyerjeva reakcija
Sandmeyerjeva reakcija je kemijska reakcija, s katero se iz arilnih diazonijevih soli sintetizira aril halogenide.[1][2][3] Imenuje se po švicarskemu kemiku Traugottu Sandmeyerju.
Reakcijski mehanizem:

Aromatski in heterociklični amini zlahka reagirajo z nitriti in tvorijo arilne diazonijeve soli. Diazonijeve soli se v prisotnosti bakrovih(I) soli, na primer CuCl, razgradijo in tvorijo ustrezne aril halogenide.[4][5] Reakcija je radikalsko-nukleofilna aromatska substitucija.
Standardna reakcija je kasneje doživela več izboljšav.[6][7]
Različice
[uredi | uredi kodo]Večina razlik med Sandmeyerjevimi reakcijami gre na račun različnih bakrovih soli:[8][9] bakrov cianid, na primer, daje benzonitrile.[10] Če se namesto bakrovih soli uporabijo tioli ali voda, nastanejo tioetri oziroma fenoli.
V Schiemannovi reakciji, v kateri se uporablja tetrafluoroborat (BF4−), nastane fluorobenzen, katerega se z bakrovimi solmi ne da sintetizirati.
Posebna skupina Sandmeyerjevih reakcij uporablja bakrove soli samo kot katalizator. Eno od bromiranj poteka s po 0,1 ekvivalenta Cu(I) in Cu(II) soli, 0,1 ekvivalenta fenantrolina kot liganda in 0,1 ekvivalenta dibenzo-18-krona-6 polietra kot katalizatorja faznega prehoda:[11]
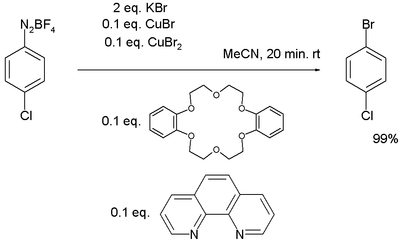
Reference
[uredi | uredi kodo]- ↑ T. Sandmeyer (1884). »Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen«. Berichte der deutschen chemischen Gesellschaft. 17 (3): 1633–1635. doi:10.1002/cber.18840170219.
- ↑ T. Sandmeyer (1884). »Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in den aromatischen Substanzen«. Berichte der deutschen chemischen Gesellschaft. 17 (4): 2650–2653. doi:10.1002/cber.188401702202.
- ↑ L. Gattermann (1890). »Untersuchungen über Diazoverbindungen«. Berichte der deutschen chemischen Gesellschaft. 17 (1): 1218–1228. doi:10.1002/cber.189002301199.
- ↑ J. K. Kochi (1957). »The Mechanism of the Sandmeyer and Meerwein Reactions«. J. Am. Chem. Soc. 79 (11): 2942–2948. doi:10.1021/ja01568a066.
- ↑ H. H. Hodgson (1947). »The Sandmeyer Reaction«. Chem. Rev. 40 (2): 251–277. doi:10.1021/cr60126a003.
- ↑ M. P. Doyle; B. Siegfried; J. F. Dellaria (1977). »Alkyl nitrite-metal halide deamination reactions. 2. Substitutive deamination of arylamines by alkyl nitrites and copper(II) halides. A direct and remarkably efficient conversion of arylamines to aryl halides«. J. Org. Chem. 42 (14): 2426–2431. doi:10.1021/jo00434a017.
- ↑ Suzuki, N. et al. Perkins Trans. I 1987, 645.
- ↑ J.L. Hartwell: o-Chlorobromobenzene, Org. Synth. 3 (1955), str. 185
- ↑ F. D. Gunstone in S. H. Tucker: 1-Chloro-2,6-dinitrobenzene, Org. Synth., 4 (1963), str. 160
- ↑ H. T. Clarke in R. R. Read: o-Tolunitrile and p-Tolunitrile, Org. Synth. 1 (1941), str. 514
- ↑ Beletskaya, P.; Sigeev, Alexander S.; Peregudov, Alexander S.; Petrovskii, Pavel V. (2007). »Catalytic Sandmeyer Bromination«. Synthesis. 2007: 2534–2538. doi:10.1055/s-2007-983784.
