Operon lac
Operon lac (laktozni operon) je operon, potreben za prenos in presnovo laktoze v bakteriji Escherichia coli in mnogih drugih enteričnih bakterijah. Čeprav je glukoza najprimernejši vir ogljika za večino bakterij, operon lac omogoča učinkovito presnovo alternativnega vira energije, tj. laktoze, ko glukoze ni na voljo. Regulacija izražanja operona lac je bil prvi genski regulatorni mehanizem, ki je bil povsem pojasnjen in je tako postal najpomembnejši primer prokariontske regulacije genov.
Bakterijski operoni so funkcionalna področja DNA, ki vključujejo več strukturnih genov pod nadzorom istega promotorja. Genski transkript je tako policistronski – ista mRNA nosi zapis za več beljakovin hkrati. Operon lac nosi tri strukturne gene: lacZ, lacY in lacA. LacZ kodira β-galaktozidazo, ki cepi laktozo, disaharid, v glukozo in galaktozo. LacY kodira laktoza-permeazo, beljakovino, ki se vgradi v celično membrano, da omogoča prenos laktoze v celico. LacA kodira galaktozid-O-acetiltransferazo.


Za bakterijo bi bilo potratno, da bi proizvajala encime za izkoriščanje laktoze, ko ta ni na voljo, ali če bi bil na voljo primarni vir energije, kot je glukoza. Operon lac uporablja mehanizem dvojnega nadzora za uravnavanje, da zagotovi, da celica potroši energijo za proizvodnjo encimov, ki jih kodira operon, le kadar je to potrebno. V odsotnosti laktoze lac-represor ustavi izražanje encimov, kodiranih v operonu lac. V prisotnosti glukoze transkripcijski faktor CAP (catabolite activator protein), ki je potreben za proizvodnjo encimov, ostane nedejaven in EIIAGlc popolnoma zavre laktoza-permeazo, da prepreči prenos laktoze v celico. Ta mehanizem dvojnega nadzora povzroča zaporedno uporabo laktoze in glukoze v dveh ločenih fazah rasti, tako imenovani diauxie.
Struktura operona lac[uredi | uredi kodo]

- Operon lac je sestavljen iz treh strukturnih genov, promotorja, terminatorja, regulatorja in operatorja. Trije strukturni geni so: lacZ, lacY, in lacA.
- LacZ kodira β-galaktozidazo (LacZ), znotrajcelični encim, ki cepi disaharid laktozo v glukozo in galaktozo
- LacY kodira laktoza-permeazo (LacY), transmembranski protein, ki deluje kot simporter, tj. črpa β-galaktozide v celico sočasno s protoni (v smeri protonskega gradienta).
- LacA kodira galaktozid-O-acetil –transferazo (LacA), encim, ki prenaša acetilno skupino iz acetil-CoA v beta-galaktozid.
Samo LacZ in LacY sta potrebna za izkoriščanje laktoze.
Regulacija[uredi | uredi kodo]
Specifična kontrola genov lac je odvisna od razpoložljivosti substrata laktoze. Bakterije proteinov ne proizvajajo, če laktoza ni na voljo kot vir ogljika. Geni lac se povezujejo v operon, kar pomeni, da so enako usmerjeni in mejijo drug na drugega ter se hkrati prepisujejo v eno samo policistronsko molekulo mRNA. Transkripcija vseh genov se začne z vezavo encima RNA-polimeraza (RNAP), ki se veže na specifično mesto na DNA, t. i. promotor. Vezava RNAP na ta promotor poteka ob pomoči transkripcijskega dejavnika CAP, ki je aktiven le v prisotnosti cAMP. Gen lacI (regulatorni gen) kodira represorski protein, ki blokira vezavo RNAP na promotor operona. Represor ni aktiven, če je nanj vezan metabolit laktoze alolaktoza, ki torej deluje kot induktor.
Operon lac je inducibilni operon, kar pomeni, da konstitutivno izražen regulatorni dejavnik (lac-represor) preprečuje izražanje strukturnih genov operona, razen če je prisoten induktor (laktoza). Če laktoze ni v gojišču, se represor zelo tesno veže na kratko DNA-zaporedje ob promotorju (blizu začetka lacZ), imenovan lac-operator. Represor, ki se veže na operator, ovira vezavo RNAP na promotor in tako poteka zgolj šibko prepisovanje strukturnih genov operona. Ko celice rastejo ob prisotnosti laktoze, se laktozni metabolit, imenovan alolaktoza, veže na represor in ga alosterično inaktivira. V tej obliki se represor ne more vezati na operator, kar omogoča RNAP interakcijo s promotorjem in posledično prepis genov lac ter nastajanje kodiranih proteinov.
Drugi kontrolni mehanizem temelji na zaznavanju glukoze in znatno poveča produkcijo proteinov operona lac ob pomanjkanju glukoze. Ciklični adenozin monofosfat (cAMP) je signalna molekula, katere koncentracija v celici je obratno sorazmerna s koncentracijo glukoze. Veže se na CAP in ga tako aktivira. CAP je transkripcijski dejavnik, ki pomaga RNAP pri vezavi na DNK. Ob pomanjkanju glukoze je koncentracija cAMP visoka in vezava CAP-cAMP na DNK znatno poveča produkcijo β-galaktozidaze, kar omogoča celici, da hidrolizira laktozo.
Analogi laktoze[uredi | uredi kodo]
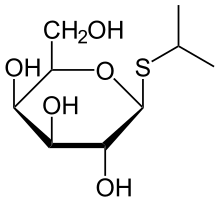

Številni derivati ali analogi laktoze so znani kot induktorji operona lac. Te spojine so v glavnem substituirani galaktozidi, kjer je glukozni del laktoze nadomeščen z drugo substituento.
- Izopropil-β-D-tiogalaktozid (IPTG) pogosto uporabljamo kot induktor operona lac v fizioloških pogojih. IPTG se veže na represor in ga deaktivira, vendar ni substrat za β-galaktozidazo. Ena od prednosti IPTG za in vivo študije je, da njegova koncentracija ostane konstantna in ni spremenljivka v procesu, saj ga bakterija ne presnavlja.
- Alolaktoza je izomer laktoze in je induktor operona lac. Laktoza je galaktoza-(β1-> 4)-glukoza, medtem ko je alolaktoza galaktoza-(β1-> 6)-glukoza. Laktozo pretvarja v alolaktozo β-galaktozidaza po alternativnem, nehidrolitičem mehanizmu.
Regulacija s pomočjo cikličnega AMP[uredi | uredi kodo]
Pojav diauxie so uspeli pojasniti šele s karakterizacijo dodatnih mutacij, ki posredno vplivajo na gene lac. Odkrili so namreč mutacije v genih cya in crp, ki ležita daleč stran od operona lac, ob katerih prihaja do znižanega izražanja genov lac v prisotnosti IPTG (celo v sevih, ki nimajo zapisa za represor ali operator). Z odkritjem cAMP v E. coli so dokazali, v mutiranih sevih z nedelujočim genom cya (ne pa tudi tistih z nedelujočim genom crp), lahko z dodatkom cAMP v gojišče obnovijo polno delovanje operona.
Gen cya kodira adenilat-ciklazo, encim, ki proizvaja cAMP. Pri sevih z mutiranim genom cya odsotnost cAMP povzroči desetkrat manjše izražanje genov lac kot običajno, in to je moč popraviti z dodatkom cAMP. Drugi gen, crp, kodira transkripcijski dejavnik CAP.
Encimi, ki bakteriji omogočajo izkoriščanje laktoze, nastajajo v majhnih količinah ob prisotnosti glukoze in laktoze (govorimo o bazalnem izražanju ob »puščanju« promotorja), saj se lac-represor veže na operator in z njega disociira hitro, torej ni tesno vezan nanj. To omogoča RNAP vezavo na promotor in transkripcijo genov lac. Bazalno izražanje je nujno za presnovo laktoze po tem ko bakterija porabi vso glukozo, a še preden se operon lac polno aktivira.
Povzetek:
- Ob odsotnosti laktoze se proizvede zelo malo encimov lac (operator ima nase vezan lac-represor).
- Ko je laktoza prisotna, hkrati pa je na voljo tudi bolj zaželen ogljikov vir (kot glukoza), se proizvedejo manjše količine encimov (lac-represor ni vezan na operator).
- Ko je glukoza odsotna, se kompleks CAP-cAMP veže na specifično mesto na DNA, ki se nahaja pred promotorjem, in neposredno veže RNAP, kar posledično okrepi vezavo RNAP na promotor.
Zamik med rastnimi fazami odraža čas, ki je potreben za proizvodnjo zadostnih količin encimov, ki presnavljajo laktozo. Najprej se mora multimerni protein CAP sestaviti na lac-promotorju, kar privede do povečanja proizvodnje lac-mRNK. Več kopij lac-mRNK-ja vodi v proizvodnjo znatno več kopij β-galaktozidaze in laktoza-permeaze. Po zamiku, ki je potreben za povečanje količine encimov, ki presnavljajo laktozo, bakterije vstopijo v novo fazo hitre celične rasti.
Spodnji diagram povzema te trditve.

Uporaba v molekularni biologiji[uredi | uredi kodo]
Gen lac in njegove derivate uporabljamo kot reporterske gene v selekcijskih tehnikah, ki temeljijo na uporabi bakterij, kot je dvohibridna analiza, v kateri proučujemo uspešnost vezave transkripcijskega aktivatorja na določeno promotorsko zaporedje. Na agarnih LB-gojiščih, ki vsebujejo kromogeni substrat β-galaktozidaze X-gal, se barva bakterijskih kolonij spremeni iz bele v modro, kar opazimo že pri 20-100 β-galaktozidaznih enotah.
