Schollova reakcija
Schollova reakcija je spajanje dveh aromatskih spojin s pomočjo Lewisove in protonske kisline.[1][2] Reakcija se imenuje po njenem odkritelju, švicarskem kemiku Rolandu Schollu.
Scholl je leta 1910 poročal o sintezi kinona[3] in perilena iz naftalena.[4] V obeh sintezah je bil kot katalizator prisoten aluminijev klorid (AlCl3). Perilen je leta 1913 sintetiziral tudi iz 1,1’-binaftalena. [5] Leta 1912 je sintetiziral tudi benzantron.[6]
Protonska kislina v Schollovi reakciji je pogosto nečistoča v Lewisovi kislini. Reakcijo katalizirajo tudi železov(III) klorid v diklorometanu, bakrov(II) klorid, (bis(trifluoroacetoksi)jodo)benzen (PIFA) , borov trifluorid eterat v diklorometanu, molibdenov(V) klorid in svinčev tetraacetat z BF3 v acetonitrilu.[7]
Izkoristek reakcije je tudi pri visokih reakcijskih temperaturah in zelo kislih katalizatorjih pogosto majhen, zato metoda ni preveč priljubljena. Mnogo boljše izkoristke dajejo intramolekularne reakcije, na primer sinteza 9-fenilfluorena:
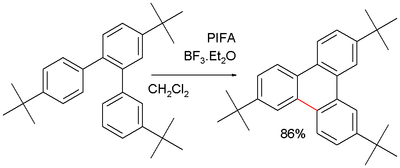
Sinteza piren dibenzo-(a.1)-pirena iz antracen 1-fenilbenz(a)antracena ima 66 % izkoristek: [8]
Ena od študij je pokazala, da bolj zapleteni policiklični aromatski ogljikovodiki nastajajo v nizu kaskadnih reakcij.[9]
V nekaterih aplikacijah, na primer sintezi trifenilena, je Schollova reakcija alternativa za Suzukijevo reakcijo. Stalen problem je oligomerizacija produkta, katero se lahko prepreči z blokiranjem terciarnih butilnih substituent.
Reakcijski mehanizem
[uredi | uredi kodo]Natančen reakcijski mehanizem ni znan, vendar lahko zelo dobro poteka preko arenijevega iona. Izkoristek in selektivnost reakcij povečajo aktivacijske skupine, na primer metoksi skupine, kar je značilno tudi za druge elektrofilne aromstske substitucije.[7]
Sklici
[uredi | uredi kodo]- ↑ Michael B. Smith; Jerry March (2001). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5 izd.). New York:John Wiley & Sons, cop. COBISS 23471109. ISBN 0-471-58589-0.
- ↑ M. Grzybowski, K. Skonieczny, H. Butenschön, D.T. Gryko (2013). Comparison of Oxidative Aromatic Coupling and the Scholl Reaction. Angew. Chem. Int. Ed. 52: 9900–9930. doi: 10.1002/anie.201210238.
- ↑ R. Scholl, J. Mansfeld (1910). meso-Benzdianthron (Helianthron), meso-Naphthodianthron, und ein neuer Weg zum Flavanthren. Ber. Dtsch. Chem. Ges. 43: 1734–1746. doi: 10.1002/cber.19100430288.
- ↑ R. Scholl, C. Seer, R. Weitzenböck (1910). Perylen, ein hoch kondensierter aromatischer Kohlenwasserstoff C20H12. Ber. Dtsch. Chem. Ges. 43: 2202–2209. doi: 10.1002/cber.191004302175.
- ↑ R. Weitzenböck, C. Seer (1913). Zur Kenntnis des Perylens und seiner Derivate. (2. Mitteilung). Ber. Dtsch. Chem. Ges. 46: 1994–2000. doi: 10.1002/cber.191304602115.
- ↑ R. Scholl, C. Seer (1912). Abspaltung aromatisch gebundenen Wasserstoffs und Verknüpfung aromatischer Kerne durch Aluminiumchlorid. Justus Liebigs Ann. Chem. 394: 111–177. doi: 10.1002/jlac.19123940202.
- ↑ 7,0 7,1 B.Z. King, J. Kroulík, C.R. Robertson, P. Rempala, C.L. Hilton, J.D. Korinek, L.M. Gortari (2007). Controlling the Scholl Reaction. J. Org. Chem. 72 (7): 2279-2288. doi: 10.1021/jo061515x.
- ↑ F.A. Vingiello, J. Yanez, J.A. Campbell (1971). J. Org. Chem. 36: 2053-2056. doi: 10.1021/jo00814a005.
- ↑ C.D. Simpson, G. Mattersteig, M. Kai, L. Gherghel, R.E. Bauer, H.J. Räder, K. Müllen (2004). Nanosized Molecular Propellers by Cyclodehydrogenation of Polyphenylene Dendrimers. J. Am. Chem. Soc. 126 (10): 3139-3147. doi: 10.1021/ja036732j.