Disulfidna vez: Razlika med redakcijama
Izbrisana vsebina Dodana vsebina
Brez povzetka urejanja |
Brez povzetka urejanja |
||
| Vrstica 1: | Vrstica 1: | ||
[[File:disulfide-bond.png|thumb|500px|Tvorbe disulfidne vezi z oksidacijo.]] |
[[File:disulfide-bond.png|thumb|500px|Tvorbe disulfidne vezi z oksidacijo.]] |
||
V [[kemija|kemiji]] je '''disulfidna vez''' [[kovalentna vez]], |
V [[kemija|kemiji]] je '''disulfidna vez''' [[kovalentna vez]], navadno pridobljena s spajanjem dveh [[tiolna funkcionalna skupina|tiolnih fuknciolalnih skupin]]. Povezava se imenuje tudi '' 'S–S-vez' '' ali '' 'disulfidni most' ''. Splošna povezljivost je zato R-S-S-R. Izraz se pogosto uporablja v biokemiji. |
||
Disulfidna vez je močna vez. Disociacijska energija je 60 kcal/mol (251 kJ/mol). Je za približno 40% šibkejša kot C–C |
Disulfidna vez je močna vez. Disociacijska energija je 60 kcal/mol (251 kJ/mol). Je za približno 40 % šibkejša kot vez C–C ali C–H, zato je pogosto »šibki člen« v mnogih molekulah. Odraža [[polarizabilnost]] dvovalentnega [[žveplo|žvepla]], zato vez S-S pogosto razpade ob dodatku polarnih reagentov, tako [[nukleofil|nukleofilov]] kot tudi [[elektrofil|elektrofilov]]:<ref>R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.</ref> |
||
RS–SR + Nu<sup>−</sup> → RS–Nu + RS<sup>−</sup> |
RS–SR + Nu<sup>−</sup> → RS–Nu + RS<sup>−</sup> |
||
Dolžina disulfidne vezi je 2 |
Dolžina disulfidne vezi je 2,05 Å. |
||
[[File:Mercapto Group General Formulae.png|thumb|120px|right|Tiolna funkcionalna skupina z <span style="color:blue;">'''modro'''</span> označeno sulfhidridno skupino.]] |
[[File:Mercapto Group General Formulae.png|thumb|120px|right|Tiolna funkcionalna skupina z <span style="color:blue;">'''modro'''</span> označeno sulfhidridno skupino.]] |
||
==Sklici== |
==Sklici== |
||
{{Sklici}} |
{{Sklici}} |
||
Redakcija: 09:50, 18. september 2013
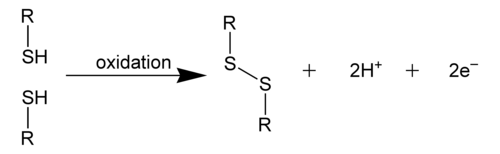
V kemiji je disulfidna vez kovalentna vez, navadno pridobljena s spajanjem dveh tiolnih fuknciolalnih skupin. Povezava se imenuje tudi 'S–S-vez' ali 'disulfidni most' . Splošna povezljivost je zato R-S-S-R. Izraz se pogosto uporablja v biokemiji. Disulfidna vez je močna vez. Disociacijska energija je 60 kcal/mol (251 kJ/mol). Je za približno 40 % šibkejša kot vez C–C ali C–H, zato je pogosto »šibki člen« v mnogih molekulah. Odraža polarizabilnost dvovalentnega žvepla, zato vez S-S pogosto razpade ob dodatku polarnih reagentov, tako nukleofilov kot tudi elektrofilov:[1]
RS–SR + Nu− → RS–Nu + RS−
Dolžina disulfidne vezi je 2,05 Å.

Sklici
- ↑ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.
