Fosfin

| |||
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
Phosphane
| |||
| Druga imena
Phosphamine
fosfin trihydride fosfinov vodik | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.328 | ||
| EC število |
| ||
PubChem CID
|
|||
| RTECS število |
| ||
| UN število | 2199 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| PH3 | |||
| Molska masa | 33.99758 g/mol | ||
| Videz | brezbarven plin | ||
| Gostota | 1.379 g/l, gas (25 °C) | ||
| Tališče | −1.328 °C (−2.358 °F; −1.055 K) | ||
| Vrelišče | −877 °C (−1.547 °F; −604 K) | ||
| 31.2 mg/100 ml (17 °C) | |||
| Viskoznost | 1.1 x 10−5 Pa s | ||
| Struktura | |||
| Oblika molekule | Trigonal pyramidal | ||
| Dipolni moment | 0.58 D | ||
| Termokemija | |||
| Standardna molarna entropija S |
210 J·mol−1·K−1[1] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
5 kJ·mol−1[1] | ||
| Nevarnosti | |||
EU klasifikacija (DSD) (zastarelo)
|
Highly flammable (F+) Very toxic (T+) Corrosive (C) Dangerous for the environment (N) | ||
| R-stavki (zastarelo) | R12, R17, R26, R34, R50 | ||
| S-stavki (zastarelo) | (S1/2), S28, S36/37, (S45), (S61), Predloga:S63 | ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | vnetljiv plin | ||
| Meje eksplozivnosti |
1.8% – ? | ||
| Sorodne snovi | |||
| Drugi kationi | Amonijak Arzin Stibine Bismuthine | ||
| Sorodne snovi | Trimetinfosfin Trifenilfosfin | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Fosfin je krajše ime za fosforjev hidrid (PH3), po poimenovanju IUPAC tudi kot fosfan. To je brezbarven vnetljiv plin s temperaturo vrelišča -88 °C pri standardnem tlaku. Čisti fosfin je brez vonja, kot tehnični plin pa ima zaradi zamenjanega fosfina in difosfina (P2H4) zelo neprijeten vonj česna ali pokvarjene ribe.
Fosfin je zelo strupen, saj zlahka povzroči smrt že v nizkih koncentracijah. Zaradi tega se ta plin uporablja pri zatiranju škodljivcev. Za uporabo v poljedelstvu se uporablja kot aluminijev fosfid v kroglicah, ta pa ob stiku z atmosfersko vodo razpade v fosfin. Te kroglice vsebujejo tudi druge kemikalije, iz katerih nastaja amonijak, ki zmanjšuje možnost samodejnega vžiga ali ekplozije fosfina. Prav tako vsebujejo še druge spojine (npr. metantiol), ki plinu dodajo zaznaven vonj po česnu, da je možno zaznati obstoj fosfina v zraku.
Fosfin se uporablja tudi v industriji polprevodnikov.
Zgodovina[uredi | uredi kodo]
Morda zaradi svoje močne povezave z elementarnim fosforjem, fosfor je nekoč bil obravnavan kot v plinasti obliki elementa, ampak Lavoisier (1789) jo priznava kot kombinacija fosforja z vodikom in jo opisal kot "hydruyet fosforja, ali fosfor z vodika"[navedi vir]
Thénard (1845) je uporabil hladno past da loči difosfin od fosfina, ki je bil pridobljen iz kalcijevega fosfida, kar dokazuje da je odgovorna P2H4 za spontano vnetljivost povezano z PH3, kot tudi za značino oranžno / rjavo barvo, ki se lahko tvorijo na površinah, kje je polimerizacija izdelka. Formulo za difosfinov je štel kot PH2 in tako vmes med elementarnega fosforja, višjimi polimeri in fosfini. Kalcijev fosfid (nominalno Ca3P2) proizvede več P2H4 od drugih fosfidov zaradi prevladujočih P-P obveznic v začetnem materialu.
Struktura in lastnosti[uredi | uredi kodo]
PH3 je trikotasta piramidasta molekula z C3v molekularno simetrijo. Dolžina PH obveznice je 1, 42 Å, kajti HPH obveznic so 93. 5°. Dipol trenutek je 0,58 D, ki povečuje z zamenjavo metilnih skupin v seriji: CH3PH2, 1,10 D, (CH3) 2PH, 1,23 D, (CH3) 3P, 1,19 D. V nasprotju s tem dipolni trenutki aminov se zmanjšajo z zamenjavo, se začne z amonijakom, ki ima dipolni moment 1,47 D. Nizka dipol trenutek in koti skoraj pravokotno obveznic pripelje do zaključka, da v PH3 so PH obveznice skoraj v celoti pσ (P) - sσ (H) in fosfor 3s orbitalni malo prispeva v lepljenju med fosforja in vodika v tej molekuli. Iz tega razloga lahko posamičen par na fosforja obravnavajo kot pretežno nastala z 3s orbitalnih fosfori. Upfield kemijski premik od atoma fosforja v 31P NMR spekter se ujema z ugotovitvijo, da par posamičeni elektroni zasedajo 3s orbitalni (Fluck, 1973). Ta elektronska struktura vodi do pomanjkanja nukleofilja in sposobnostjo oblikovanja le šibke vodikove vezi.[2]
Topnost v PH3 je rahlo, 0,22 ml plina raztopimo v 1 ml vode. Fosfin se raztopi lažje v nepolarnih topilih kot v vodi zaradi nepolarnih PH vezi. V vodi ne deluje niti kot kislina niti kot osnova. Proton naredi izmenjavo procesa preko fosfonijevim (PH4 +) ionov v kislih raztopinah in preko PH2-pri visoki vrednosti pH, z ravnotežnih konstant Kb = 4 × 10-28 in Kz = 41,6 × 10-29.
Priprava in dogodkih[uredi | uredi kodo]
Fosfin lahko pripravimo na različne načine.[3] Industrijsko se lahko izvede z reakcijo belega fosforja z natrijevim hidroksidom, kjer proizvajajo natrijev hipofosfit in natrijev fosfit, kot stranski produkt. Alternativno se lahko uporabi kislinsko katalizirane dispropocionacije belega fosforja, in daje fosforne kisline in fosfin. Obe poti imata industrijski pomen; kislinska pot je prednostna metoda, če je potrebna nadaljnja reakcija fosfina na substituirane fosfine. Kislinska pot zahteva čiščenje in pritisk. To se lahko izvede tudi (kot je opisano zgoraj) s hidrolizo kovinski fosfid, tako kot je aluminijev fosfid ali kalcijev fosfat. Čiste vzorce fosfina, brez P2H4, lahko pripravimo z uporabo delovanja kalijevega hidroksida na fosfonijevega jodida (PH4l).
Fosfin je verjetno sestavina atmosfere pri zelo nizkih in zelo spremenljive koncentracije in zato lahko prispeva k svetovni fosforja biokemijskega cikla.[4] Možni viri vključujejo bakterijsko znižanje fosfatov v razpadajoči organski snovi in korozijo fosfor, ki vsebujejo kovine.[5]
Fosfini[uredi | uredi kodo]
Povezana s PH3 je razred organskih spojin pogosto imenujemo fosfini. Te alkile in arile derivati fosfina so analogna organskih aminov. Pogosti primeri vključujejo trifenilfosfin ((C6H5) 3P) in BINAP, tako uporabljena kot ligandi v homogene katalize ali triisopropylphosphine. Fosfine so lahko oksidirani do fosfin oksidi, česar primer je usmerjeno sintezo phospha-krono, fosfor analog za aza krono [6], kjer je ni mogoče izolirati fosfin sam.

V koraku 1 diphosphinoethane se usklajuje s ferocen in vsebuje dodatne ligande, ogljikovega monoksida in acetonitril ligand.Naslednji korak je hydrophosphination s trivinylphosphine ki sledi alkiliranje z etil bromida in hidrogeniranje z vodikom preko paladija na oglju. V zadnjem koraku so predlogo železo odstranili z bromom, vendar oksidacijo skupina fosfin je neizogibna.
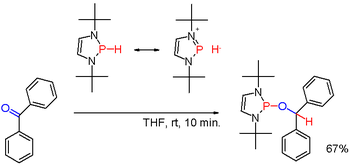
Ko modificiranje z ustrezni substituenti, kot je v nekaterih (redkih) diazaphospholenes (shema 3) polarnost PH obveznice se lahko obrnejo (glej: umpolung), takrat dobljen fosfin hidrid lahko zmanjša karbonilno skupino, kot na primer benzofenona na drugačen način.[7]
Vloge[uredi | uredi kodo]
ORGANOFOSFORNIH kemija[uredi | uredi kodo]
Fosfin predvsem se uporablja kot intermediat v organofosforjevo kemije. V ilustrativni reakcije, formaldehid se dodaja v prisotnosti vodikovega klorida, da dobimo tetrakis (hidroksimetil) fosfonijev klorid, ki se uporablja za tekstil.
MICROELECTRONICS[uredi | uredi kodo]
Majhne količine fosfina se uporabljajo kot dopanta v industriji polprevodnikov in njegovega prekurzorja za nanašanje sestavljenih polprevodnikov.[8]
Fumigacija[uredi | uredi kodo]
Za uporabo v kmetiji, peleti aluminijev fosfid, kalcijev fosfid, ali cinkovega fosfida javnost fosfinski pri stiku z atmosferskim vodo ali glodalcih "želodčne kisline. Te pelete vsebujejo tudi sredstva za zmanjšanje možnosti za vžig ali eksplozijo sproščenem fosfina. Ker je bil prej priljubljen Fumigant metilbromid postopno odpravijen v nekaterih državah, v okviru Montrealskega protokola, fosfins se je le pogosto uporabljal, stroškovno učinkovito in hitro deluje Fumigant, ki ne pušča ostankov na uskladiščenega proizvoda. Škodljivci k razvoju visoko stopnjo odpornosti proti fosfina so postali pogosti v Aziji, Avstraliji in Braziliji. Odpornost na visoki ravni je tudi verjetnost, da se pojavijo na drugih območjih, vendar morda ni bilo tako skrbno spremljati.
Varnost[uredi | uredi kodo]
Fosfinski plin je bolj gost od zraka, najdemo ga v nizko ležečem območju. Ko pride v stik z zrakom zaradi rekcije se vname in pride do eksplozije. Med gorenjem proizvaja gost bel dim fosforjevega pentoksida - hudo respiratorno dražilo[9]. Fosfin se lahko absorbira v telo z vdihavanjem. Neposreden stik s fosfinsko tekočino - čeprav je malo verjetno, da pride - lahko povzroči ozebline, tako kot druge kriogene tekočine. Glavna tarča fosfinskega plina so organi dihal. Glede na leto 2009 ameriškega Nacionalnega inštituta za varnost in zdravje pri delu (NIOSH) Pocket Guide in ZDA varstvo pri delu in ureditvi zdravstvenega Administration 8 ur povprečna izpostavljenost dihal, ne sme presegati 0,3 ppm. NIOSH priporoča, da kratkotrajna izpostavljenost dihal fosfinskega plina ne sme presegati 1 ppm.Takoj nevarno za življenje ali zdravje stopnja je 50 ppm. Prekomerna izpostavljenost fosfinskega plin povzroči slabost, bruhanje, bolečine v trebuhu, driska, žeja, tiščanje v prsih, dispneja (oteženo dihanje), bolečine v mišicah, mrzlica, stupor ali sinkopa. Pljučni edem.[10][11] Za Fosfin so poročali, da imajo vonj razpadajoče ribe ali česna pri koncentracijah pod 0,3 ppm. Vonj je običajno omejena na laboratorijskih površin ali fosfinskega predelavo, saj vonj prihaja iz načina fosfina pridobljenega iz okolja. Vendar pa se lahko zgodi drugod, na primer na odlagališčih industrijskih odpadkov. Izpostavljenost višjim koncentracijam lahko povzroči dišavne težave, utrujenost.[12]
Lastnosti[uredi | uredi kodo]
Je edina stabilna molekula fosforja z vodikom. Strukturno in po nekaterih lastnostih je dokaj podoben amonijaku NH3. Prav tako se obnaša kot konjugirana baza, vendar je močnejši reducent kot amonijak. S kisikom zgori do fosforjeve (V) kisline. Drugače se čisti fosfin na zraku ne vžge spontano, ampak zaradi sledov nestabilnega P2H4.
Glej tudi[uredi | uredi kodo]
- Diphosphane, H2PPH2
- Diphosphines,R2PPR2, R2P(CH2)nPR2
- Diphosphene, HP=PH
- Fosfin oksid, R3P = O
- Fosforan, PR5, R3P = CR2
- Phosphinite, P R2 (OR)
- Phosphonite, P 2R (OR)
- Fosfita, P (OR) 3.
- Fosfinata, R2P (RO) O
- Fosfonat, RP (RO) 2O
- Fosfat, PRO) 3O
Reference[uredi | uredi kodo]
- ↑ 1,0 1,1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. str. A22. ISBN 0-618-94690-X.
- ↑ Sennikov, P. G. (1994). »Weak H-Bonding by Second-Row (PH3, H2S) and Third-Row (AsH3, H2Se) Hydrides«. Journal of Physical Chemistry. 98 (19): 4973–4981. doi:10.1021/j100070a006.
- ↑ Toy, A. D. F. (1973). The Chemistry of Phosphorus. Oxford, UK: Pergamon Press.
- ↑ Gassmann, G.; van Beusekom, J. E. E.; Glindemann, D. (1996). »Offshore atmospheric phosphine«. Naturwissenschaften. 83 (3): 129–131. Bibcode:1996NW.....83..129G. doi:10.1007/BF01142178.
- ↑ Roels, J.; Verstraete, W. (2001). »Biological formation of volatile phosphorus compounds, a review paper«. Bioresource Technology. 79 (3): 243–250. doi:10.1016/S0960-8524(01)00032-3.
- ↑ Edwards, P. G.; Haigh, R.; Li, D.; Newman, P. D. (2006). »Template Synthesis of 1,4,7-Triphosphacyclononanes«. Journal of the American Chemical Society. 128 (11): 3818–3830. doi:10.1021/ja0578956.
- ↑ Burck, S.; Gudat, D.; Nieger, M.; Du Mont, W.-W. (2006). »P-Hydrogen-Substituted 1,3,2-Diazaphospholenes: Molecular Hydrides«. Journal of the American Chemical Society. 128 (12): 3946–3955. doi:10.1021/ja057827j.
- ↑ Bettermann, G.; Krause, W.; Riess, G.; Hofmann, T. (2002). »Phosphorus Compounds, Inorganic«. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_527.
- ↑ »NIOSH Emergency Response Card«. CDC. Pridobljeno 6. aprila 2010.
- ↑ »NIOSH pocket guide«. CDC. 3. februar 2009. Pridobljeno 6. aprila 2010.
- ↑ »WHO (Data Sheets on Pesticides-No. 46): Phosphine«. Inchem.org. Arhivirano iz prvotnega spletišča dne 18. februarja 2010. Pridobljeno 6. aprila 2010.
- ↑ »NIOSH Alert: Preventing Phosphine Poisoning and Explosions during Fumigation«. CDC. 10. julij 1995. Pridobljeno 6. aprila 2010.
Nadaljnje branje[uredi | uredi kodo]
- Fluck, E. (1973). »The Chemistry of Phosphine«. Topics in Current Chemistry. 35: 1–64. doi:10.1007/BFb0051358.
- Svetovna zdravstvena organizacija (1988). Phosphine and Selected Metal Phosphides. Environmental Health Criteria. Zv. 73. Ženeva: Joint sponsorship of UNEP, ILO and WHO.



