Spojina: Razlika med redakcijama
Brez povzetka urejanja |
{{normativna kontrola}} |
||
| Vrstica 42: | Vrstica 42: | ||
[[Kategorija:Kemične snovi]] |
[[Kategorija:Kemične snovi]] |
||
[[Kategorija:Kemične spojine|*]] |
[[Kategorija:Kemične spojine|*]] |
||
{{normativna kontrola}} |
|||
Redakcija: 13:49, 16. januar 2017
 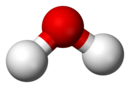 | |
| Čista voda (H2O), prikazana na zgornji sliki, je primer spojine. Prostorsko zapolnjeni model molekule vode na spodnji sliki prikazuje sestavo spojine H2O; sestavljajo dva atoma vodika (bele barve) in enega atoma kisika. |
Spojína imenujemo v kemiji snov, ki jo sestavljata dva ali več kemičnih elementov (prvin) v stalnem razmerju, ki določa spojino. Voda je, na primer, spojina vodika in kisika v razmerju 2:1. Spojina je snov, ki je sestavljena iz enakih molekul, ki so povezane z molekulskimi vezmi. Primer: spojina vode je zgrajena iz velikega števila molekul vode H2O.
Molekule, ki sestavljajo spojino, so zgrajene iz atomov različnih elementov. Primer: molekula H2O je zgrajena iz atomov vodika (H) in kisika (O), ki sta povezana s kovalentno – polarno vezjo.
Spojine so zgrajene iz atomov različnih elementov, ki so med seboj povezani s kemijskimi vezmi. Imajo drugačne lastnosti kot izhodne snovi in jih lahko s kemijsko reakcijo razstavimo nazaj na elemente. Najmanjši delci v spojini so molekule ali ioni.
Temeljni koncepti
Osnovne značilnosti spojin zajema naslednja definicija:
- Elementi v spojini so zastopani v določenem stalnem razmerju.
Zgled: Spojino vode (H2O) sestavljata vselej dva atoma vodika in en atom kisika.
- Spojine imajo svoje značilne lastnosti.
Elementi, ki sestavljajo spojino, pri tem ne ohranijo svojih prvotnih lastnosti.
Na primer: vodik (vnetljiv plin, ki pa sam ne omogoča gorenja) in kisik (nevnetljiv plin, ki omogoča gorenje drugih snovi) tvorita spojino vode (nevnetljiva in ne omogoča gorenja drugih snovi).
Valenca (valentnost) je število, ki pove, s koliko atomi vodika se lahko poveže ali koliko atomov vodika lahko nadomesti atom ali ion kakega elementa ali kaka atomska skupina.[1]
Primerjava spojin in zmesi
Fizikalne in kemične lastnosti spojin se razlikujejo od lastnosti elementov, ki jih gradijo. To je eno od poglavitnih meril za razlikovanje spojine od zmesi ali katerihkoli drugih kategorij snovi. Lastnosti zmesi so namreč močno odvisne od lastnosti posameznih sestavin. Nadalje se zmesi ločujejo od spojin po tem, da lahko praviloma posamezne sestavine zmesi ločimo med seboj z razmeroma enostavnimi mehanskimi postopki (npr. filtriranje, izparevanje ...), sestavine spojin pa lahko ločimo le s kemično reakcijo. Nadalje lahko zmesi pripravimo iz posameznih sestavin le z mehanskimi postopki, spojine pa se iz elementov ali drugih spojin tvorijo le s kemično reakcijo.
Nekatere zmesi so tako enovite, da imajo določene lastnosti spojin, na primer zlitine. Zlitine se pripravijo mehansko, najpogosteje s segrevanjem kovin do utekočinjenja, nato sledi mešanje in hitro ohlajanje, tako da posamezne kovinske sestavine ostanejo ujete v osnovni kovinski sestavini.
Sklici in opombe
- ↑ http://www.termania.net/slovarji/slovenski-medicinski-slovar/5543422/valenca?query=valenca, Slovenski medicinski e-slovar.
