Brønsted–Lowryjeva teorija kislin in baz
Brønsted–Lowryjeva teorija kislin in baz je teorija, ki sta jo leta 1923 neodvisno eden od drugega predlagala danski fizikalni kemik Johannes Nicolaus Brönsted in angleški fizikalni kemik Thomas Martin Lowry.[1][2] Po njuni teoriji je kislina snov, ki v medsebojni reakciji odda proton (H+) in preide v konjugirano bazo, baza pa snov, ki proton sprejme in preide v konjugirano kislino. Teorija je posplošitev Arrheniusove teorije.
Definicije kislin in baz
[uredi | uredi kodo]Po Arrheniusovi teoriji so kisline definirane kot snovi, ki pri disociaciji v vodni raztopini tvorijo vodikove ione H+, baze pa so snovi, ki pri disociaciji v vodni raztopini tvorijo hidroksilne ione OH−.[3]
Po Brønsted-Lowryjevi teoriji[4][5][6] so kisline in baze definirane po tem, kako reagirajo med seboj, kar je njihovo definicijo zelo posplošilo. Definicija je izražena z naslednjim ravnotežjem:
- kislina + baza ⇌ konjugirana kislina + konjugirana baza
ali
- HA + B ⇌ A− + HB+.
Reakcija je ravnotežna, ker poteka v obe smeri. Kislina HA lahko odda proton in preide v konjugirano bazo A-, baza B pa lahko proton sprejme in postane konjugirana kislina HB+. Večina kislo-bazičnih reakcij je hitrih, tako da so reaktanti in produkti običajno v medsebojnem dinamičnem ravnotežju.[7]
Vodne raztopine
[uredi | uredi kodo]Za zgled vzemimo naslednjo kemijsko reakcijo:
- CH3COOH + H2O ⇌ CH3COO− + H3O+
Ocetna kislina (CH3COOH) je kislina, ker odda vodi (H2O) proton in postane konjugirana baza acetatni ion (CH3COO−). H2O je baza, ker sprejme proton od CH3COOH in postane konjugirana kislina oksonijev ion (H3O+).[8]
Poimenovanje ocetne kisline kot kisline in acetatnega iona kot konjugirane baze je prepuščeno svobodnemu odločanju, ker bi reakcijo lahko enako dobro zapisali z acetatom kot bazo in ocetno kislino kot konjugirano kislino:
- H3O+ + CH3COO− ⇌ CH3COOH + H2O
Prednost Brønsted–Lowryjeve teorije je v tem, da v nasprotju z Arrheniusovo teorijo ni pogojena z disociacijo kisline.
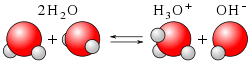
Bistvo Brønsted–Lowryjeve teorije je, da lahko kislina kot taka obstaja samo v povezavi z bazo in obratno. Voda je amfoterna, ker lahko deluje kot kislina ali kot baza: ena molekula vode deluje kot kislina, odda proton H+ in postane hidroksidni ion OH-, druga molekula vode pa deluje kot baza in ga sprejme in postane oksonijev ion H3O+.
Amfoterne so tudi druge spojine, na primer aluminijev hidroksid Al(OH)3:
- Al(OH)3 + OH- ⇌ Al(OH)−
4 + H2O, deluje kot kislina, - 3H+ + Al(OH)3 ⇌ 3H2O + Al+
3, deluje kot baza.
Nevodne raztopine
[uredi | uredi kodo]Vodikov ion H+ je v vodnih raztopinah Brønsted–Lowryjeva kislina, hidroksidni ion OH- pa baza. Oba nastajata z disociacijo vode:
- H2O + H2O ⇌ H3O+ + OH-
Iz tega sledi, da imata v tekočem amonijaku enako vlogo amonijev ion NH+
4 in amidni ion NH−
2. Amonijeve soli se torej obnašajo kot kisline, amidi pa kot baze.[9]
Nekatera nevodna topila se lahko obnašajo kot baze, se pravi da so v povezavi z Brønsted–Lowryevimi kislinami akceptorji protonov:
- HA + T ⇌ A- + TH+
T je molekula topila.
Najpomembnejši tovrstni topili sta dimetilsulfoksid (DMSO, (CH3)2SO) in acetonitril (CH3CN). Acetonitril se pogosto uporablja za merjenje disociacijskih konstant (Ka) organskih kislin. Ker je DMSO močnejši akceptor protonov kot voda, postane kislina v njem močnejša kot v vodi.[10] Mnogo je tudi takih molekul, ki se v nevodnih raztopinah obnašajo kot kisline, v vodi pa ne. Takšen primer so organske kisline, v katerih se proton odcepi iz vezi C-H.
Na enak način se močno kislim topilom lahko povečala bazičnost. Takšen primer je ocetna kislina, ki se v tekočem vodikovem kloridu (HCl) obnaša kot baza:[11]
- HCl + CH3C(O)(OH) ⇌ Cl- + CH3C(OH)+
2
Primerjava z Lewisovo teorijo kislin in baz
[uredi | uredi kodo]V istem letu, kot sta Brønsted in Lowry objavila svojo teorijo kislin in baz, je Gilbert Newton Lewis predlagal alternativno teorijo kislo-bazičnih reakcij, ki temelji na elektronski strukturi reaktantov. Lewisova baza je opredeljena kot spojina, ki lahko donira elektronski par Lewisovi kislini, spojini, ki lahko elektronski par sprejme:[12][13]
- A-H + B: ⇌ A:- + B-H+
V Lewisovi predstavitvi sta tako baza B kot konjugirana baza A- prikazani kot nosilki prostega elektronskega para, Lewisova kislina pa kot nosilka protona, ki se prenaša med njima.
Lewis je v podporo svoji teoriji zapisal: »Omejevanje pojma kislin na snovi, ki vsebujejo vodik, resno moti sistematično razumevanje kemije, in je podobno omejevanju oksidacijskih procev izključno na snovi, ki vsebujejo kisik«.[13] Po Lewisovi teoriji tvorita kislina A in baza B: adukt AB, v katerem se elektronski par uporabi za tvorbo dativne kovalentne vezi med A in B. Trditev ponazarja tvorba adukta H3N-BF3 iz amonijaka in borovega trifluorida, ki v vodnem mediju ne more poteči zaradi burne reakcije BF3 z vodo:

- BF3 + 3H2O → B(OH)3 + 3HF
- HF ⇌ H+ + F-
Iz reakcij je razvidno, da se BF3 obnaša kot kislina tako po Lewisovi kot po Bronstedov-Lowryjevi teoriji, kar potrjuje skladnost obeh teorij.
Borova kislina, ki se lahko zapiše kot H3BO3 ali B(OH)3, je Lewisova kislina zaradi naslednje reakcije:
- B(OH)3 + H2O ⇌ B(OH)−
4 + H+
Borova kislina v tem primeru ne disociira in deluje kot baza, voda pa disociira. Raztopina B(OH)−
4 je kisla, ker se v reakciji sprosti vodikov H+ ion.
Obstajajo trdni dokazi, da razredčene vodne raztopine amonijaka vsebuje zanemarljivo majhne količine amonijevega iona, se pravi da hidroliza amonijaka ne poteka
- H2O + NH3 ≠ OH- + NH+
4
in da amonijak, raztopljen v vodi, deluje kot Lewisova baza.[14]
Primerjava z Lux-Floodovo teorijo
[uredi | uredi kodo]Reakcij nekaterih oksidov v nevodnih medijih ni mogoče razložiti z Brønsted–Lowryjevo teorijo. Reakcija
- 2MgO + SiO2 → Mg2SiO4
ne sodi na Brønsted–Lowryjevo področje kislin in baz. V vodnem mediju je MgO bazičen, SiO2 pa kisel:
- 2H+ + MgO(s) → Mg+
2(aq) + 2H2O - SiO2(s) + 2H2O → SiO4−
4 + 4H+ (≡ Si(OH)4(aq)).
Lux-Floodova teorija uvršča MgO med baze tudi v nevodnih okoljih, kar je zlasti pomembno v geokemiji. Minerali kot je na primer olivin ((Mg,Fe)SiO4), ki se razvršča med ultramafične minerale, je spojina zelo bazičnega MgO in kislega silicijevega dioksida SiO2.
Sklici
[uredi | uredi kodo]- ↑ R.H. Petrucci, W.S. Harwood, F.G. Herring (2002). General Chemistry. 8. izdaja. Prentice-Hall. str. 666.
- ↑ G.L. Miessler, D.A. Tarr (1998). Inorganic Chemistry. 2. izdaja. Prentice-Hall. str. 154.
- ↑ R. Myers (2003). The Basics of Chemistry. Greenwood Publishing Group. str. 157–161. ISBN 978-0-313-31664-7.
- ↑ W. Masterton, C. Hurley, E. Neth (2011). Chemistry: Principles and Reactions. Cengage Learning. str. 433. ISBN 1-133-38694-6.
- ↑ D. Ebbing, S.D. Gammon (2010). General Chemistry, Enhanced Edition. Cengage Learning. str. 644–645. ISBN 0-538-49752-1.
- ↑ K. Whitten, R. Davis, L. Peck, G. Stanley (2013). Chemistry. Cengage Learning. str. 350. ISBN 1-133-61066-8.
- ↑ K. Lew (2009). Acids and Bases. Infobase Publishing. ISBN 9780791097830.
- ↑ G. Patrick (2012). Instant Notes in Organic Chemistry. Taylor & Francis. str. 76. ISBN 978-1-135-32125-3.
- ↑ A,K. Holliday, A.G. Massy (1965). Inorganic Chemistry in Non-Aqueous Solvents. Pergamon Press.
- ↑ Bordwell pKa Table (Acidity in DMSO). Pridobljeno 19. novembra 2014.
- ↑ T.C. Waddington (1965). Non-Aqueous Solvent Systems. New York: Academic Press.
- ↑ G.L. Miessler, D.A. Tarr (1991). Inorganic Chemistry. 2. izdaja. Pearson Prentice-Hall. str. 170–172.
- ↑ 13,0 13,1 N.F. Hall (marec 1940). Systems of Acids and Bases. Journal of Chemical Education 17 (3): 124–128. Bibcode: 1940JChEd..17..124H. doi: 10.1021/ed017p124.
- ↑ C.E. Housecroft, A.G. Sharpe (2004). Inorganic Chemistry. 2. izdaja. Prentice Hall. str. 187. ISBN 978-0130399137.
