Grafit
| Grafit | |
|---|---|
 Grafit | |
| Splošno | |
| Kategorija | I Samorodne prvine |
| Kemijska formula | C |
| Lastnosti | |
| Barva | Jekleno črn do siv |
| Kristalni habit | Ploščat, luskast, zrnat ali masiven |
| Kristalni sistem | Heksagonalnil (6/m 2/m 2/m) |
| Razkolnost | Popoln v eni smeri |
| Lom | Luskast, na nerazkolnih ploskvah grob |
| Trdota | 1–2 |
| Sijaj | Kovinski, moten |
| Barva črte | Črna |
| Gostota | 2,09–2,23 g/cm3 |
| Lomni količnik | Neprozoren |
| Pleohroizem | Brez |
| Topnost | V raztaljenem niklju |
| Sklici | [1][2] |
Grafit je ena od štirih alotropskih modifikacij ogljika. Alotropija je namreč pojav, ko se element pojavlja v več kristalnih oblikah; ogljik se poleg grafita pojavlja še kot diamant, fuleren in grafen. Diamant kristalizira v kubičnem kristalnem sistemu, fulereni pa imajo zanimivejšo zgradbo, najbolj podobno nogometni žogi, kjer se v ogrodju izmenjujejo petčlenski in šestčlenski obroči.
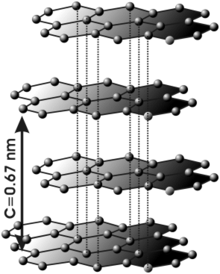
Grafit kristalizira v heksagonalnem (šesterokotnem) kristalnem sistemu, posamezni šesterokotniki pa se razporedijo v ravne plasti. Atome ogljika v plasteh usmerjajo trije atomi vezani s sp2 elektronskimi vezmi, medtem ko je pz elektron umeščen med plasti kristala kar daje grafitu električno prevodnost. Plasti vežejo med sabo le Van der Waalsove vezi, ki pa so seveda šibke, grafit pa se zaradi tega lušči po ploskvah.
Grafit se uporablja za svinčnike, maziva, talilne lonce, za elektrode in kot moderator v jedrskih reaktorjih. Poleg tega so zelo uporabna ogljikova vlakna, ker imajo sorazmerno visoko natezno trdnost in so zelo obstojna. Dobimo jih pri segrevanju akrilnih vlaken v inertni atmosferi. Uporabljajo se za ojačitev v kompozitnih materialih (npr. za turbinske lopatice).
Saje, oglje in koks dobimo pri segrevanju organskih snovi, kot so les, kosti in premog brez dostopa zraka pri 1000 °C. Mikrokristaliničen ali deloma amorfen ogljik lahko pretvorimo v elektropečeh v grafit:
Najprej:
- oglje + Si → SiC
nato pri visokih temperaturah (2000 °C) nastane grafit po reakciji:
- SiC → Si + C(grafit).
Vse oblike grafita so pri oksidaciji termodinamsko nestabilne. Nad 1000 °C nastane CO, pod 1000 °C pa nastane CO2.
- C + O2 → CO2
- 2 C + O2 → 2 CO
Pri visokih temperaturah ogljik reducira druge nekovine in vodno paro. Ta reakcija je bila v preteklosti glavni vir vodika:
- C + H2O => CO + H2 (1000 °C)
Zaradi plastovite strukture grafita lahko med njegove plasti vrinemo različne ione in dobimo interkalacijske spojine. Vgrajena kisik oziroma fluor zmanjšata prevodnost medtem ko kalij, brom, jod ali halogenidi FeCl3, povečajo prevodnost zaradi vključitve dodatnih elektronov v prevodni pas.
Tališče grafita je 3500 °C (diamant: 3700).
Gostota 2,22 g/cm3 (diamant:3,51) .
Kdor bi rad ravnal zelo potratno naj segreva diamant v odsotnosti zraka pri 1500 °C in tako pridobi grafit. Veliko uporabnejši je obratni postopek, ko pri visoki temperaturi (2400 °C) in visokem pritisku iz grafita pridobimo diamant. Kot katalizator uporabimo krom, nikelj. Umetni diamanti so majhni, uporabljajo se v glavnem kot abrazivi za izdelavo brusov in vrtalnih glav.
