Zaviralci tirozin kinaze BCR-ABL
Zaviralci tirozin kinaze BCR-ABL so skupina učinkovin, ki se uporabljajo pri zdravljenju kronične mieloične levkemije (KML) in nekaterih drugih vrst raka.[1] Tirozin kinaza BCR-ABL je produkt onkogena BCR-ABL in deluje kot konstitutivno aktivna citosolna tirozin kinaza, ki je patogenetski dejavnik pri kronični mieloični levkemiji in pri akutni limfoblastni levkemiji, kadar je prisoten kromosom Filadelfija.[2] V več kot 90 % primerov kronične mieloične levkemije je prisotna kromosomska anomalija, pri kateri pride do tvorbe omenjenega kromosoma Filadelfija (s translokacijo med kromosomoma 9 in 22[2]). To je prvi odkril Peter Nowel leta 1960.[3] Do leta 2001, ko so odobrili imitinib, ni bilo na tržišču nobenega zdravila, ki bi vplivalo na napredovanje KML. Uporabljali so le citotoksične učinkovine, kot sta busulfan in hidroksisečnina, in interferon alfa. Imitinib je kot prvo zdravilo iz skupine zaviralcev tirozin kinaze BCR-ABL veljal za velkik preboj v zdravljenju KML, vendar so razvili kasneje novejše učinkovine, ki izkazujejo boljši profil odpornosti, ki jo lahko razvijejo bolniki proti imitinibu.[4]
Pri uporabi zaviralcev tirozin kinaze BCR-ABL se lahko med drugim pojavijo neželeni učinki, povezani s citopenijami, srčnim popuščanjem in hipotiroidizmom.[5]
Mehanizem delovanja[uredi | uredi kodo]
Onkoprotein, ki je produkt onkogena BCR-ABL, ima lastnosti encima tirozin kinaze. Tirozin kinaza fosforilira substratne beljakovine, ki sprožijo aktivacijo številnih znotrajceličnih signalnih poti, ki odijo do rakaste preobrazbe celic (spremenjena proliferacija, adhezija in nesmrtnost levkemičnih celic).[6]
Prva generacija učinkovin[uredi | uredi kodo]

Imatinib (pod zaščitenim imenom Gleevec) so odkrili leta 1992[7] in je prva učinkovina iz skupine zaviralcev tirozin kinaz, ki so jo odobrili za zdravljenje KML. Velja za predstavnika prve generacije učinkovin iz te skupine. Med razvojem imatiniba kristalna struktura kirozin kinaze Bcr-Abl še ni bila poznana.[8] Z visokozmogljivostnim rešetanjem zbirk kemijskih spojin so prišli do spojine vodnice, pirimidina A, ter nato s preskusi in modificiranjem molekule razvili imatinib.[9] Z zamenjavo imidazolne skupine z benzamidno skupino v molekuli se je povečala specifičnost učinkovine, pri čemer je aktivnost ostala enaka. Z vpeljavo metilnega substituenta na orto-mesto pirimidil-aminske skupine so povečali še aktivnost.[10] Imatinib kot zaviralec kinaze BCR-ABR prve generacije izkazuje zelo visoko učinkovitost in nizko stopnjo relapsov pri bolnikih s KML, vendar pa se pri nekaterih bolnikih razvije odpornost proti zdravilu, nekateri pa zdravila ne morejo prenašati.[4]
Vezava[uredi | uredi kodo]

Preskusi z rentgensko kristalografijo so razkrili, da se imatinib veže na domeno Abl, ko je le-ta v neaktivni oziroma zaprti konformaciji.[11] Na domeno Abl se veže s šestimi vodikovimi vezmi. Imatinib na vezavnem mestu prepreči dostop ATP-ju.[10][7][11]
Odpornost[uredi | uredi kodo]
Odpornost proti imitinibu je bil poglavitni razlog za nadaljnji razvoj učinkovin iz skupine zaviralcev kinaze BCR-ABL. Namreč že kmalu po utrženju imatiniba so pričeli raziskovalci poročati o in vitro pridobljenih celičnih linijah, ki izkazujejo odpornost proti imatinibu.[12] Sledila so poročila tudi o prvih primerih odpornosti proti zdravilu v klinični praksi.[13]
Vzrokov za pojav odpornosti na zdravljenje z zaviralci kinaze BCR-ABL je več, najpomembnejša dejavnika pa sta klonska evolucija in pojav točkovnih mutacij in sta medsebojno povezana. Pri bolnikih s KML, odporno na zdravljenje z imatinibom, so ugotovili že več kot 90 točkovnih mutacij, ki povzročajo spremembe aminokislin na 57 mestih v genu ABL1.[14] Posebej pomembna je mutacija T315I, ki povzroča odpornost tudi proti nekaterim predstavnikom druge generacije zaviralcev kinaze BCR-ALB.[15] Gre za zamenjavo treonina z izolevcinom na položaju 315, pri čemer je odstranjen kisik, ki je na tem mestu bistven za tvorbo vodikove vezi med imatinibom in kinazo BCR-ALB.[13]
Lahko pride tudi do povečanega izražanja gena BCR-ABL, lahko pa odpornost povzročijo mehanizmu, ki niso povezani z genom BCR-ABL, kot sta akticavija določenih drugih signalnih poti v celicah (na primer signalnih poti, povezanih s kinazami iz družine Src) ter povečano izplavljanje učinkovine iz celic.[4]
Druga in tretja generacija[uredi | uredi kodo]
Zaradi pojava odpornosti proti imatinibu pri nekaterih bolnikih s KML, pa tudi primerov neprenašanja zdravila,[16] je bila potreba po razvoju novejših zaviralcev kinaze BCR-ABL.[17] Na trg so prišli predstavniki druge generacije zaviralcev kinaze BCR-ABL (nilotinib, dasatinib, bosutinib), s katerimi so premagali večino primerov odpornosti (razen v primeru mutacije T315I).[18] Ponatinib, predstavnik tretje generacije zaviralcev kinaze BCR-ABL, je učinkovit tudi pri bolnikih z mutacijo T315I.[16]
Pregled učinkovin[uredi | uredi kodo]
| Učinkovina | Struktura | Vodikove vezi | Aminokisline, ki tvorijo H-vezi | Konformacija ob vezavi | Način razvoja/odkritja |
|---|---|---|---|---|---|
| Imatinib (STI571) | 
|
6 | Met-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | neaktivna | rešetanje |
| Nilotinib (AMN107) | 
|
4 | Met-318, Thr-315, Glu-286, Asp-381 | neaktivna | racionalno načrtovanje |
| Dasatinib (BMS-345825) | 
|
3 | Met-318, Thr-315 | aktivna | racionalno načrtovanje |
| Bosutinib (SKI-606) | 
|
- | - | neaktivna | racionalno načrtovanje |
| Ponatinib (AP-24534) | 
|
5 | Met-318, Asp-381, Glu-286, His-381, Ile-380 | neaktivna | racionalno načrtovanje |
| Bafetinib (INNO-406) | 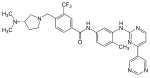
|
6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | neaktivna | racionalno načrtovanje |
Sklici[uredi | uredi kodo]
- ↑ https://www.termania.net/slovarji/slovenski-medicinski-slovar/5544860/zaviralec?query=zaviralec&SearchIn=All Slovenski medicinski e-slovar, vpogled: 22. 10. 2021.
- ↑ 2,0 2,1 https://www.termania.net/slovarji/slovenski-medicinski-slovar/5541707/tirozin_kinaza?query=tirozin+kinaza&SearchIn=All Slovenski medicinski e-slovar, vpogled: 27. 10. 2021.
- ↑ Nowell, Peter; Hungerford, David (1960). »A minute chromosome in human chronic granulocytic leukaemia«. Science. 132: 1497.
- ↑ 4,0 4,1 4,2 An, X.; Tiwari, A.; Sun, Y.; Ding, P.; Ashby Jr, C.; Chen, Z. (2010). »BCR-ABL tyrosine kinase inhibitors in the treatment of Philadelphia chromosome positive chronic myeloid leukemia: a review«. Leukemia Research. 34 (10): 1255–1268. doi:10.1016/j.leukres.2010.04.016. PMID 20537386.
- ↑ Mencinger, Marina (2018). Stranski učinki ob zdravljenju rakavih bolezni z zaviralci tirozinskih kinaz. Onkologija (Ljubljana), letnik 22, številka 1, str. 24-27.
- ↑ Glaser M., Grmek-Zemljič T., Borin P. Naše izkušnje pri zdravljenju kronične mieloične levkemije z imatinib mesilatom. ZDRAV VESTN 2004; 73: 207–210.
- ↑ 7,0 7,1 Eck, M.; Manley, P. (2009). »The interplay of structural information and functional studies in kinase drug design: insights from BCR-Abl«. Current Opinion in Cell Biology. 21 (2): 288–295. doi:10.1016/j.ceb.2009.01.014. PMID 19217274.
- ↑ Buchanan, S. G. (2003) "Protein structure: discovering selective protein kinase inhibitors". Targets: 101-108.
- ↑ Mandal, S.; Moudgil, M.; Mandal, S. (2009). »Rational drug design«. European Journal of Pharmacology. 625 (1–3): 90–100. doi:10.1016/j.ejphar.2009.06.065. PMID 19835861.
- ↑ 10,0 10,1 Manley, P.W., Cowan-Jacob, S. W., Buchdunger, E., Fabbro, D., Fendrich, G., Furet, P., Meyer, T. and Zimmermann, J. (2002). "Imatinib: a selective tyrosine kinase inhibitor". European Journal of Cancer: S19-S27.
- ↑ 11,0 11,1 Asaki, T.; Sugiyama, Y.; Hamamoto, T.; Higashioka, M.; Umehara, M.; Naito, H.; Niwa, T. (2006). »Design and synthesis of 3-substituted benzamide derivatives as Bcr-Abl kinase inhibitors«. Bioorganic & Medicinal Chemistry Letters. 16 (5): 1421–1425. doi:10.1016/j.bmcl.2005.11.042. PMID 16332440.
- ↑ Mahon (1. avgust 2000). »Selection and characterization of BCR-ABL positive cell lines with differential sensitivity to the tyrosine kinase inhibitor STI571: Diverse mechanisms of resistance«. Blood. 96 (3): 1070–9. doi:10.1182/blood.V96.3.1070. PMID 10910924.
- ↑ 13,0 13,1 Bixby, D., Talpaz, M. (2009). "Mechanisms of resistance to tyrosine kinase inhibitors in chronic myeloid leukemia and recent therapeutic strategies to overcome resistance". Hematology: 461-476.
- ↑ Pajič T. s sod. Analiza mutacij v kinazni domeni proteina BCR-ABL1 pri bolnikih s kronično mieloično levkemijo. Zdrav Vestn 2012; 81 supl 2: II-174–9.
- ↑ Napaka pri navajanju: Neveljavna oznaka
<ref>; sklici, poimenovaniStein2010, ne vsebujejo besedila (glej stran pomoči). - ↑ 16,0 16,1 Jabbour E., Kantarjian H., Cortes J. Use of Second- and Third-Generation Tyrosine Kinase Inhibitors in the Treatment of Chronic Myeloid Leukemia: An Evolving Treatment Paradigm. Clin Lymphoma Myeloma Leuk. 2015 Jun; 15(6): 323–334. Published online 2015 Mar 24. doi: 10.1016/j.clml.2015.03.006.
- ↑ Tauchi T., Ohyashiki K. The second generation of BCR-ABL tyrosine kinase inhibitors. Int J Hematol. 2006 May;83(4):294-300. doi: 10.1532/IJH97.06025.
- ↑ Rossari, F., Minutolo, F. & Orciuolo, E. Past, present, and future of Bcr-Abl inhibitors: from chemical development to clinical efficacy. J Hematol Oncol 11, 84 (2018). https://doi.org/10.1186/s13045-018-0624-2.
