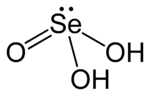
Selenasta kislina
| |

| |
| Imena | |
|---|---|
| IUPAC ime
selenasta kislina
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.067 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| H2SeO3 | |
| Molska masa | 128,97 g/mol |
| Videz | beli higroskopni kristali |
| Gostota | 3,0 g/cm3 |
| Tališče | pri 70 °C razpade |
| zelo topna | |
| Topnost | topna v etanolu |
| Kislost (pKa) | 2,46, 7,3[2] |
| Sorodne snovi | |
| Drugi anioni | selenova kislina vodikov selenid |
| Drugi kationi | natrijev selenit |
| Sorodne snovi | žveplasta kislina telurasta kislina polonasta kislina |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Selenasta kislina je anorganska spojina s kemijsko formulo H2SeO3 ali natančneje (HO)2SeO.
Priprava in lastnosti[uredi | uredi kodo]
Selenasta kislina je analogna žveplasti kislini. Pripravi se enostavno z raztapljanjem selenovega dioksida v vodi. V trdnem stanju imajo njene molekule zaradi selenovega prostega elektronskega para piramidasto obliko in so med seboj povezane z vodikovimi vezmi. V vodnih raztopinah se obnaša kot dvoprotonska kislina:
- H2SeO3 ⇌ H+ + HSeO−
3 (pKa = 2,62)
- HSeO−
3 ⇌ H+ + HSeO2−
3 (pKa = 8,32)
Je zmeren oksidant, vendar reakcije potekajo počasi. Sama se reducira v elementarni selen. V 1 M H+ poteka naslednja reakcija:
- H2SeO3 + 4H+ + 4e- ⇌ Se + 3H2O (Eθ = +0,74 V),
v 1 M OH- pa:
- SeO32- + 4e- + 3H2O ⇌ Se + 6OH- (Eθ = -0,37 V).
Uporaba[uredi | uredi kodo]
Največ selenaste kisline se porabi za bruniranje jekla, predvsem orožja (osebno strelno orožje in topovi). Za bruniranje se uporablja skupaj z bakrovim(II) nitratom (Cu(NO3)2) in dušikovo kislino (HNO3). Barva jekla se iz srebrno sive spremeni v modro sivo. V preteklosti se je bruniralo tudi hladno orožje.[3]
Uporablja se tudi za kemično temnenje in patiniranje bakra, medenine in brona. Nastala bogata temna barva se lahko kasneje še poudari z abrazijo.
Selenasta kislina je ključna komponenta Meckejevega reagenta, s katerim se na hiter in enostaven način ugotavlja morebitno prisotnosti alkaloidov in drugih spojin, na primer prepovedanih drog.[4]
V organskih sintezah se uporablja za sintezo 1,2-diketonov, na primer glioksala.
Učinki na zdravje[uredi | uredi kodo]
Kot mnoge selenove spojine, je tudi selenova kislina zelo toksična in zaužitje kakršne koli količine kisline je navadno smrtonosno. Simptomi zastrupitve s selenom se pojavijo nekaj ur po zaužitju in vključujejo omamljenost, vrtoglavico, velik padec krvnega tlaka in smrt.[5]
Sklici[uredi | uredi kodo]
- ↑ D.R. Lide (1998). Handbook of Chemistry and Physics. 87. izdaja. Boca Raton, FL: CRC Press. str. 4–81. ISBN 0-8493-0594-2.
- ↑ »Ka and pKa for Polyprotic Acids«. Arhivirano iz prvotnega spletišča dne 18. novembra 2019. Pridobljeno 16. februarja 2015.
- ↑ E.A. Scarlato, J. Higa (28. junij 1990). Uses/High Risk Circumstances of Poissoning "Selenium". Pridobljeno 29. decembra 2010.
- ↑ Mecke Reagent Testing Kit (Red Label) Arhivirano 2013-05-19 na Wayback Machine.. Dancesafe. Pridobljeno 26. januarja 2012.
- ↑ MSDS for Reagent for Special Opiates (Codeine, Heroin, & Morphine)[mrtva povezava]. Sirchie Finger Print Laboratories, Inc. 12. maj 2006.
Viri[uredi | uredi kodo]
- Holleman, A. F.; in sod. (2001). Inorganic Chemistry (1 izd.). San Diego [etc.] : Academic Press ; Berlin ; New York : De Gruyter, cop. COBISS 24318981. ISBN 0-12-352651-5.
- Organic Syntheses 3 (1955): 438.
- Sirchie Finger Print Laboratories, Inc. 1. maj 2006.
