Kalijev oksid
| |
| Imena | |
|---|---|
| IUPAC ime
kalijev oksid
| |
| Sistematično ime
kalijev oksidokalij | |
| Druga imena
dikalijev monoksid, potaša
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.032.012 |
| MeSH | Potassium+oxide |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| K2O | |
| Molska masa | 94,20 g·mol−1 |
| Videz | bledo rumena trdnina |
| Vonj | brez vonja |
| Gostota | 2,32 g/cm3 (20 °C)[1] 2,13 g/cm3 (24 °C)[2] |
| Tališče | 740 °C (1.360 °F; 1.010 K) |
| reagira,[1] pri čemer nastaja KOH | |
| Topnost | topen v etanolu in dietil etru[2] |
| Struktura | |
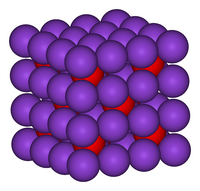
| Kristalna struktura | antifluiritno kubična, pearsonov simbol: cF12[3] |
| Prostorska skupina | Fm3m, No. 225[3] |
a = 6,436 [3] α = 90°, β = 90°, γ = 90°
| |
| Koordinacijska geometrija |
tetraedrična (K+) kubična (O2−) |
| Termokemija | |
| Specifična toplota, C | 83,62 J/mol·K[4] |
| Standardna molarna entropija S |
94,03 J/mol·K[4] |
Std tvorbena
entalpija (ΔfH⦵298) |
−363,17 kJ/mol[1][4] |
Gibbsova prosta energija (ΔfG˚)
|
−322,1 kJ/mol[1] |
| Nevarnosti | |
| Glavne nevarnosti | koroziven, burno reagira z vodo |
| Sorodne snovi | |
| Drugi anioni | kalijev sulfid |
| Drugi kationi | litijev oksid natrijev oksid rubidijev oksid cezijev oksid |
| Sorodno kalijevi oksidi | kalijev peroksid kalijev superoksid |
| Sorodne snovi | kalijev hidroksid |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Kalijev oksid je anorganska spojina s formulo K2O. Oksid je bledo rumena trdnina, ki je zaradi velike reaktivnosti slabo obstojna. Vsebnost kalija v nekaterih snoveh, na primer v umetnih gnojilih, se pogosto izraža v ekvivalentih K2O.
Sinteza[uredi | uredi kodo]
Kalijev oksid se pripravlja z reakcijo kalija s kisikom. V reakciji nastane najprej kalijev peroksid (K2O2), ki reagira s kalijem in se pretvori v oksid: [5]
- 2K + O2 → K2O2
- K2O2 + 2K → 2K2O
Druga, bolj prikladna, je sinteza s segrevanjem kalijevega nitrata s kovinskim kalijem:
- 2KNO3 + 10K → 6K2O + N2
Kalijev hidroksid se ne da dehidrirati v kalijev oksid, lahko pa reagira z raztaljenim kalijem, pri čemer nastaneta kalijev oksid in vodik:
- 2KOH + 2K → 2K2O + H2
Lastnosti in reakcije[uredi | uredi kodo]
Kalijev oksid kristalizira a antifluoritni kubični strukturi, se pravi da so položaji anionov in kationov ravno obratni kot v kalcijevem fluoridu: kalijevi ioni so koordinirani s štirimi oksidnimi ioni, oksidni ioni pa z osmimi kalijevimi ioni.[6][7]
K2O je bazičen oksid in burno reagira z vodo v kalijev hidroksid. Je higroskopen in živahno reagira tudi z vlago iz zraka.
Uporaba[uredi | uredi kodo]
Kemijska formula K2O (ali enostavneje K) se uporablja v več kontekstih: kot N-P-K v umetnih gnojilih in kot K v industriji cementa in stekla. V teh proizvodih v resnici ni prisoten K2O, ker ni obstojen, ampak kakšna druga kalijeva spojina, na primer kalijev karbonat. Razlog za takšno izražanje vsebnosti je različna vsebnost kalija v njegovih spojinah: v K2O ga je 83 %, v KCl pa samo 52 %. Če umetno gnojilo vsebuje 30 % KCl, je standardna vsebnost kalija, izraženega s kalijevim oksidom, enaka 18,8 %.
Sklici[uredi | uredi kodo]
- ↑ 1,0 1,1 1,2 1,3 1,4 K.R. Anatolievich. Potassium oxide. Pridobljeno 4. julija 2014.
- ↑ 2,0 2,1 2,2 D.R. Lide, urednik (2009). CRC Handbook of Chemistry and Physics. 90. izdaja. Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ↑ 3,0 3,1 3,2 R.W.G. Wyckoff (1935). The Structure of Crystals. 2. izdaja, str. 25. Reinhold Publishing Corp., American Chemical Society.
- ↑ 4,0 4,1 4,2 Dipotassium oxide. Pridobljeno 4. julija 2014.
- ↑ Holleman, A. F.; in sod. (2001). Inorganic Chemistry (1 izd.). San Diego [etc.] : Academic Press ; Berlin ; New York : De Gruyter, cop. COBISS 24318981. ISBN 0-12-352651-5.
- ↑ E. Zintl, A. Harder, B. Dauth (1934). Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums. Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie 40: 588–593.
- ↑ A.F. Wells (1984). Structural Inorganic Chemistry (5 izd.). Oxford: Clarendon Press. COBISS 621359. ISBN 0-19-855370-6.
