Sulfat: Razlika med redakcijama
m slog, jezikovne povezave |
Uporaba, zgodivina, vpliv na okolje |
||
| Vrstica 32: | Vrstica 32: | ||
Paulingova uvedba d orbital je izzvala polemiko o relativni pomembnosti π vezi in polarnosti (elektrostatskega privlaka) pri skrajšanju vezi S-O. Rezultat polemike je bilo splošno soglasje, da d orbitale sodelujejo pri tvorbi vezi, vendar njihova vloga ni tako pomembna, kot je menil Pauling.<ref>C. A. Coulson, Nature, 221, 1106 (1969)</ref><ref>K. A. R. Mitchell, Chem. Rev., 69, 157 (1969)</ref> Na koncu je bila sprejeta struktura z vezmi pπ - dπ, ki jih je prvotno predlagal D.W.J. Cruickshank, v kateri se popolnoma zasedene p orbitale kisika prekrivajo s praznimi d orbitalami žvepla (predvsem ''d''<sub>''z''<sup>2</sup></sub> and ''d''<sub>''x''<sup>2</sup>-''y''<sup>2</sup></sub>).<ref>Cotton, F. A., Wilkinson, G. (1966). ''Advanced Inorganic Chemistry (2d Edn.). New York:Wiley.</ref> V tem opisu ima vez S-O nekaj značilnosti π vezi, vendar je še vedno izrazito ionska. Takšna razlaga se še vedno navaja tudi v nekaterih sodobnih učbenikih.<ref>Cotton, F.A., Wilkinson, G., Murillo, C.A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5</ref><ref name = greenwood>{{Greenwood&Earnshaw}}</ref> |
Paulingova uvedba d orbital je izzvala polemiko o relativni pomembnosti π vezi in polarnosti (elektrostatskega privlaka) pri skrajšanju vezi S-O. Rezultat polemike je bilo splošno soglasje, da d orbitale sodelujejo pri tvorbi vezi, vendar njihova vloga ni tako pomembna, kot je menil Pauling.<ref>C. A. Coulson, Nature, 221, 1106 (1969)</ref><ref>K. A. R. Mitchell, Chem. Rev., 69, 157 (1969)</ref> Na koncu je bila sprejeta struktura z vezmi pπ - dπ, ki jih je prvotno predlagal D.W.J. Cruickshank, v kateri se popolnoma zasedene p orbitale kisika prekrivajo s praznimi d orbitalami žvepla (predvsem ''d''<sub>''z''<sup>2</sup></sub> and ''d''<sub>''x''<sup>2</sup>-''y''<sup>2</sup></sub>).<ref>Cotton, F. A., Wilkinson, G. (1966). ''Advanced Inorganic Chemistry (2d Edn.). New York:Wiley.</ref> V tem opisu ima vez S-O nekaj značilnosti π vezi, vendar je še vedno izrazito ionska. Takšna razlaga se še vedno navaja tudi v nekaterih sodobnih učbenikih.<ref>Cotton, F.A., Wilkinson, G., Murillo, C.A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5</ref><ref name = greenwood>{{Greenwood&Earnshaw}}</ref> |
||
==Uporaba== |
|||
Sulfati so pomembni v kemični industriji in bioloških sistemih: |
|||
* [[Žveplova kislina]] H<sub>2</sub>SO<sub>4</sub> se uporablja kot [[elektrolit]] v [[svinčev akumulator|svinčevih akumulatorjih]]. |
|||
* Nekateri anaerobni mikroorganizmi, na primer tisti, ki živijo ob globokomorskih termalnih dimnikih, uporabljajo sulfate kot akceptorje elektronov. |
|||
* [[Bakrov sulfat]] CuSO<sub>4</sub> je algicid in se kot bordojska brozga uporablja za škropljenje [[vinska trta|vinske trte]]. |
|||
* [[Magnezijev sulfat]] MgSO<sub>4</sub> se uporablja v terapevtskih kopelih. |
|||
* [[Sadra]] CaSO<sub>4</sub>•2H<sub>2</sub>O je naravni [[mineral]], ki se uporablja za proizvodnjo [[mavec|mavca]]. |
|||
* Sulfatni ion je protiion v nekaterih ionskih [[zdravilo|zdravilih]]. |
|||
==Zgodovina== |
|||
Nekatere sulfate so poznali že alkimisti. Imenovali so jih ''vitriolna sol'', slovensko ''galica''. Naziv izhaja iz [[latinščina|latinske]] besede ''vitreolum'' – steklast, ker so takšni nekateri njihovi prozorni [[kristal]]i.<ref>''Inorganic and Theoretical Chemistry'' F.Sherwood Taylor 6th Edition (1942) William Heinemann</ref> Zelena galica je fero sulfat heptahidrat FeSO<sub>4</sub>•7H<sub>2</sub>O, modra galica je bakrov sulfat pentahidrat CuSO<sub>4</sub>•5H<sub>2</sub>O, bela galica pa cinkov sulfat heptahidrat ZnSO<sub>4</sub>•7H<sub>2</sub>O. [[Galun]] je mešani dvojni sulfat s kemijsko formulo <br/>K<sub>2</sub>Al<sub>2</sub>(SO<sub>4</sub>)<sub>4</sub>•24H<sub>2</sub>O, ki je kasneje igral pomembno vlogo v kemični industriji. |
|||
==Vplivi na okolje== |
|||
Sulfati nastajajo kot mikroskopsko veliki delci ([[aerosol]]i) pri zgorevanju fosilnih goriv in biomase, povečujejo kislost [[atmosfera|atmosfere]] in tvorijo [[kisli dež]]. |
|||
====Glavni vplivi na klimo==== |
|||
Glavni neposredni vpliv sulfatov na klimo je razprševanje svetlobe, kar povečuje Zemljin [[albedo]]. Vpliv ni povsem jasen, vendar je zmanjšal sevanje za približno 0,5 W/m<sup>2</sup> v primerjavi s predindustrijskim obdobjem. S tem se je vsaj delno zmanjšal mnogo večji vpliv toplogrednih plinov (okrog 2,4 W/m<sup>2</sup>).<ref>[http://www.grida.no/climate/ipcc_tar/wg1/figspm-3.htm Figure 3: The global mean radiative forcing of the climate system for the year 2000, relative to 1750]. Climate Change 2001: Working Group I: The Scientific Basis. Intergovernmental Panel on Climate Change.</ref> Vpliv ni povsod enak in je občuten prevsem nad velikimi industrijskimi področji. |
|||
Prvi posredni vpliv je [[Twomeyev efekt]].<ref>Twomey, S., Pollution and the planetary albedo, Atmospheric Environment, 8, 1251-1256, 1974. </ref><ref>Twomey, S., The Influence of Pollution on the Shortwave Albedo of Clouds, Journal of the Atmospheric Sciences [http://ams.allenpress.com/archive/1520-0469/34/7/pdf/i1520-0469-34-7-1149.pdf PDF] </ref> Aerosoli sulfatov lahko tvorijo kondenzacijska jedra za nastajanje oblakov, kar poveča število vodnih kapljic, večje število majhnih kapljic pa bolj razprši svetlobo kot manjše število velikih. |
|||
Drugi posredni vpliv, ki je tudi posledica večjega števila kondenzacijskih jeder, je zmanjšano rosenje, večja višina oblakov,<ref>Pincus & Baker 1994</ref> tvorjenje oblakov pri nižjih [[relativna vlažnost|relativnih vlažnostih]] in njihova daljša življenjska doba.<ref>Albrecht 1989</ref> Sulfati lahko vplivajo tudi na razporeditev velikosti delcev, kar lahko vpliva na sevalne lastnosti oblakov na način, ki ni povsem pojasnjen. V drugi posredni vpliv so vključeni tudi kemijski vplivi, na primer raztapljanje topnih plinov in slabo topnih snovi, zmanjšanje [[površinska napetost|površinske napetosti]], ki jo povzročijo organske snovi, in spremembe prestopnih koeficientov.<ref>[http://nenes.eas.gatech.edu/Preprints/Sensitivity_JASPP.pdf Chemical Amplification (or dampening) of the Twomey Effect: Conditions derived from droplet activation theory]. T.A. Rissman, A. Nenes, J.H. Seinfeld.</ref> |
|||
Posredni vplivi imajo verjetno tudi hladilni učinek (okrog 2 W/m<sup>2</sup>), vendar je podatek zelo nezanesljiv. Sulfati torej sodelujejo v globalnem senčenju, ki bi lahko vsaj nekoliko zmanjšalo učinek [[globalno segrevanje|globalnega segrevanja]]. |
|||
==Reference== |
==Reference== |
||
Redakcija: 11:07, 24. julij 2009
Ta članek je za krajši čas rezerviran, saj ga namerava eden izmed sodelavcev v večji meri preurediti. Prosimo vas, da strani v tem času ne spreminjate, saj bi lahko prišlo do navzkrižja urejanj. Če je iz zgodovine strani razvidno, da je zadnjih nekaj dni ni spreminjal nihče, lahko to predlogo odstranite. |

Sulfat v anorganski kemiji je sol žveplove(VI) kisline.
Kemijske lastnosti
Sulfatni ion je večatomski anion z empirično formulo SO42− in molekulsko maso 96,06 dalton. Sestavljen je iz centralnega atoma žvepla, ki je obdan s štirimi enakovrednimi atomi kisika. Razporeditev atomov je tetraedrična z molekularno simetrijo Td. Žveplo je v oksidacijskem stanju 6+, kisik pa 2-, tako da ima sulfatni ion oksidacijsko stanje 2-. Sulfatni ion je konjugirana baza bisulfatnega (hidrogensulfatnega) iona HSO4-, ki je konjugirana baza žveplove(VI) kisline H2SO4. Organski sulfati, na primer dimetil sulfat, so kovalentne spojine in estri žveplove kisline.
Priprava
Ionski sulfati se lahko pripravijo
- z raztapljanjem kovin v žveplovi kislini
- Zn + H2SO4 → ZnSO4 + H2
- z reakcijo med žveplovo kislino in kovinskimi oksidi in hidroksidi
- MgO + H2SO4 → MgSO4 + H2O
- Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
- z oksidacijo kovinskih sulfidov in sulfitov
Lastnosti
Ionski sulfati so precej številni in večinoma dobro topni v vodi. Izjeme so kalcijev, stroncijev in svinčev(II) sulfat, ter barijev sulfat, ki je slabo topen. Najbolj netopen je radijev sulfat.
Za kvalitativno določanje sulfatnega iona se uporabljajo vodotopne barijeve spojine, na primer barijev klorid, ki dajejo v reakciji s sulfatnim ionom belo oborino barijevega sulfata.
Sulfatni ion je lahko ligand, ki se veže ali preko enega kisikovega atoma (monodentat) ali preko dveh kisikovih atomov kot kelat ali kot most.[1] Primer takšnega nevtralnega kompleksa je PtSO4(P(C6H5)3)2, v katerem sulfat deluje kot bidentatni ligand. Vezi kovina-kisik v sulfatnih kompleksih imajo značilne kovalentne lastnosti.
Zgradba in vezi
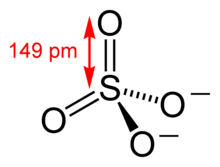
Vez S-O je dolga 149 pm, kar je nekoliko manj, kot bi pričakovali, saj je vez S-OH v žveplovi kislini dolga 157 pm. Sulfatni ion ima po teoriji o odboju elektronskega para valenčne orbitale (VSEPR) [2] obliko tetraedra.
Obliko vezi v sulfatnem ionu je prvi predlagal Gilbert Lewis leta 1916. Opisal jih je z elektronskimi okteti okrog vsakega atoma, se pravi brez dvojnih vezi, in s formalnim nabojem žveplovega atoma 2+.[3]
Linus Pauling je za opis sulfatnega iona uporabil teorijo valenčne vezi in predpostavil, da ima najpomembnejša resonančna zgradba dve π vezi, kateri tvorijo elektroni z d orbital. Njegov zaključek je bil, da je naboj žvepla skladno s principom električne nevtralnosti zato zmanjšan.[4] Skrajšanje vezi na 149 pm je pripisal dvojni vezi.
Paulingova uvedba d orbital je izzvala polemiko o relativni pomembnosti π vezi in polarnosti (elektrostatskega privlaka) pri skrajšanju vezi S-O. Rezultat polemike je bilo splošno soglasje, da d orbitale sodelujejo pri tvorbi vezi, vendar njihova vloga ni tako pomembna, kot je menil Pauling.[5][6] Na koncu je bila sprejeta struktura z vezmi pπ - dπ, ki jih je prvotno predlagal D.W.J. Cruickshank, v kateri se popolnoma zasedene p orbitale kisika prekrivajo s praznimi d orbitalami žvepla (predvsem dz2 and dx2-y2).[7] V tem opisu ima vez S-O nekaj značilnosti π vezi, vendar je še vedno izrazito ionska. Takšna razlaga se še vedno navaja tudi v nekaterih sodobnih učbenikih.[8][1]
Uporaba
Sulfati so pomembni v kemični industriji in bioloških sistemih:
- Žveplova kislina H2SO4 se uporablja kot elektrolit v svinčevih akumulatorjih.
- Nekateri anaerobni mikroorganizmi, na primer tisti, ki živijo ob globokomorskih termalnih dimnikih, uporabljajo sulfate kot akceptorje elektronov.
- Bakrov sulfat CuSO4 je algicid in se kot bordojska brozga uporablja za škropljenje vinske trte.
- Magnezijev sulfat MgSO4 se uporablja v terapevtskih kopelih.
- Sadra CaSO4•2H2O je naravni mineral, ki se uporablja za proizvodnjo mavca.
- Sulfatni ion je protiion v nekaterih ionskih zdravilih.
Zgodovina
Nekatere sulfate so poznali že alkimisti. Imenovali so jih vitriolna sol, slovensko galica. Naziv izhaja iz latinske besede vitreolum – steklast, ker so takšni nekateri njihovi prozorni kristali.[9] Zelena galica je fero sulfat heptahidrat FeSO4•7H2O, modra galica je bakrov sulfat pentahidrat CuSO4•5H2O, bela galica pa cinkov sulfat heptahidrat ZnSO4•7H2O. Galun je mešani dvojni sulfat s kemijsko formulo
K2Al2(SO4)4•24H2O, ki je kasneje igral pomembno vlogo v kemični industriji.
Vplivi na okolje
Sulfati nastajajo kot mikroskopsko veliki delci (aerosoli) pri zgorevanju fosilnih goriv in biomase, povečujejo kislost atmosfere in tvorijo kisli dež.
Glavni vplivi na klimo
Glavni neposredni vpliv sulfatov na klimo je razprševanje svetlobe, kar povečuje Zemljin albedo. Vpliv ni povsem jasen, vendar je zmanjšal sevanje za približno 0,5 W/m2 v primerjavi s predindustrijskim obdobjem. S tem se je vsaj delno zmanjšal mnogo večji vpliv toplogrednih plinov (okrog 2,4 W/m2).[10] Vpliv ni povsod enak in je občuten prevsem nad velikimi industrijskimi področji.
Prvi posredni vpliv je Twomeyev efekt.[11][12] Aerosoli sulfatov lahko tvorijo kondenzacijska jedra za nastajanje oblakov, kar poveča število vodnih kapljic, večje število majhnih kapljic pa bolj razprši svetlobo kot manjše število velikih.
Drugi posredni vpliv, ki je tudi posledica večjega števila kondenzacijskih jeder, je zmanjšano rosenje, večja višina oblakov,[13] tvorjenje oblakov pri nižjih relativnih vlažnostih in njihova daljša življenjska doba.[14] Sulfati lahko vplivajo tudi na razporeditev velikosti delcev, kar lahko vpliva na sevalne lastnosti oblakov na način, ki ni povsem pojasnjen. V drugi posredni vpliv so vključeni tudi kemijski vplivi, na primer raztapljanje topnih plinov in slabo topnih snovi, zmanjšanje površinske napetosti, ki jo povzročijo organske snovi, in spremembe prestopnih koeficientov.[15]
Posredni vplivi imajo verjetno tudi hladilni učinek (okrog 2 W/m2), vendar je podatek zelo nezanesljiv. Sulfati torej sodelujejo v globalnem senčenju, ki bi lahko vsaj nekoliko zmanjšalo učinek globalnega segrevanja.
Reference
- ↑ 1,0 1,1 Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.) Napaka pri navajanju: Neveljavna oznaka
<ref>; sklici, poimenovanigreenwood, so definirani večkrat z različno vsebino (glej stran pomoči). - ↑ Modern Inorganic Chemistry W.L. Jolly ISBN 0-07-032760-2
- ↑ The Atom and the Molecule by Gilbert N. Lewis Journal of the American Chemical Society Volume 38, 1916, pages 762-786
- ↑ The modern theory of valency Linus Pauling J. Chem. Soc., 1948, 1461 - 1467
- ↑ C. A. Coulson, Nature, 221, 1106 (1969)
- ↑ K. A. R. Mitchell, Chem. Rev., 69, 157 (1969)
- ↑ Cotton, F. A., Wilkinson, G. (1966). Advanced Inorganic Chemistry (2d Edn.). New York:Wiley.
- ↑ Cotton, F.A., Wilkinson, G., Murillo, C.A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ↑ Inorganic and Theoretical Chemistry F.Sherwood Taylor 6th Edition (1942) William Heinemann
- ↑ Figure 3: The global mean radiative forcing of the climate system for the year 2000, relative to 1750. Climate Change 2001: Working Group I: The Scientific Basis. Intergovernmental Panel on Climate Change.
- ↑ Twomey, S., Pollution and the planetary albedo, Atmospheric Environment, 8, 1251-1256, 1974.
- ↑ Twomey, S., The Influence of Pollution on the Shortwave Albedo of Clouds, Journal of the Atmospheric Sciences PDF
- ↑ Pincus & Baker 1994
- ↑ Albrecht 1989
- ↑ Chemical Amplification (or dampening) of the Twomey Effect: Conditions derived from droplet activation theory. T.A. Rissman, A. Nenes, J.H. Seinfeld.

