Hessov zakon: Razlika med redakcijama
Uvod, razlaga |
Primeri |
||
| Vrstica 36: | Vrstica 36: | ||
:<math>\Delta H^0 = \sum(\Delta H_{produkti}^0 ) - \sum(\Delta H_{reaktanti}^0)</math> |
:<math>\Delta H^0 = \sum(\Delta H_{produkti}^0 ) - \sum(\Delta H_{reaktanti}^0)</math> |
||
==Uporaba== |
|||
Če poznamo tvorbene entalpija (''ΔH<sub>t</sub>'') vseh reaktantov in produktov, ki sodelujejo v kemijski reakciji, lahko spremembo entalpije reakcije izračunamo z enačbo |
|||
:<math>\Delta H = \Delta H_{t~produktov} - \Delta H_{t~reaktantov}</math> |
|||
Če je reakcija na primer [[gorenje]] (sežig), lahko enačbo priredimo in jo zapišemo kot: |
|||
:<math>\Delta H_{sez} = \Delta H_{sez~produktov} - \Delta H_{sez~reaktantov}</math> |
|||
===Primer enostavnega izračuna=== |
|||
Kakšna je standardna reakcijska entalpija reakcije |
|||
:CH<sub>4</sub>(g) + 2O<sub>2</sub>(g) → CO<sub>2</sub>(g) + 2H<sub>2</sub>O(l)? |
|||
<!--[[Image:Hessex.png|center|Numbers are in KJ.mol<sup>-1</sup>]]--> |
|||
Za izračun potrebujemo standardne tvorbene entalpije vseh reaktantov in produktov: |
|||
{| class="wikitable" |
|||
|- |
|||
! Spojina |
|||
! ΔH<sub>t</sub><sup>0</sup> [kJ mol<sup>-1</sup>] |
|||
|- |
|||
| CH<sub>4</sub>(g) |
|||
| -75 |
|||
|- |
|||
| O<sub>2</sub>(g) |
|||
| 0 |
|||
|- |
|||
| CO<sub>2</sub>(g) |
|||
| -394 |
|||
|- |
|||
| H<sub>2</sub>O(l) |
|||
| -286 |
|||
|} |
|||
'''Izračun:''' |
|||
:ΔH<sup>0</sup><sub>r</sub> = ΔH<sup>0</sup><sub>sež</sub> = [-394 + 2(-286)] - [-75 + 2(0)] = -891 kJ mol-1 |
|||
===Primer bolj zapletenega izračuna=== |
|||
Izračunaj ΔH<sub>r</sub> reakcije: |
|||
* 2B(s) + (3/2)O<sub>2</sub>(g) → B<sub>2</sub>O<sub>3</sub>(s) |
|||
'''Podatki:''' |
|||
* B<sub>2</sub>O<sub>3</sub>(s) + 3H<sub>2</sub>O(g) → 3O<sub>2</sub>(g) + B<sub>2</sub>H<sub>6</sub>(g) ΔH = +2035 kJ |
|||
* H<sub>2</sub>O(l) → H<sub>2</sub>O(g) ΔH = +44 kJ |
|||
* H<sub>2</sub>(g) + (1/2)O<sub>2</sub>(g) → H<sub>2</sub>O(l) ΔH = -286 kJ |
|||
* 2B(s) + 3H<sub>2</sub>(g) → B<sub>2</sub>H<sub>6</sub>(g) ΔH = +36 kJ |
|||
'''Izračun:''' |
|||
Prvo enačbo obrnemo, drugo in tretjo enašbo pa pomnožimo s 3. Zapis bo zdaj izgledal takole: |
|||
* B<sub>2</sub>H<sub>6</sub>(g) + 3O<sub>2</sub>(g) → B<sub>2</sub>O<sub>3</sub>(s) + 3H<sub>2</sub>O(g) ΔH = -2035 kJ |
|||
* 3H<sub>2</sub>O(g) → 3H<sub>2</sub>O(l) ΔH = -132 kJ |
|||
* 3H<sub>2</sub>O(l) → 3H<sub>2</sub>(g) + (3/2)O<sub>2</sub>(g) ΔH = +858 kJ |
|||
*2 B(s) + 3H<sub>2</sub>(g) → B<sub>2</sub>H<sub>6</sub>(g) ΔH = +36 kJ |
|||
Enačbe seštejemo in črtamo izraze, ki so na obeh straneh enačbe enaki. Rezultat je naslednja enačba: |
|||
*2B(s) + (3/2)O<sub>2</sub>(g) → B<sub>2</sub>O<sub>3</sub>(s) ΔH = -1273 kJ |
|||
'''Odgovor:''' |
|||
Reakcijska entalpija ΔH<sub>r</sub>, ki je enaka tvorbeni entalpiji ΔH<sub>t</sub> B<sub>2</sub>O<sub>3</sub>(s), je -1273 kJ. |
|||
{{kemijska škrbina}} |
{{kemijska škrbina}} |
||
| Vrstica 42: | Vrstica 110: | ||
[[Kategorija:Kemijske reakcije]] |
[[Kategorija:Kemijske reakcije]] |
||
[[bs:Hessov zakon]] |
|||
[[bg:Закон на Хес]] |
|||
[[ca:Llei de Hess]] |
|||
[[da:Hess' lov]] |
|||
[[de:Hess'scher Wärmesatz]] |
|||
[[en:Hess's law]] |
[[en:Hess's law]] |
||
[[es:Ley de Hess]] |
|||
[[fa:قانون هس]] |
|||
[[fr:Loi de Hess]] |
|||
[[gl:Lei de Hess]] |
|||
[[ko:헤스의 법칙]] |
|||
[[hr:Hessov zakon]] |
|||
[[id:Hukum Hess]] |
|||
[[it:Legge di Hess]] |
|||
[[he:חוק הס]] |
|||
[[hu:Hess-tétel]] |
|||
[[ms:Hukum Hess]] |
|||
[[ja:ヘスの法則]] |
|||
[[pl:Prawo Hessa]] |
|||
[[pt:Lei de Hess]] |
|||
[[ru:Закон Гесса]] |
|||
[[fi:Hessin laki]] |
|||
[[sv:Hess lag]] |
|||
[[uk:Закон Гесса]] |
|||
[[zh:赫士定律]] |
|||
Redakcija: 18:33, 6. april 2009

Hessov zakon je eden od osnovnih zakonov termodinamike. Ime je dobil po svojemu utemeljitelju, v Švici rojenemu ruskemu kemiku in zdravniku Germainu Henriju Hessu. Zakon obravnava spremembo energije in pravi, da je
- sprememba energije odvisna samo od začetnega in končnega stanja sistema in je neodvisna od poti, po kateri je do spremembe prišlo.
Hessov zakon omogoča izračun energetskih sprememb, ki se jih sicer ne da enostavno izmeriti.
Razlaga
Hessov zakon trdi, da je sprememba energije v vsakem kemičnem ali fizikalnem procesu neodvisna od poti in števila vmesnih korakov, ki so potrebni, da se proces zaključi. Z drugimi besedami to pomeni, da sta za spremembo energije pomembni samo začetno in končno stanje sistema.
Neodvisnost od poti velja tudi za vse druge funkcije, ki so povezane s stanjem sistema, na premer temperaturo in tlak.
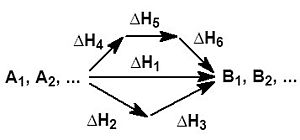
Na zgornji sliki je shematski prikaz kemijske reakcije, v kateri iz reaktantov A1, A2... nastanejo produkti B1, B2... Reakcija lahko poteka po treh različnih poteh, ki imajo različno število korakov. Spremembo energije, bolj pravilno entalpije (ΔH), zapišemo z enačbo:
Hessov zakon omogoča izračunavanje spremembe entalpije tudi takšnih reakcij, katerih spremembe entalpije se ne da izmeriti neposredno. Za takšen izračun je potrebna urejena kemijska enačba ali sistem enačb in poznavanje tvorbenih entalpij (ΔHt)reagentov in reaktantov.
Kemijske enačbe se obnašajo zelo podobno kot matematični sistem linearnih enačb: lahko se delijo ali množijo s celimi števili, seveda pa je treba istočasno deliti ali množiti tudi vrednosti entalpij. Če se smer reakcije obrne, se predznak entalpije spremeni, na primer iz ΔH v –ΔH in obratno.
Če je celotna sprememba entalpije negativna (ΔHr<0), je reakcija eksotermna in obratno: če je sprememba entalpije pozitivna (ΔHr>0), je reakcija endotermna. Za ugotavljanje spontanosti reakcij igra pomembno vlogo entropija, to pa pomeni, da so reakcije lahko spontane četudi je sprememba entalpije pozitivna!
Hessov zakon pravi, da so spremembe entalpije aditivne. Iz tega sledi, da se lahko ΔH posamezne reakcije izračuna iz razlike med tvorbenimi entalpijami produktov in reaktantov. Razliko zapišemo z enačbo:
Za sestavljene ali stopenjske reakcije se malo spremeni oblika zapisa, koncept pa ostane isti:
Uporaba
Če poznamo tvorbene entalpija (ΔHt) vseh reaktantov in produktov, ki sodelujejo v kemijski reakciji, lahko spremembo entalpije reakcije izračunamo z enačbo
Če je reakcija na primer gorenje (sežig), lahko enačbo priredimo in jo zapišemo kot:
Primer enostavnega izračuna
Kakšna je standardna reakcijska entalpija reakcije
- CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)?
Za izračun potrebujemo standardne tvorbene entalpije vseh reaktantov in produktov:
| Spojina | ΔHt0 [kJ mol-1] |
|---|---|
| CH4(g) | -75 |
| O2(g) | 0 |
| CO2(g) | -394 |
| H2O(l) | -286 |
Izračun:
- ΔH0r = ΔH0sež = [-394 + 2(-286)] - [-75 + 2(0)] = -891 kJ mol-1
Primer bolj zapletenega izračuna
Izračunaj ΔHr reakcije:
- 2B(s) + (3/2)O2(g) → B2O3(s)
Podatki:
- B2O3(s) + 3H2O(g) → 3O2(g) + B2H6(g) ΔH = +2035 kJ
- H2O(l) → H2O(g) ΔH = +44 kJ
- H2(g) + (1/2)O2(g) → H2O(l) ΔH = -286 kJ
- 2B(s) + 3H2(g) → B2H6(g) ΔH = +36 kJ
Izračun:
Prvo enačbo obrnemo, drugo in tretjo enašbo pa pomnožimo s 3. Zapis bo zdaj izgledal takole:
- B2H6(g) + 3O2(g) → B2O3(s) + 3H2O(g) ΔH = -2035 kJ
- 3H2O(g) → 3H2O(l) ΔH = -132 kJ
- 3H2O(l) → 3H2(g) + (3/2)O2(g) ΔH = +858 kJ
- 2 B(s) + 3H2(g) → B2H6(g) ΔH = +36 kJ
Enačbe seštejemo in črtamo izraze, ki so na obeh straneh enačbe enaki. Rezultat je naslednja enačba:
- 2B(s) + (3/2)O2(g) → B2O3(s) ΔH = -1273 kJ
Odgovor:
Reakcijska entalpija ΔHr, ki je enaka tvorbeni entalpiji ΔHt B2O3(s), je -1273 kJ.