Stiren
| |
| |
| Imena | |
|---|---|
| Priporočeno IUPAC ime
fenileten | |
| Druga imena
vinilbenzen,
stirol, fenileten, feniletilen, etenilbenzen | |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.002.592 |
| KEGG | |
PubChem CID
|
|
| RTECS število |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C8H8 | |
| Molska masa | 104,15 g/mol |
| Videz | brezbarvna oljnata tekočina |
| Gostota | 0,909 g/cm3 |
| Tališče | −30 °C (−22 °F; 243 K) |
| Vrelišče | 145 °C (293 °F; 418 K) |
| < 1% | |
| Lomni količnik (nD) | 1,5469 |
| Viskoznost | 0,762 cP pri 20 °C |
| Struktura | |
| Dipolni moment | 0,13 D |
| Nevarnosti | |
| Glavne nevarnosti | vnetljiv, strupen |
EU klasifikacija (DSD) (zastarelo)
|
|
| R-stavki (zastarelo) | R10 R36 |
| S-stavki (zastarelo) | S38 S20 (S23) |
| NFPA 704 (diamant ognja) | |
| Plamenišče | 31 °C (88 °F; 304 K) |
| Sorodne snovi | |
| Sorodno stireni, sorodne aromatske spojine |
polistiren, stilben, etilbenzen |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
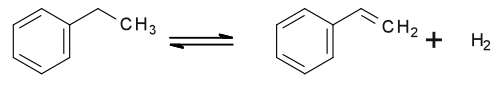
Stiren, znan tudi kot etenilbenzen, vinilbenzen in fenileten, je organska spojina s kemijsko formulo C6H5CH=CH2. Ta derivat benzena je brezbarvna lahko hlapna oljnata tekočina s sladkim vonjem, ki pri visokih koncentracijah postane neprijeten. Stiren je surovina za proizvodnjo polistirena in več kopolimerov. Svetovna proizvodnja stirena je leta 2010 znašala približno 25 milijonov ton.[1]
Nahajališča, zgodovina in raba[uredi | uredi kodo]

Ime je dobil po stirenskem balzamu, naravni smoli, ki jo iz ranjenega lubja izločata drevesi Liquidambar orientalis Mill. (Mala Azija) in Liquidambar styraciflua L. (Srednja Amerika).[2] Smola se pogosto imenuje tudi benzojska smola in je podobna smoli, ki jo izločajo rastline iz družine stiraksovk (Styracaceae).
Količine naravnega stirena so zelo majhne. Pojavlja se v nekaterih rastlinah in hrani, na primer v cimetu, kavnih zrnih in kikirikiju, in premogovem katranu. V čisti obliki so ga pridobili v 19. stoletju z destilacijo naravnega stirenskega balzama.[3]
Proizvodnja stirena z dehidrogeniranjem etilbenzena se je začela v 1930. letih.[3] Kmalu so ugotovili, da je odlična surovina za sintetični gumij, zato je njegova proizvodnja v Združenih državah Amerike že v 1940. letih skokovito narasla.
Polimerizacijo stirena omogoča vinilna skupina –CH=CH2. Tržno pomembni proizvodi so polistiren in kopolimeri ABS (akrilonitril-butadien-stiren), SBR (stirensko-butadienska guma), stirensko-butadienski lateks, SIS (stiren-izopren-stiren), S-EB-S (stiren-eten/buten-stiren), S-DVB (stiren-divinilbenzen), SAN (stiren-akrilonitril) in nenasičeni poliestri, ki se uporabljajo v smolah za toplotno zamreževanje. Proizvodi se uporabljajo za proizvodnjo gume, plastike, izolacij (stiropor), fiberglasa, cevi, avtomobilskih in ladijskih sestavnih delov, posod za hrano in preprog.
Proizvodnja[uredi | uredi kodo]
Stiren se v industrijskem obsegu proizvaja z dehidrogeniranjem etilbenzena, ki se proizvaja z alkiliranjem benzena z etenom.[4]
Katalitsko dehidrogeniranje etilbenzena[uredi | uredi kodo]
Etilbenzen se v plinski fazi pomeša z 10-15 kratnim volumnom pregrete vodne pare in pošlje preko trdnega katalizatorja. Večina katalizatorjev temelji na železovem(III) oksidu, katerega delovanje poboljšajo manjše količine kalijevega oksida in kalijevega karbonata.
Vodna para ima v reakciji več vlog. Je vir toplote, ki žene endotermno reakcijo, in odstranjuje koks (ogljik), ki se nalaga na površino katalizatorja. Pri tem nastajata ogljikov dioksid in vodik. Reakcijo pospešujejo kalijeve spojine. Vodna para tudi redči reaktante in produkte in s tem pomika ravnotežje reakcije proti produktom.
Večina industrijskih naprav je sestavljena iz dveh ali treh zaporedno vezanih vakuumskih reaktorjev. Izkoristek postopka z dvema reaktorjema je približno 65 %, s tremi pa 70-75 %. Vsebnost stirena v produktu je 93-97 %. Glavna stranska produkta sta benzen in toluen.
Ker imata etilbenzen in stiren zelo podobni vrelišči (145 in 136 °C), njuno ločevanje zahteva visoke destilacijske kolone in velik protitok. Stiren med destilacijo rad polimerizira. Polimerizacijo zavira dodatek elementarnega žvepla. V 1970. letih so žveplo zamenjali zaviralci na osnovi nitriranega fenola. Nitrirani fenoli se zaradi nizke cene še vedno uporabljajo, čeprav so v zadnjem času razvili še bolj učinkovite zaviralce polimerizacije.
Sodobne tehnologije se razvijajo v to smer, da bi se etilbenzen zamenjal s kakšno drugo surovino, in da bila konverzija čim bolj selektivna in ločevanje ne bi bilo potrebno.
Sinteza preko etilbenzen hidroperoksida[uredi | uredi kodo]
Stiren se lahko proizvaja tudi skupaj s propilen oksidom v procesu, znanem kot POSM (Lyondell Chemical Company) ali SM/PO (Shell). PO = propilen oksid, SM = stiren monomer. V teh procesih se etilbenzen obdela s kisikom, da tvori etilbenzen hidroperoksid, s katerim se zatem oksidira propen v propilen oksid. Nastali 2-feniletanol se z dehidracijo pretvori v stiren:
Laboratorijske sinteza[uredi | uredi kodo]
Laboratorijske sinteza stirena poteka z dekarboksilacijo cimetove kisline.[5] Stiren se je prvič pripravil po prav tem postopku.[6]
Druge metode[uredi | uredi kodo]
Stiren se lahko proizvede tudi iz toluena in metanola, ki sta cenejša od surovin v konvencionalnih procesih. Proces se zaradi majhne selektivnosti zaradi razpada metanola ni uveljavil.[7] Exelus Inc. trdi, da je postopek razvil do gospodarsko zanimive selektivnosti. Reakcija poteka pri 400-425 °C in atmosferskem tlaku med prepihovanjem reakcijske zmesi skozi ustrezen zeolitski katalizator. Produkt vsebuje zmes stirena in etilbenzena v razmerju 9:1.[8] Izkoristek reakcije je preko 60 %.[9]
Druga možna sinteza poteka iz benzena in etana. Postopek sta razvila Snamprogetti S.p.A. in Dow. Etan se skupaj z etilbenzenom uvjaja v dehidrogenacijski reaktor s katalizatorjem, ki lahko vzporedno proizvaja stiren in eten. Produkti se zatem ohladijo in ločijo. Proces se še nadgrajuje.[10]
Vpliv na zdravje[uredi | uredi kodo]
Stiren spada med nevarne kemikalije, predvsem zaradi škodljivosti stika z očmi, čeprav so nevarni tudi stik s kožo, zaužitje in vdihavanje.[4][11] [12][13] Pri ljudeh se presnavlja večinoma v stiren oksid, ki nastane z oksidacijo s citokromom P450. Stiren oksid se obravnava kot strupen, mutagen in morda karcinogen. Stiren oksid nato encim epoksidna hidrolaza hidrolizira in vivo v stiren glikol.[14]
Ameriška agencija za zaščito okolja (EPA) ga uvršča tudi med »domnevno strupene snovi za prebavila, ledvica in dihala«.[15][16] 10. junija 2011 so ga v ZDA razglasili tudi za zelo verjetnega povzročitelja raka pri ljudeh,[17][18] čeprav znanstvene študije tega ne potrjujejo.[19]
Danski raziskovalci so kljub temu raziskali povezavo med izpostavljenostjo stirenu na delovnem mestu in rakom in zaključili, »da se mora rezultate obravnavati previdno, čeprav morda obstaja povezava med stirenom in okvarami osrednjega živčevja in rakom trebušne slinavke«.[20] Danska agencija za zaščito okolja je pred kratkim zaključila, da do sedaj zbrani podatki ne dokazujejo karcinogenosti stirena.[21]
Karcinogenost stirena se kljub temu še vedno preučuje.[22][23] Njegov škodljiv vpliv na zdravje vsekakor ni sporen, saj dolgotrajna izpostavljenost stirenu povzroča utrujenost, zaspanost, pešanje spomina, glavobole in omotico.[24]
Sklici[uredi | uredi kodo]
- ↑ New Process for Producing Styrene Cuts Costs, Saves Energy, and Reduces Greenhouse Gas Emissions. U.S. Department of Energy.
- ↑ K.-G. Fahlbusch in drugi (2007). Flavors and Fragrances. Ullmann's Encyclopedia of Industrial Chemistry. 7. izdaja. Wiley. Str. 115.
- ↑ 3,0 3,1 D.H. James, W.M. Castor (2007). Styrene. Ullmann's Encyclopedia of Industrial Chemistry. 7. izdaja. Wiley. Str. 1.
- ↑ 4,0 4,1 D.H. James, W.M. Castor (2005). Styrene. Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ↑ T.W. Abbott, J.R. Johnson (1941). Phenylethylene (Styrene). Org. Synth. 1: 440.
- ↑ R. Fittig, F. Binder (1879). Über die Additionsproducte der Zimmtssaure. Untersuchungen über die ungesättigten Säuren. I. Weitere Beiträge zur Kenntnifs der Fumarsäure und Maleïnsäure. Justus Liebigs Annalen der Chemie 195: 56-179. doi: 10.1002/jlac.18791950103.
- ↑ T. Yashima, K. Sato, T. Hayasaka, N. Hara (1972). Alkylation on synthetic zeolites: III. Alkylation of toluene with methanol and formaldehyde on alkali cation exchanged zeolites. Journal of Catalysis 26, 303. doi: 10.1016/0021-9517(72)90088-7.
- ↑ P. Taffe. ICIS.com, 21. januar 2008. The 6th European Aromatics & Derivatives Conference. Antwerpen, Belgija, 14.-15. november 2007.
- ↑ S.K. Ritter. Chemical & Engineering News, 19. marec 2007, str. 46.
- ↑ Styrene/Ethylbenzene 07/08-4 Report. ChemSystems, marec 2009, str. 64-73.
- ↑ Material Safety Data Sheet Styrene (monomer) MSDS Arhivirano 2011-08-07 na Wayback Machine.. Varnostni list. Pridobljeno 11. junija 2011.
- ↑ US EPA (december 1994). OPPT Chemical Fact Sheets (Styrene) Fact Sheet: Support Document (CAS No. 100-42-5). US EPA. Pridobljeno 11. junija 2011.
- ↑ Styrene. ATSDR.
- ↑ K.C. Liebman (1975). Metabolism and toxicity of styrene. Environmental Health Perspectives 11: 115–119. doi: 10.2307/3428333. JSTOR 3428333.
- ↑ EPA settles case against Phoenix company for toxic chemical reporting violations. U.S. Environmental Protection Agency. Pridobljeno 11. februarja 2008.
- ↑ EPA Fines California Hot Tub Manufacturer for Toxic Chemical Release Reporting Violations. U.S. Environmental Protection Agency. Pridobljeno 11. februarja 2008.
- ↑ H. Gardiner (10. junij 2011). Government Says 2 Common Materials Pose Risk of Cancer. New York Times. Pridobljeno 11. junija 2011.
- ↑ National Toxicology Program (10. junij 2011). 12th Report on Carcinogens. National Toxicology Program. Pridobljeno 11. junija 2011.
- ↑ P. Boffetta in drugi (november 2009). Epidemiologic Studies of Styrene and Cancer: A Review of the Literature. J. Occupational and Environmental Medicine 51, 11.
- ↑ H.A. Kolstad, K. Juel, J. Olsen, E. Lynge (maj 1995). Exposure to styrene and chronic health effects: mortality and incidence of solid cancers in the Danish reinforced plastics industry. Occupational and Environmental Medicine 52 (5): 5. doi: 10.1136/oem.52.5.320. PMC 1128224. PMID 7795754.
- ↑ Danish EPA 2011 review.
- ↑ National Toxicology Program's Styrene Page.
- ↑ Monographs on the Evaluation of Carcinogenic Risks to Humans 82 (2002). Some Traditional Herbal Medicines, Some Mycotoxins, Naphthalene and Styrene. Str. 436 - 550.
- ↑ F.X. Prenafeta-Boldu, A. Kuhn, M.A.M. Luykx, H. Anke, J.W. van Gronestijn, J.A.M. de Bont (april 2001). Isolation and characterisation of fungi growing on volatile aromatic hydrocarbons as their sole carbon and energy source, 105 (4): 477-484.